微量元素锰对底栖甲藻热带库里亚藻(Coolia tropicalis)生长及叶绿素荧光特性的影响
2020-05-25刘莎莎陈亨黄凯旋吕颂辉张亮谢学东
刘莎莎, 陈亨, 黄凯旋, 吕颂辉, 张亮, 谢学东
海洋生物学
微量元素锰对底栖甲藻热带库里亚藻()生长及叶绿素荧光特性的影响
刘莎莎1, 2, 陈亨1, 2, 黄凯旋1, 2, 吕颂辉1, 2, 张亮3, 谢学东3
1. 暨南大学赤潮与海洋生物学研究中心, 广东 广州 510632; 2. 水体富营养化与藻华防治广东省普通高校重点实验室, 广东 广州 510632;3. 广东省环境监测中心, 广东 广州 510632
以热带库里亚藻()为研究对象, 在不同锰浓度(0、1、5、10、50μmol·L–1)的人工海水培养15d, 利用叶绿素荧光动力学技术研究了其生长和光合作用对不同锰环境的响应。结果表明: 1)比生长速率()和最大相对电子传递速率(rETRmax)与锰浓度均呈指数关系且对锰胁迫具有相同程度的响应; 2)锰浓度至少大于1μmol·L–1才能维持热带库里亚藻正常的光合作用活性, 当锰浓度低于该浓度时, 光合作用活性(vm)在6d后开始下降, 而单位反应中心吸收光能(ABS/RC)和热能耗散(DI0/RC)升高; 两个反应中心之间的电子传递(E0)及生长并未受影响, 表明此阶段锰缺乏只影响活性光反应中心数量并提高热耗散途径; 当锰缺乏延长至15d时, 胁迫作用显现(0上升)并且电子传递(E0)和生长受到抑制, 这阶段锰缺乏使光反应中心关闭且电子传递受阻; 3)锰缺乏的修复损伤比(/)并未降低, 表明锰缺乏并未影响热带库里亚藻的光保护能力。
锰; 热带库里亚藻; 底栖甲藻; 叶绿素荧光; OJIP曲线
早在20世纪30年代, 锰就被证明是浮游植物生长所必须的元素(Hopkins, 1930)。20世纪50年代, Kessler(1955)进一步指出在无锰条件下生长的绿藻缺乏放氧能力。后续的研究发现, 光合放氧是由光系统Ⅱ (photosystem Ⅱ, PSⅡ)中的放氧复合体(oxygen-evolving complex, OEC)催化完成, 其核心部分是由4个锰原子组成的锰簇(Ferreira et al, 2004), 可以在一些辅助因子的协助下, 将水分子裂解成氧气和氢离子, 并给P680提供电子。锰缺乏会导致细胞分裂减慢、类囊体结构破坏、叶绿素的积累减少, 造成光系统功能缺陷(Allen et al, 2007; Hsieh et al, 2013; Schmidt et al, 2016 ); 一些研究还发现, 赤潮发生时褐囊藻中Mn含量是水体中871倍, 直至赤潮消亡水体中Mn的质量浓度才缓缓回升(杨秀环等, 2000), 其他研究也表明赤潮发生时, 水体中锰含量增幅较大(梁舜华等, 1993; 沈竑等, 1995)。
叶绿素荧光于1984年被发现, 作为一种利用植物体内叶绿素作为天然探针, 快速、灵敏、准确、无损害的监测植物和藻类光合作用性能并分析其保护反应的技术, 其在对植物、藻类等的逆境生理研究中得到了广泛应用(Kumar et al, 2014; Kalaji et al, 2016;Dąbrowski et al, 2016; Li et al, 2019)。近年来, 叶绿素a荧光诱导动力学OJIP分析技术已经成为光合研究领域一个普遍采用的工具(Strasser et al, 2004)。该技术已被应用于锰对光合作用影响的研究中, 主要集中于高等植物, 在硅藻及浮游甲藻中也有所涉及(Strasser et al, 2000; 曹春晖等, 2010; 王木兰等, 2018), 但极少应用于锰对底栖甲藻光合生理的影响研究中。
底栖甲藻(benthic dinoflagellate)是一类生境复杂、生长位置相对固定, 多附着于大型藻类、海草、珊瑚、污泥、岩石等热带和亚热带浅层海洋生物和沉积物表面的甲藻生态类群, 多数具毒性或潜在毒性。它们在破坏海洋环境的同时, 也对水产品食用安全产生了严重威胁, 使海洋渔业遭受损失。近年来, 我国海域赤潮优势种出现由硅藻向甲藻演替的现象(郭皓等, 2015)。作为甲藻生态类群的重要组成部分, 底栖甲藻的研究日益引起人们重视, 已经成为国际有害藻华研究的重要领域之一。热带库里亚藻在我国南海近海均有分布, 已有实验证明库里亚藻产生的毒素对小鼠有毒害作用(梁计林等, 2011; Leung et al, 2017; Larsson et al, 2019)。由于室内培养较为困难, 目前国内对该藻的研究较少, 本研究选用采自海南岛近海的底栖甲藻热带库里亚藻()为研究对象, 通过短期高光损伤和修复实验以及15d的长期培养, 利用叶绿素荧光诱导动力学技术, 分析不同浓度锰对该藻种生长和光合作用的影响, 以期为锰在底栖甲藻中的影响研究提供基础研究数据。
1 材料与方法
1.1 实验材料
实验所用藻种热带库里亚藻分离自海南省琼海市青葛湾培养于f/2培养基(Guillard et al, 1962)加富的天然海水中, 保存于暨南大学赤潮与海洋生物学研究中心恒温培养室。培养温度25℃(±1℃), 培养光强100μmol photons·m–2·s–1, 光暗周期为12h︰12h, 光照强度由照度仪(QSI2100, Biospherical Instrument Inc., USA)测定。
供试试剂为氯化锰(MnCl2·4H2O, 生工 A500331)溶液, 用超纯水配置, 保存于4℃冰箱备用。
1.2 实验方法
将生长在天然海水中处于指数生长期的细胞离心(4000r·min–1)收集后, 重悬于缺乏锰元素的f/2微量元素加富的人工海水(Hutner et al, 1950)中, 反复三次后分装于石英管中(内径70mm, 高度200mm), 每管200mL, 以分批培养方式, 参考硅藻威氏海链藻(王木兰等, 2018)、浮游甲藻米氏凯轮藻(曹春晖等, 2010)等对锰的响应研究中的浓度设计, 随即添加不同浓度的锰溶液使藻液中锰终浓度分别为: 0、1、5、10、50μmol·L–1, 每组设置三个平行样, 置于上述恒温培养室中培养, 整个实验周期为15d, 每3d定时取样, 进行细胞密度、叶绿素荧光各项参数的测定, 并于第15天取样进行快速光响应曲线(rapid light curves, RLCs)以及高光下损伤和修复的测定。
1.3 测定方法
1.3.1 生长测定
藻细胞密度采用血球计数法。细胞比生长速率计算公式为:

式中:为时刻的细胞比生长速率;1和2分别表示1和2时刻的藻细胞密度。
1.3.2 叶绿素荧光参数的测定
OJIP荧光曲线使用掌上水体叶绿素荧光仪(AquaPen-C 100, PSI 公司, 捷克)进行测定, 样品黑暗15min后选取仪器OJIP模块进行测定, 仪器设置饱和光强为3000μmol photons·m–2·s–1, 每个样品测定时间为1秒, 数据由软件FluorPen导出。OJIP各项参数计算参考Strasser等(2000)的方法, 相关参数详见表1。

表1 JIP-测定的相关参数
RLCs曲线使用Phyto-PAM (Walz, Germany)进行测定。设置1、8、16、32、64、164、264、364、464、864、1264、1664、2064μmol photons·m–2·s–1共13个光化光梯度, 每个光化光照射30s, 由获得的有效光化学效率[v′m′=(m′′)/m′]值, 根据公式(2)计算相对电子传递速率(relative electron transport rate, rETR)。

式中PAR (photosynthetically active radiation)为光化光强度。根据Platt等(1980)提出的公式(3)进行拟合:

式中s是与最大相对电子传递速率(maximal relative electron transport rate, rETRmax)相关系数;为光利用率,为光抑制率。当=0时, rETRmax=s; 当>0时,s>rETRmax则rETRmax根据公式(4)得出。

k为半饱和光强, 由公式(5)得出。
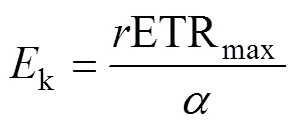
非光化学淬灭(non-photochemical quench, NPQ)由公式(6)计算得出。

式中m为暗适应下所得最大荧光,m′为每个光化光照射下的最大荧光。
1.3.3 损伤和修复的测定
将各浓度处理下的热带库里亚藻分别暴露于1000μmol photons·m–2·s–1强光下60min, 每隔6~12min检测v′m′, 随后进行6h弱光(15μmol photons·m–2·s–1)修复, 每隔30~120min检测v′m′的恢复情况(Guan et al, 2017)。损伤与修复速率根据公式(7)拟合得出(Lesser et al, 1994)。

式中为损伤时间;为修复速率;为损伤速率。
1.4 统计分析

2 结果与分析
2.1 不同浓度锰对热带库里亚藻生长的影响
当锰离子浓度低于5μmol·L–1时,v′m′被显著抑制(<0.05); 而当锰离子浓度高于或等于5μmol·L–1时,v′/m′无明显的差异(>0.05), 表明锰离子浓度至少要大于1μmol·L–1才能维持热带库里亚藻正常光合作用活性(图1b)。当锰浓度为0和1μmol·L–1时, 0~6d的v′/m′出现了先降低后上升的趋势, 但这期间并未影响细胞密度(>0.05); 6天之后的v′/m′快速下降, 与此同时, 细胞密度显著低于其他锰浓度组别(≥5μmol·L–1)。这表明热带库里亚藻可能含有锰离子的储藏库, 在光合作用活性受抑制环境下仍能维持6天正常的比生长率。
选取细胞密度出现显著性差异的第9天计算比生长率, 发现热带库里亚藻的比生长率与锰离子浓度符合方程=0.15233–0.01838e–0.17616x,2=0.99(图2)。锰浓度低于10μmol·L–1的显著低于较高锰浓度组(≥10μmol·L–1)(<0.05), 被视为锰限制环境。
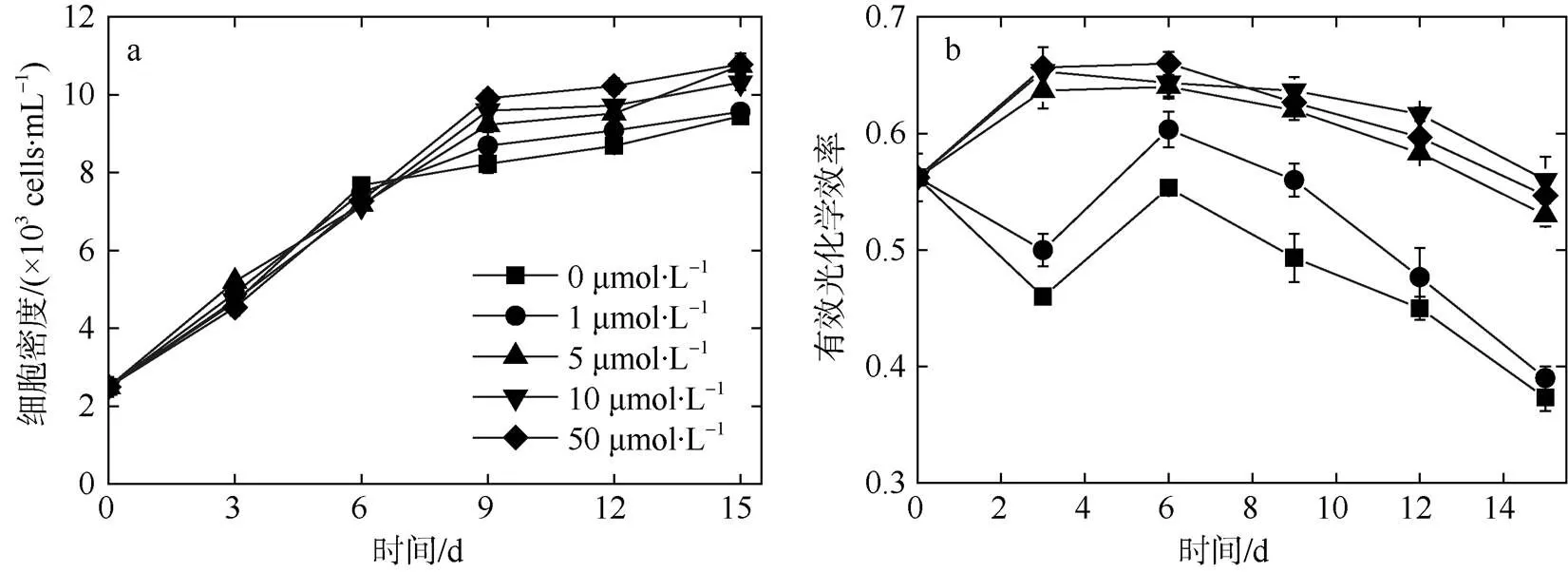
图1 不同浓度锰处理下热带库里亚藻细胞密度(a)及有效光化学效率变化(b)
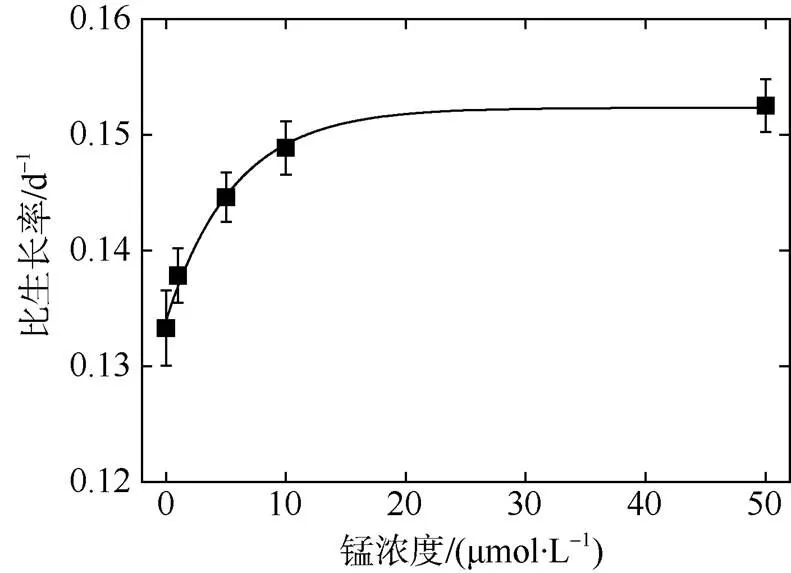
图2 不同浓度锰处理下热带库里亚藻比生长率(μ)
2.2 锰浓度对热带库里亚藻快速光响应曲线(RLCs)的影响
由热带库里亚藻的快速光响应曲线(图3)可以看出, 锰浓度小于5μmol·L–1的rETR在光化光高于8μmol photons·m–2·s–1时也显著低于高锰处理组(≥5μmol·L–1)(<0.05)。与此同时, 低锰浓度(<5μmol·L–1)的NPQ显著高于高锰处理组(≥5μmol·L–1) (< 0.05)。反映细胞的光能利用效率, 其与锰浓度的关系可表示为=0.22–0.08e–0.63x,2=0.94。锰浓度低于5μmol·L–1条件限制细胞对光能的利用(图4c)。rETRmax与锰浓度符合方程=287.78–162.96e–29478x,2=0.96, 代表最大电子传递能力, 低锰条件(<5μmol·L–1)下较低的rETRmax表明光能利用的受限进一步限制了电子传递能力(图4a)。k表示细胞忍受强光的能力, 与锰浓度的关系可由=1571.16–643.41e–0.07x,2=0.97表示, 其值随锰浓度升高而升高, 表明锰添加提高了细胞对强光的耐受(图4b)。
根据图2、4, 计算并对比各项参数与锰浓度曲线的初始斜率和饱和锰浓度(表2), 可观察到对锰浓度最为敏感, 其具有最高初始斜率和最低饱和锰浓度。和rETRmax具有相近的初始斜率, 说明热带库里亚藻生长速率和相对电子传递速率对锰胁迫具有相同程度的响应。但的饱和锰浓度高于rETRmax, 与k相近。这表明可能当锰浓度对于电子传递达到饱和之后, 继续添加的锰浓度可通过提高对光耐受进而提高生长速率。
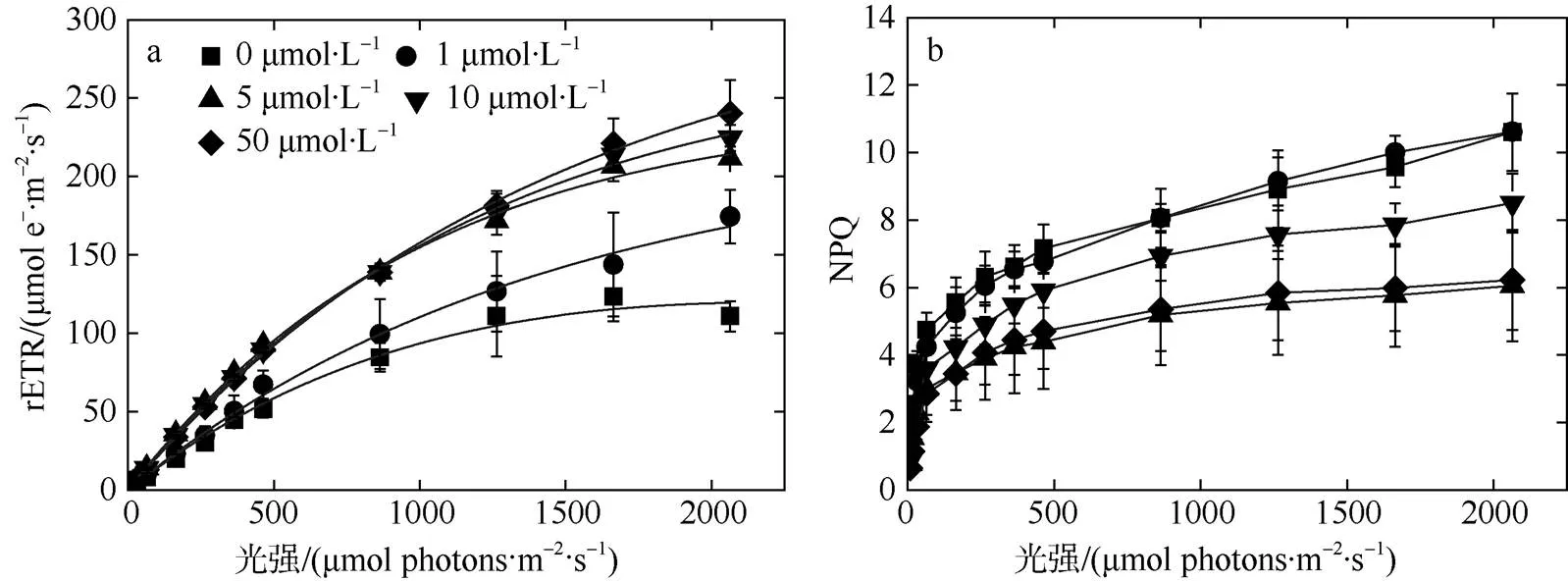
图3 不同浓度锰处理下热带库里亚藻的快速光响应曲线(a)和NPQ(b)

图4 不同浓度锰处理下RLCs中的最大电子传递rETRmax(a), 半光饱和光强Ek(b)和光利用率α(c)

表2 μ, rETRmax, Ek和α拟合曲线的初始斜率及各参数下的饱和锰浓度
2.3 锰对热带库里亚藻OJIP曲线相关参数的影响
由结果可知, 在第6d, 锰浓度组(<5μmol·L–1)v0和v0显著低于锰浓度≥5μmol·L–1组(图5e、f,<0.05)。反应中心供体侧的电子传递并未表现出差异(图5c、d; 图6g), 而ABS/RC和DI0/RC在锰缺乏组均高于高锰组, 并且呈现出随锰浓度上升而降低的趋势。这表明锰缺乏首先降低活性光反应中心的数量, 导致细胞每个反应中心分配到的光能升高, 进而导致热耗散升高(图5b)。
在第15d, 各组0、M0、ABS/RC和DI0/RC均上升且锰浓度<5μmol·L–1组高于其他高锰处理组(≥5μmol·L–1, 图5a、h和图6a、b), 该结果表明细胞的活性光反应中心随培养时间增长继续降低甚至出现胁迫效应(0和0上升)。此外, 锰浓度<5μmol·L–1的VJ和VI显著高于其他高锰处理组(≥5μmol·L–1, 图5c, d), 这表明锰缺乏使由PSII到QA和由QA到QB的电子传递受到抑制(图5g)。
2.4 锰浓度对热带库里亚藻高光下损伤修复的影响
热带库里亚藻接受1h高光照射后, 各组有效光化学效率(图7a)均下降, 后经过6h的弱光修复(图7b)至最终稳定, 0和1μmol·L–1出现了过度修复, 分别达到初始值的103.7%和103.6%, 而50μmol·L–1只恢复到初始的80.4%, 显著低于其他各组(<0.05)。
由高光和弱光处理下的光化学效率拟合后, 得到修复率()和损伤率(), 通过计算修复与损伤比(图8)可得, 5μmol·L–1组/最低, 50μmol·L–1最高, 但各组之间并没有显著性差异。
3 讨论
3.1 锰浓度对热带库里亚藻生长的影响
锰作为放氧复合体(OEC)的组分, 是藻类生长所必须的微量元素。本研究结果显示, 第6天前高锰浓度组(锰浓度≥5μmol·L–1)与低锰浓度组(锰浓度<5μmol·L–1)v′m′差异显著且低锰浓度组有先下降后上升的过程, 即由于锰缺乏而使荧光受到限制; 然而细胞生长在第6天前并未出现显著性差异, 故而这种荧光受到限制时生长未受限制的情况, 推测是由于热带库里亚藻中存在锰储藏库造成的, 且第6天后高锰组细胞生长显著大于低锰组, 由此猜测, 库里亚藻的锰库在6天的时间里逐渐耗尽, 其后该藻密度随着起始锰浓度的增大而增大。在威氏海链藻()对锰的响应研究中同样发现, 高浓度Mn (9μmol·L–1)对其生长有显著促进作用(王木兰等, 2018)。但也有研究表明锰浓度过高或过低都会导致光合速率降低, 抑制藻类生长, 例如, 赤潮藻米氏凯伦藻()细胞密度在锰浓度为10–6~10–2μmol·L–1之间时随锰浓度增大而增大, 但在10–2~100μmol·L–1锰浓度间则随锰浓度的增大而降低(曹春晖等, 2010)。由此可见不同藻对锰的敏感度不同。天然海水中锰浓度较低, 约为5.5×10–4~0.38μmol·L–1(Wang et al, 2019; Pausch 2019), 而本研究中锰浓度为1μmol·L–1时, 生长还处于受限状态, 因而锰将会成为底栖甲藻生长的限制因子, 一旦由于污染等原因锰从外界输入水体, 将极易引发底栖甲藻生长甚至形成赤潮。
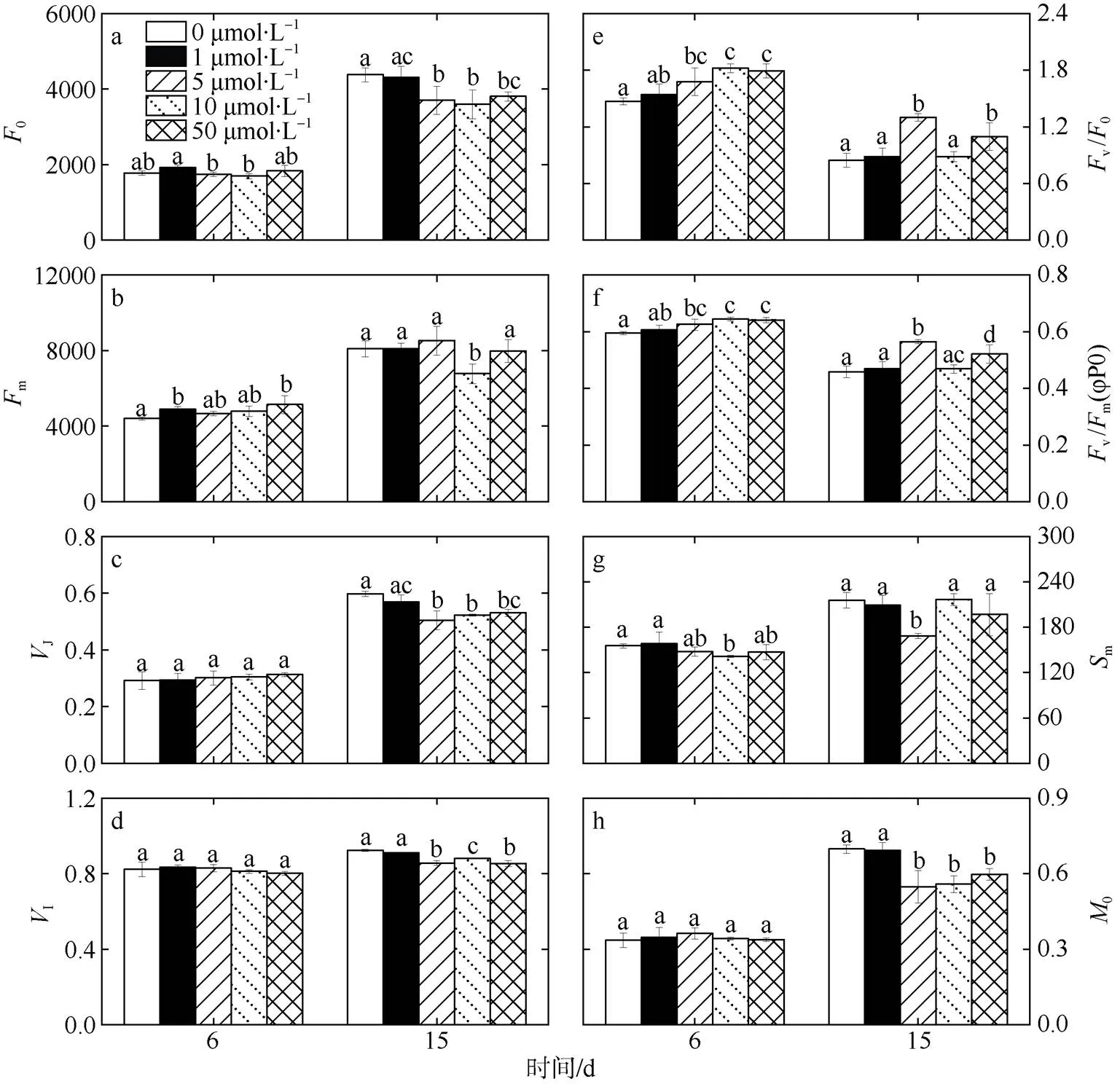
图5 第6和15d不同浓度锰处理下热带库里亚藻的叶绿素荧光参数变化
a.最小荧光值; b.最大荧光值; c. 在 J 点的相对可变荧光强度; d. 在 I 点的相对可变荧光强度; e. PSⅡ 潜在活性; f. 最大光化学效率; g. 标准化后的在 OJIP 荧光诱导曲线和m之间的面积; h. OJIP 荧光诱导曲线的初始斜率; 图中不同字母表示有显著性差异
Fig. 5 Changes of chlorophyll fluorescence induction parameters ofunder different Mn treatment on days 6 and 15. a) minimal fluorescence intensity; b) maximal fluorescence intensity; c) relative variable fluorescence intensity at the J-step; d) relative variable fluorescence intensity at the I-step; e) potential activity of PSⅡ; f) maximal photochemical efficiency; g) normalised total complementary area above the O-J-I-P transie; h) approximated initial slope of the fluorescence transient
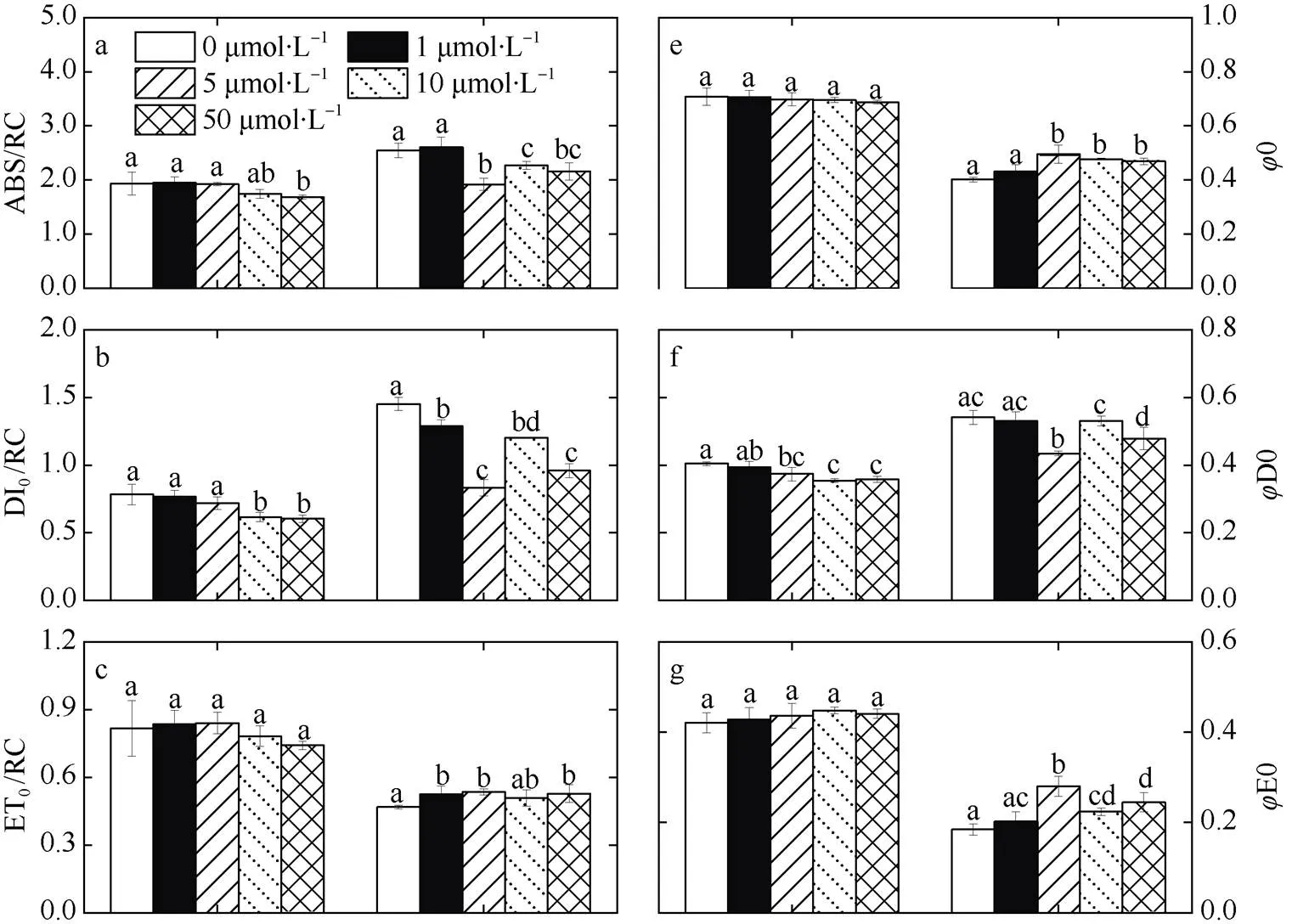
a. 单位反应中心吸收的光能; b. 单位反应中心的热耗散; c. 单位反应中心捕获的用于电子传递的能量; d. 单位反应中心捕获的用于还原 QA的能量; e. 捕获的激子将电子传递到电子传递链中超过 QA的其它电子受体的概率; f. 用于热耗散的量子比率; g. 用于电子传递的量子产额; h. 以吸收光能为基础的性能指数; 图中不同字母表示有显著性差异
Fig. 6 Changes of ABS/RC, DI0/RC, ET0/RC, TR0/RC,0,D0,E0, and PIABSunder different Mn treatment on days 6 and 15. a) absorption flux per reaction center; b) dissipated energy flux per reaction center; c) electron transport flux per reaction center; d) trapped energy flux per reaction center; e) probability that a trapped exciton moves an electron into the electron transport chain beyond QA–; f) quantum yield for energy dissipation; g) quantum yield for electron transport; h) performance index on absorption basis
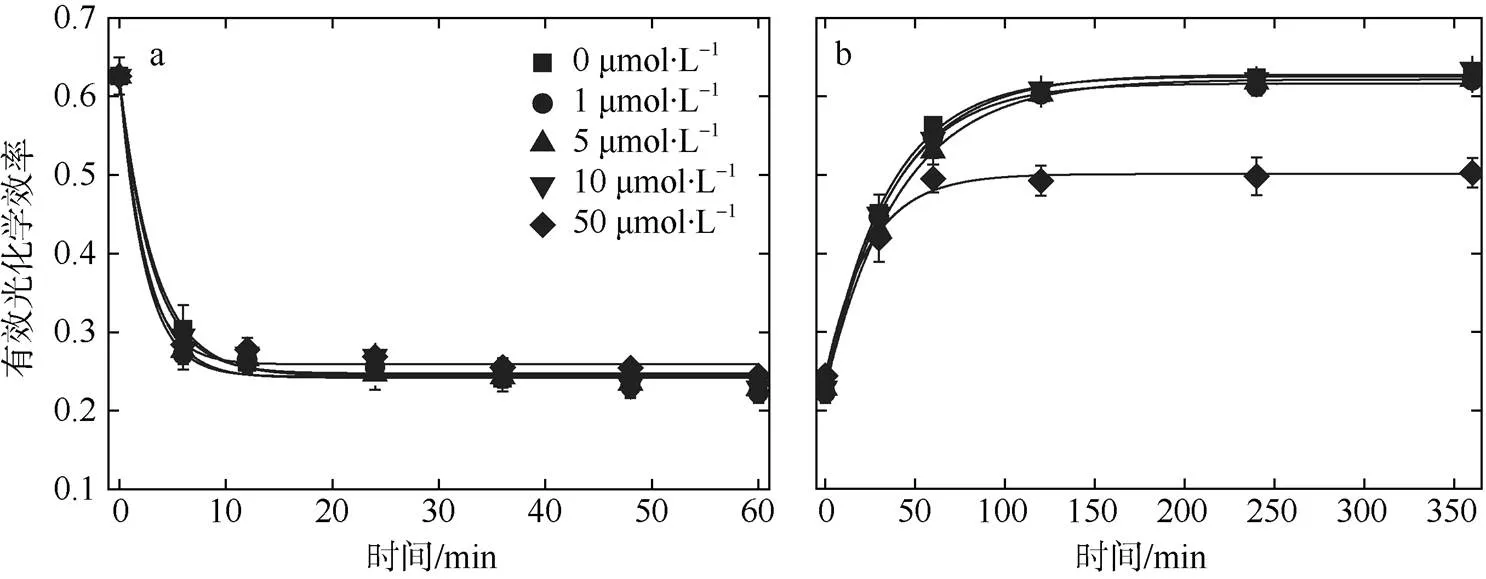
图7 不同浓度锰处理后热带库里亚藻接受高光照射1h(a)及6h弱光下恢复(b)后其光化学效率的变化
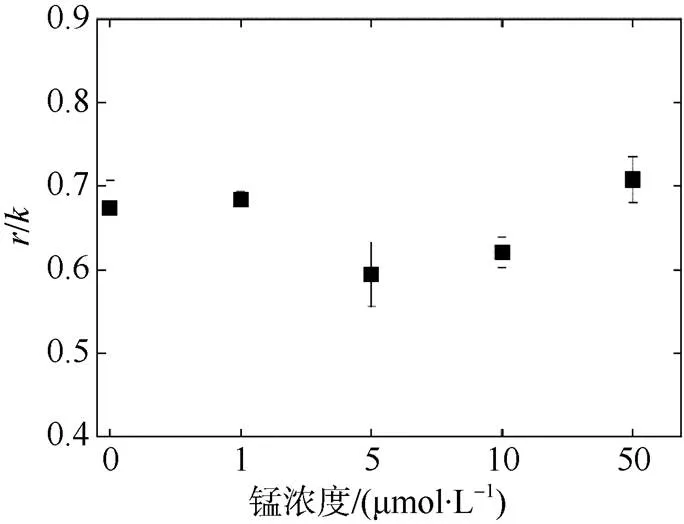
图8 不同浓度锰处理后热带库里亚藻接受高光照射及弱光恢复后的修复损伤比(r/k)
3.2 锰浓度对热带库里亚藻叶绿素快速光响应曲线的影响
锰的添加使rETRmax和k都得到了显著提升, 说明长期的不同浓度锰适应培养使热带库里亚藻光合结构对瞬间光强变化的响应和利用能力产生了差异, 锰的添加更有利于使该藻株保持较高的瞬间光能利用率, 以此来适应光环境的变化。此外随着PAR的增加, 各组均出现捕获激发能过剩的现象, 高NPQ与叶黄素循环密切相关, 代表较为活跃的光保护(Bautista-Saraiva et al, 2018), 因此为保护光合机构免受光破坏, 热带库里亚藻以非光化学淬灭(NPQ)的方式将其耗散掉, 但锰浓度≥5μmol·L–1的各实验组NPQ显著小于锰饥饿组, 曹春晖等(2010)研究了锰对米氏凯轮藻()叶绿素荧光特性的影响, 结果同样出现了高锰浓度下NPQ降低的现象。
3.3 锰浓度对热带库里亚藻PSⅡ反应中心的影响
光强对叶绿素荧光曲线的改变主要反映的是PSⅡ电子受体库QA、QB及PQ库的状态, 进而直观的表达藻类受到逆境伤害的程度, JI段荧光强度的上升主要和PQ库的氧化还原状态有关(Zhang et al, 2012), 结果显示锰的添加使J、I均有显著降低, 且由于J的降低,0降低, 意味着锰的添加使热带库里亚藻的PSⅡ反应中心更多处于有活性的打开状态, 进而降低了QA的还原量和被还原的相对速率, 即光合电子传递链中电子从QA向QB的传递得到促进。
DI0/RC的增加和ET0/RC的减少与vm(TR0/ABS)的减少可以更准确地评价PSⅡ的光抑制(Force et al, 2003), 锰饥饿组较高锰浓度组DI0/RC(图6b)增加、ET0/RC (图6c)与vm(TR0/ABS)(图5f)减少, 说明锰的缺乏使热带库里亚藻PSⅡ受光抑制程度更大, 这是由于放氧复合体裂解水放出电子的过程受阻, 也即作为电子传递的起点, 锰的缺乏可能限制了供给侧电子输出, 进而导致缺锰条件下电子传递下降; 同时,0为PSⅡ反应中心全部开放即原初电子受体QA全部氧化时的荧光水平, 通常由于非光化学能量的耗散0会降低, 但当PSⅡ反应中心受到破坏或可逆失活时, 将会导致0的增加(Demmig et al, 1987)。0在高温干旱等胁迫条件下均会出现上升的现象(叶波等, 2014), 本实验中由于缺锰也导致了0的升高。由此可见, 锰的缺乏可能造成了热带库里亚藻供体侧可逆失活或者抑制, 进而导致了后续受体测电子传递受阻。
PSⅡ发生损伤时首先是放氧复合体受到损伤使水的裂解受阻, 进而使氧-锰络合物失活, 电子传递到PSⅡ反应中心P680过程受阻, 致使极具氧化活性的P680+不能正常还原, 因此引起PSⅡ反应中心的损伤(Ohnishi et al, 2005)。强光下PSⅡ活性受损称为光抑制, 主要是由于PSⅡ的光损伤率和修复率之间不平衡造成的(Ohad et al, 1992)。通过高光(1000μmol photons·m–2·s–1)对热带库里亚藻的损伤修复实验发现, 虽然锰浓度为50μmol·L–1组抑制率最大, 但各组/与锰饥饿组之间并未出现显著性差异。有学者认为尽管光化学淬灭降低了多余的能量, 但却增强了P680+诱导的损伤(Hakala et al, 2005), 这也就解释了为什么高浓度组高光损伤更为明显。PSⅡ反应中心的这种损伤能够得到快速的修复, 主要是由于其核心蛋白D1蛋白的从头合成加速引起的(Andersson et al, 2001), 由于高浓度组在强光下的热耗散(NPQ)能力较弱, 从而导致PSⅡ产生大量的自由基, 抑制了D1蛋白的合成, 使其PSⅡ损伤修复受阻, 因此, 锰的添加未能使损伤修复至初始值, 可能是增强P680+诱导的损伤的同时减弱了合成D1蛋白进行修复的能力。
4 结论
锰浓度至少大于1μmol·L–1才能保障热带库里亚藻的光合活性。当锰浓度低于1μmol·L–1时, 热带库里亚藻首先降低活性光反应中心并提高热耗散途径, 这一阶段光合活性降低并不会影响其电子传递和生长; 当延长锰缺乏时间时, 热带库里亚藻的电子传递受到抑制进而影响其生长。但锰缺乏并未降低热带库里亚藻对强光的耐受。
曹春晖, 孙世春, 王学魁, 等, 2010. 锰浓度对米氏凯伦藻叶绿素荧光特性及生长的影响[J]. 生态学报, 30(19): 5280–5288. CAO CHUNHUI, SUN SHICHUN, WANG XUEKUI, et al, 2010. Effects of manganese concentrations on the chlorophyll fluorescence characteristics and growth of[J]. Acta Ecologica Sinica, 30(19): 5280–5288 (in Chinese with English abstract).
郭皓, 丁德文, 林凤翱, 等, 2015. 近20a我国近海赤潮特点与发生规律[J]. 海洋科学进展, 33(4): 547–558. GUO HAO, DING DEWEN, LIN FENGAO, et al, 2015. Characteristics and patterns of red tide in China coastal waters during the last 20a[J]. Advances in Marine Science, 33(4): 547–558 (in Chinese with English abstract).
梁计林, 龙丽娟, 张偲, 等, 2011. 微量元素Fe、Mn、Co对有毒甲藻生长和产毒的影响[J]. 热带海洋学报, 30(1): 119–123. LIANG JILIN, LONG LIJUAN, ZHANG SI, et al, 2011. Influence of trace elements, Fe, Mn, and Co, on growth and toxin-producing of toxic marine dinoflagellate Coolia monotis[J]. Journal of Tropical Oceanography, 30(1): 119–123.
梁舜华, 张红标, 1993. 大鹏湾盐田水域赤潮期间水质锰的变化规律[J]. 海洋通报, 12(2): 13–16. LIANG XUNHUA, ZHANG HONGBIAO, 1993. Change in manganese concentration in waters off Yantian, Dapeng Bay during red tide occurrence[J]. Marine Science Bulletin, 12(2): 13–16 (in Chinese with English abstract).
沈竑, 洪君超, 张开富, 等, 1995. 中肋骨条藻()赤潮发生过程中微量元素Fe、Mn作用的研究[J]. 暨南大学学报(自然科学与医学版), 16(1): 131–136, 149. SHEN HONG, HONG JUNCHAO, ZHANG KAIFU, et al, 1995. Studies on the effects of Fe and Mn in thered tide[J]. Journal of Jinan University (Natural Science), 16(1): 131–136, 149 (in Chinese with English abstract).
王木兰, 姜玥璐, 2018. 微量元素锰对威氏海链藻生长及叶绿素荧光的影响[J]. 环境科学, 39(12): 5514–5522. WANG MULAN, JIANG YUELU, 2018. Effects of manganese on the growth and fluorescence induction kinetics of[J]. Environmental Science, 39(12): 5514–5522 (in Chinese with English abstract).
杨秀环, 唐宝英, 吴京洪, 等, 2000. 柘林湾赤潮与Fe、Mn、Se和营养盐指数的关系[J]. 中山大学学报(自然科学版), 39(5): 58–62. YANG XIUHUAN, TANG BAOYING, WU JINGHONG, et al, 2000. Relationship between Fe, Mn, Se, synthetic index of nutrient and red tide in Zhelin Bay[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 39(5): 58–62 (in Chinese with English abstract).
叶波, 吴永波, 邵维, 等, 2014. 高温干旱复合胁迫及复水对构树()幼苗光合特性和叶绿素荧光参数的影响[J]. 生态学杂志, 33(9): 2343–2349. YE BO, WU YONGBO, SHAO WEI, et al, 2014. Effects of combined stress of elevated temperature and drought and of re-watering on the photosynthetic characteristics and chlorophyll fluorescence parameters ofseedlings[J]. Chinese Journal of Ecology, 33(9): 2343-2349 (in Chinese with English abstract).
ALLEN M D, KROPAT J, TOTTEY S, et al, 2007. Manganese deficiency in Chlamydomonas results in loss of photosystem II and MnSOD function, sensitivity to peroxides, and secondary phosphorus and iron deficiency[J]. Plant Physiology, 143(1): 263–277.
ANDERSSON B, ARO E M, 2001. Photodamage and D1 protein turnover in photosystem II[M]//ARO E M, ANDERSSON B. Regulation of Photosynthesis. Dordrecht: Springer: 377–393.
Bautista-Saraiva A I N, Bonomi-Barufi J, Figueroa F L, et al, 2018. UV-radiation effects on photosynthesis, photosynthetic pigments and UV-absorbing substances in three species of tropical lotic macroalgae[J]. Theoretical and Experimental Plant Physiology, 30(3): 181–192.
Dąbrowski P, Baczewska A H, Pawluśkiewicz B, et al, 2016. Prompt chlorophyllfluorescence as a rapid tool for diagnostic changes in PSII structure inhibited by salt stress in Perennial ryegrass[J]. Journal of Photochemistry and Photobiology B: Biology, 157: 22–31.
DEMMIG B, WINTER K, KRÜGER A, et al, 1987. Photoinhibition and zeaxanthin formation in intact leaves: a possible role of the xanthophyll cycle in the dissipation of excess light energy[J]. Plant Physiology, 84(2): 218–224.
FERREIRA K N, IVERSON T M, MAGHLAOUI K, et al, 2004. Architecture of the photosynthetic oxygen-evolving center[J]. Science, 303(5665): 1831–1838.
FORCE L, CRITCHLEY C, VAN RENSEN J J S, 2003. New fluorescence parameters for monitoring photosynthesis in plants[J]. Photosynthesis Research, 78(1): 17–33.
GUAN WANCHUN, LI PING, 2017. Dependency of UVR-induced photoinhibition on atomic ratio of N to P in the dinoflagellate[J]. Marine Biology, 164(2): 31.
GUILLARD R R L, RYTHER J H, 1962. Studies of marine planktonic diatoms. I. Cyclotella nana hustedt, and detonula confervacea (cleve) gran[J]. Canadian Journal of Microbiology, 8(2): 229–239.
HAKALA M, TUOMINEN I, KERÄNEN M, et al, 2005. Evidence for the role of the oxygen-evolving manganese complex in photoinhibition of photosystem II[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1706(1–2): 68–80.
HOPKINS E F, 1930. The necessity and function of manganese in the growth of Chlorella sp[J]. Science, 72(1876): 609–610.
Hsieh S I, Castruita M, Malasarn D, et al, 2013. The proteome of copper, iron, zinc, and manganese micronutrient deficiency in[J]. Molecular & Cellular Proteomics, 12(1): 65–86.
Hutner S H, Provasoli L, SCHATZ A, et al, 1950. Some approaches to the study of the role of metals in the metabolism of microorganisms[J]. Proceedings of the American Philosophical Society, 94(2): 152–170.
Kalaji H M, Jajoo A, Oukarroum A, et al, 2016. Chlorophyll a fluorescence as a tool to monitor physiological status of plants under abiotic stress conditions[J]. Acta Physiologiae Plantarum, 38(4): 102.
KESSLER E, 1955. On the role of manganese in the oxygen-evolving system of photosynthesis[J]. Archives of Biochemistry and Biophysics, 59(2): 527–529.
Kumar K S, Dahms H U, Lee J S, et al, 2014. Algal photosynthetic responses to toxic metals and herbicides assessed by chlorophyll a fluorescence[J]. Ecotoxicology and Environmental Safety, 104: 51–71.
LARSSON M E, SMITH K F, DOBLIN M A, 2019. First description of the environmental niche of the epibenthic dinoflagellate species,, and(Dinophyceae) from Eastern Australia[J]. Journal of Phycology, 55(3): 565–577.
Lesser M P, Cullen J J, Neale P J, 1994. Carbon uptake in a marine diatom during acute exposure to ultraviolet B radiation: relative importance of damage and repair[J]. Journal of Phycology, 30(2): 183–192.
LEUNG P T Y, YAN M, YIU S K F, et al, 2017. Molecular phylogeny and toxicity of harmful benthic dinoflagellates(Ostreopsidaceae, Dinophyceae) in a sub-tropical marine ecosystem: the first record from Hong Kong[J]. Marine Pollution Bulletin, 124(2): 878–889.
Li Qiang, Chen HuanHuan, Qi YiPing, et al, 2019. Excess copper effects on growth, uptake of water and nutrients, carbohydrates, and PSII photochemistry revealed by OJIP transients in Citrus seedlings[J]. Environmental Science and Pollution Research, 26(29): 30188–30205.
OHAD I, PRÁŠIL O, ADIR N, 1992. Dynamics of photosystem II: mechanism of photoinhibition and recovery processes[M] //BARBER J. The Photosystems: Structure, Function and Molecular Biology. Amsterdam: Elsevier: 295–348.
OHNISHI N, ALLAKHVERDIEV S I, TAKAHASHI S, et al, 2005. Two-step mechanism of photodamage to photosystem II: step 1 occurs at the oxygen-evolving complex and step 2 occurs at the photochemical reaction center[J]. Biochemistry, 44(23): 8494–8499.
Pausch F, Bischof K, Trimborn S, 2019. Iron and manganese co-limit growth of the Southern Ocean diatom[J]. PLoS One, 14(9): e0221959.
PLATT T, GALLEGOS C L, HARRISON W G, 1980. Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J]. Journal of Marine Research, 38(4):687-701.
SCHMIDT S B, JENSEN P E, HUSTED S, 2016. Manganese deficiency in plants: the impact on photosystem II[J]. Trends in Plant Science, 21(7): 622–632.
STRASSER R J, SRIVASTAVA A, TSIMILLI-MICHAEL M, 2000. The fluorescence transient as a tool to characterise and screen photosynthetic samples[M]//YUNUS M, PATHRE U, MOHANTY P. Probing Photosynthesis: Mechanism, Regulation & Adaptation. London: Taylor and Francis Press: 445–483.
STRASSER R J, TSIMILLI-MICHAEL M, SRIVASTAVA A, 2004. Analysis of the chlorophyll a fluorescence transient[M] // PAPAGEORGIOU G C, GOVINDJEE. Chlorophyll A Fluorescence. Dordrecht: Springer: 321–362.
Wang ZHAOWEI, Ren JingLing, Zhang RuiFeng, et al, 2019. Physical and biological controls of dissolved manganese on the northern slope of the South China Sea[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 167: 25–33.
ZHANG L T, GAO H Y, ZHANG Z S, et al, 2012. Multiple effects of inhibition of mitochondrial alternative oxidase pathway on photosynthetic apparatus inK-1 leaves[J]. Biologia Plantarum, 56(2): 365–368.
Effect of manganese on the growth and chlorophyll fluorescence characteristics of benthic dinoflagellate
LIU Shasha1, 2, CHEN Heng1, 2, HUANG Kaixuan1, 2, LÜ Songhui1, 2, ZHANG Liang3, XIE Xuedong3
1. Research Center for Harmful Algae and Marine Biology, Jinan University, Guangzhou 510362, China;2.Key Laboratory of Aquatic Eutrophication and Control of Harmful Algae Blooms of Guangdong Higher Education Institutes, Guangzhou 510632, China;3. Guangdong Environmental Monitoring Center, Guangzhou 510362, China
In this study, the effects of growth and chlorophyll fluorescence characteristics inunder different concentrations of manganese (Mn, 0, 1, 5, 10, and 50μmol·L–1) were investigated by using chlorophyll fluorescence kinetics technique. The results are as follows. The relationships of specific growth rate () and maximal relative electron transport rate (rETRmax) with the concentration of Mn were fitted by exponential functions; growth and electron transport had the same degree of response to manganese stress. The regular activity of photosynthesis can be maintained only when the concentration of manganese is at least 1μmol·L–1. when the Mn concentration was lower than that 1μmol·L–1, the photochemical efficiency (v/m) begins to decrease after 6 days, while the per reaction center of absorbed light energy (ABS/RC) and heat energy dissipation (DI0/RC) increase, and no influence to electron transport (E0) and the growth, which indicated Mn deficiency only decreased the number of active reaction center and increased the heat dissipation in this phase. While Mn deficiency extended to day 15, the rising of0and the decreases ofE0and growth indicated that Mn deficiency caused irreversible damage to the active reaction center and inhibited the electron transport in this phase. The repair rate to damage rate (/) under intense light was not affected by Mn deficiency, indicated Mn deficiency did not influence the photoprotection of.
manganese;; benthic dinoflagellate; chlorophyll fluorescence; OJIP curve
A
1009-5470(2020)03-0076-10
10.11978/2020003
http://www.jto.ac.cn
2020-01-08;
2020-01-29。
林强编辑
国家自然科学基金 (41706126、41876173); 科技基础资源调查专项 (2018FY100100、2018FY100200)
刘莎莎(1995—), 女, 安徽省亳州市人, 硕士研究生, 研究方向为藻类光合生理, E-mail: shasha_icon@163.com
黄凯旋。E-mail: babyblue02@163.com
2020-01-08;
2020-01-29.
Editor: LIN Qiang
National Natural Science Fund ation of China (41706126, 41876173); Science & Technology Basic Resources Investigation Program of China (2018FY100200, 2018FY100100)
HUANG Kaixuan. E-mail: babyblue02@163.com
Q178.53; Q945.14
