乳清蛋白磷酸化改性对其营养价值和消化吸收的影响
2020-05-24李金华王成涛
李金华 李 博* 王成涛
(1 中国农业大学食品科学与营养工程学院 北京100083 2 北京工商大学食品质量与安全北京实验室 北京100048)
乳清蛋白有“蛋白之王”之称,其纯度高,吸收率高且氨基酸组成最为合理。目前市场上乳清蛋白产品主要有浓缩乳清蛋白(WPC)、乳清分离蛋白(WPI)和乳清蛋白肽[1]。其中,WPI 含有β-乳球蛋白、α-乳白蛋白及牛血清白蛋白等[2],易被人体消化吸收,能为特定人群提供所需优质蛋白。乳清蛋白因良好的乳化性、粘着性及胶凝性等特性,广泛应用于肉制品、乳制品等工业生产中,如在香肠和午餐肉加工中添加乳清蛋白,有助于肉块与配料的粘结[3],在干酪生产时添加WPC 以改善产品感官性能[4]。随着食品工业的快速发展,天然的蛋白已较难满足生产中的不同需求。为此,许多研究者对乳清蛋白进行改性。Lee 等[5]以WPI 为原料,经高压处理后提高了蛋白质的乳化稳定性;孙颜君等[6]通过热处理和调节pH 值对WPC 进行改性并将改性蛋白添加到低脂稀奶油中,提高了低脂稀奶油的打发率和泡沫稳定性。然而,改性是否会影响WPI 的营养品质,目前还鲜有研究报道。
蛋白质的营养品质包括蛋白质含量、必需氨基酸的含量和模式以及机体对其消化利用的程度。蛋白质的营养评价方法主要有生物价(BV)[7]、化学评分(CS)[8]、氨基酸评分(AAS)和必需氨基酸指数(EAAI)、氨基酸比值系数(RCAA)和氨基酸比值系数分(SRCAA)[9]等。徐向英等[10]通过AAS、CS 等指标对不同产地的燕麦品种进行营养品质的评价。赵凤敏等[11]应用RCAA 和SRCAA 等方法筛选出6 个营养价值较高的马铃薯品种。机体对蛋白质的消化吸收程度也是评价蛋白质营养价值的标准之一。体外模拟消化模型和Caco-2 细胞吸收模型可较好地模拟体内胃、肠消化吸收的生理过程,且广泛应用于研究中。顾浩峰等[12]利用胃蛋白酶和胰蛋白酶对羊奶婴儿配方奶粉进行体外模拟胃、肠消化,结果发现其蛋白质能较好地被机体吸收利用,营养价值高。Rubio 等[13]以动物蛋白和植物蛋白为原料,利用Caco-2 细胞吸收模型进行体外模拟吸收,结果表明动物蛋白氨基酸的吸收速率高于植物蛋白,营养利用率高。
本研究以WPI 为原料,利用三聚磷酸钠(STP)对其进行改性,探究改性程度对WPI 的营养价值及消化吸收的影响,为乳清蛋白磷酸化改性工业化生产和应用提供参考。
1 材料与方法
1.1 试剂与仪器
主要试剂:WPI、SDS-PAGE 凝胶试剂盒、考马斯亮蓝染色套装等(AR 级),北京索莱宝;三聚磷酸钠(AR 级),天津光复;酒石酸锑钾(AR 级),山东西亚;钼酸铵、甲基红、溴甲酚蓝等(AR 级),国药集团;胃蛋白酶、胰蛋白酶、氨基酸混合标准品、异硫氰酸苯酯、三乙胺,美国Sigma;非必需氨基酸、胎牛血清、HBSS、青霉素,美国HyClone;乙腈、甲醇(色谱级),Fisher Scientific 等。
主要仪器:TA-XT plus 质构仪,英国SMS 公司;UV-5100 紫外分光光度计,上海精密仪器仪表;K9860 全自动凯式定氮仪,海能仪器;LC-15液相泵、LC-15 梯度混合器、LC SOLUTION 15C液相操作系统,岛津国际贸易(上海)等。
1.2 方法
1.2.1 磷酸化WPI 制备[14]取一定量的WPI 溶于pH 7.0 的0.05 mol/L 磷酸盐缓冲液(PBS)中,制得8%的蛋白质溶液,分别加入1%~7%的STP,充分混合后调节pH 8.0,45 ℃水浴振荡2 h。振荡结束后冷却至室温,4 ℃透析24 h。透析结束后,将样品冷冻干燥48 h,得改性WPI。
1.2.2 磷酸化程度测定 参考申世强等[15]的方法并有所改动。分别量取0,1.0,1.5,2.0,2.5,3.0,3.5 mL 磷标准液于50 mL 容量瓶中,用20 mL 水稀释,依次加入2.0 mL 钼酸铵溶液、3.0 mL 抗坏血酸溶液,用水稀释至刻度后摇匀,室温放置10 min。以试剂空白为对照,在波长710 nm 处测定其吸光度,绘制标准曲线。将待测样品配制成1 mg/mL 的蛋白溶液,取10.0 mL 于100 mL 锥形瓶中,分别加入1.0 mL 硫酸溶液(浓硫酸∶水体积比为1 ∶35)、5.0 mL 过硫酸钾溶液,调节体积至25 mL,置于电炉上煮沸至溶液快蒸干为止。取出,冷却至室温,转移至50 mL 容量瓶中,按照磷标准液的操作步骤测定样品的吸光度,在标准曲线上查得试样液中的磷含量。以原蛋白为空白,磷酸化程度以每100 g 蛋白质所含的质量表示。图1为磷标准曲线,磷标准曲线的回归方程为:y = 0.1805x -0.0093,R2=0.999,式中y 为吸光值,x 为磷标准溶液(mg/L)。
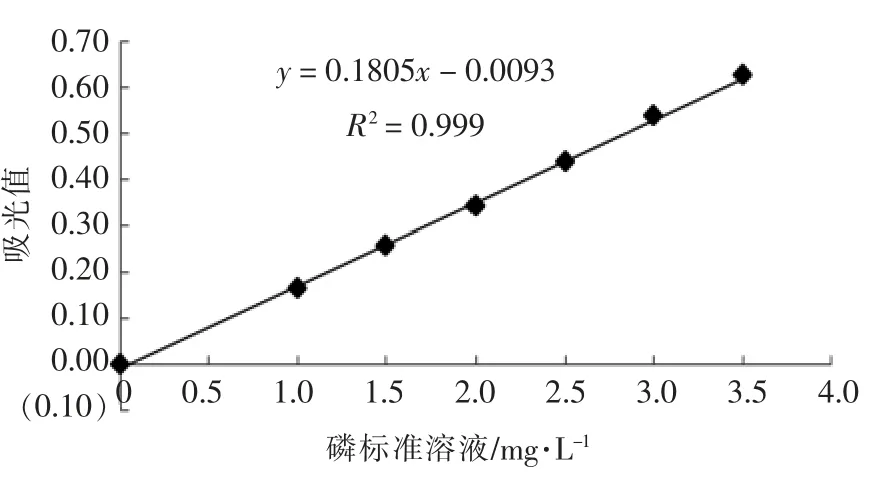
图1 磷标准曲线Fig.1 Standard curve of phosphorus
1.2.3 乳化性及乳化稳定性的测定[14]将蛋白质用PBS 配制成0.25%的蛋白液,从中取出15 mL置于离心管中,加入5.0 mL 葵花籽油,10 000 r/min 均质2 min。均质结束后取50 μL 匀浆液加到5.0 mL 0.1% SDS 中,混匀后在波长500 nm 处测定其吸光值A0。均质液放置10 min 后在相同的位置取50 μL 匀浆液,在波长500 nm 处测定其吸光值A10。以SDS 溶液为空白,乳化性EAI 和乳化稳定性ESI 计算公式如下:
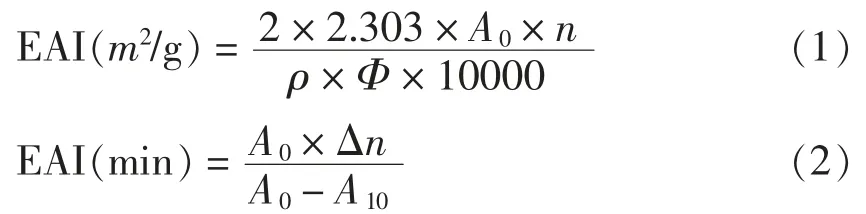
式中:n——稀释倍数;ρ——蛋白质量浓度(g/mL);Ф——油体积分数,25%;A0——均质后样品在波长500 nm 处的吸光值;A10——均质10 min后样品在波长500 nm 处的吸光值。
1.2.4 起泡性及泡沫稳定性的测定[16]取0.5 g待测样品溶于100 mL PBS 中,取25 mL 于量筒中,以16 000 r/min 速度均质2 min,30 s 后记录总体积,室温静置30 min 后记录总体积。起泡性FA和泡沫稳定性FS 计算公式如下:

式中:A——待测样品均质后的体积,mL;B——待测样品均质前的体积,mL;C——室温静置30 min 后体积,mL。
1.2.5 凝胶硬度测定[17]将待测样品配成16%的蛋白液,90 ℃水浴加热30 min,冷却至室温后置于4 ℃冰箱过夜。用质构仪测定其硬度,测定参数为:在TPA 模式下用P2 探头,测试前速度3 mm/s,测试速度2 mm/s,测试后速度2 mm/s,触发力5 g,测试距离5 mm。
1.2.6 体外模拟胃消化[12]将待测样品配制成质量分数为2%的溶液,于37 ℃水浴预热15 min,调节溶液pH 值为2.0。以酶与底物质量比1∶50 的比例加入胃蛋白酶,于37 ℃水浴摇床上消化2 h,消化结束后调节溶液pH 值至7.0,灭酶。
体外模拟胃、肠总消化[18]:将待测样品配制成质量分数为2%的溶液,于37 ℃水浴预热15 min,调节溶液pH 值为2.0。以酶与底物质量比1∶50 的比例加入胃蛋白酶,于37 ℃水浴摇床上消化2 h,然后调节溶液的pH 值至7.0 进入肠消化阶段。向水解液中添加胰蛋白酶,酶与底物质量比为1∶50,在37 ℃水浴摇床中酶解2 h。酶解结束后,将水解液沸水灭酶5 min,冷却至室温后调节pH值为7.0。
1.2.7 Caco-2 细胞培养及模拟吸收转运 参考霍艳姣等的方法[19]。
1.2.8 体外消化率测定[20]取10 mL 消化液,加入等体积的10%三氯乙酸沉淀蛋白质,8 000 r/min离心15 min,取上清液,参照GB 5009.5-2010 凯式定氮法测定上清液中蛋白质的含量,以不添加消化液的溶液为空白。样品总蛋白质的含量用凯式定氮法测定,体外消化率计算公式为:
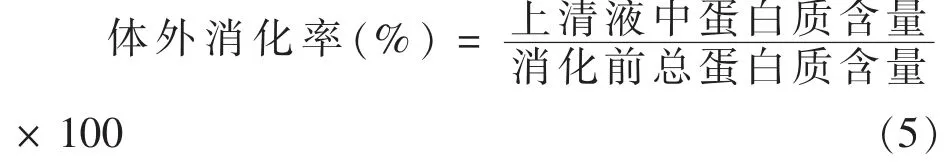
1.2.9 消化产物分子质量测定 采用SDS-PAGE凝胶电泳法。根据何光华等[21]的方法,浓缩胶质量分数为5%,分离胶质量分数为15%。
1.2.10 肽氮及氨基氮含量测定 参照王波[18]方法。
1.2.11 氨基酸组成测定和分析 采用HPLC-异硫氰酸苯酯(PITC)柱前衍生法对改性及消化吸收前、后的样品进行氨基酸组成的测定[22]。样品的处理参考陈敏[23]的方法。以氨基酸标品洗脱得到的图谱为标准图谱,对测定样品的氨基酸组成进行定性和定量。
AAS 计算公式[24]:

1.3 数据处理
采用Excel 2010 进行试验图表和数据的处理,通过SPSS 17.0 统计软件进行显著性差异分析,P<0.05 表示有显著差异。
2 结果与分析
2.1 WPI 磷酸化改性对WPI 功能性质的影响
随着STP 添加量的增加,WPI 的磷酸化程度不断增大,在添加量为7%时达到46.7 mg/g(图2a)。随着磷酸化程度的增大,WPI 的乳化性及乳化稳定性、起泡性及泡沫稳定性也随之提高(图2b、2d),而凝胶硬度先增大后减小,在磷酸化程度为4.67%时硬度明显小于改性前的硬度(图2c)。各功能性质变化的原因可能是随着STP 添加量的增加,蛋白质体系引入负电荷,降低了乳化液表面张力,乳化性和乳化稳定性提高;蛋白质溶解度增大,起泡性和泡沫稳定性增强;磷酸化引入的磷酸根基团较少时,蛋白质的吸引力和排斥力能较好地保持平衡,凝胶硬度增大,随着引入磷酸根基团的增加,蛋白质分子间的排斥力不断增大,凝胶网络结构较难形成,凝胶硬度下降。陈旸[14]优化了WPI 磷酸化改性工艺,STP 最优添加量为5.47%。本研究选用STP 添加量1%~5%改性组进行蛋白质营养价值评价。
2.2 WPI 磷酸化改性对其氨基酸组成及评价的影响

图2 STP 添加量对WPI 磷酸化程度及功能性质的影响Fig.2 Effects of STP addition on extent of phosphorylation and functional properties of WPI
磷酸化改性后,WPI 的必需氨基酸中赖氨酸(Lys)的含量随着磷酸化程度的增加而减小,在STP 添加量为5%时Lys 含量减小约4%;苏氨酸(Thr)和亮氨酸(Leu)的含量减小,甲硫氨酸(Met)和酪氨酸(Tyr)的含量增加。而WPI 的非必需氨基酸中,谷氨酸(Glu)的含量减小,在STP 添加量5%时减小约5%(表1)。有研究表明,在pH 7~9 时,Lys 的自由氨基具有亲核性,STP 主要与该氨基结合[26],而谷氨酰胺(Gln)的自由氨基在此条件下也有亲核性。本试验中采用的氨基酸检测方法将Gln 的含量归入Glu 中。由表1可以看出Glu 含量为Lys 的2 倍以上,推测Gln 也可能是磷酸化改性的位点之一。
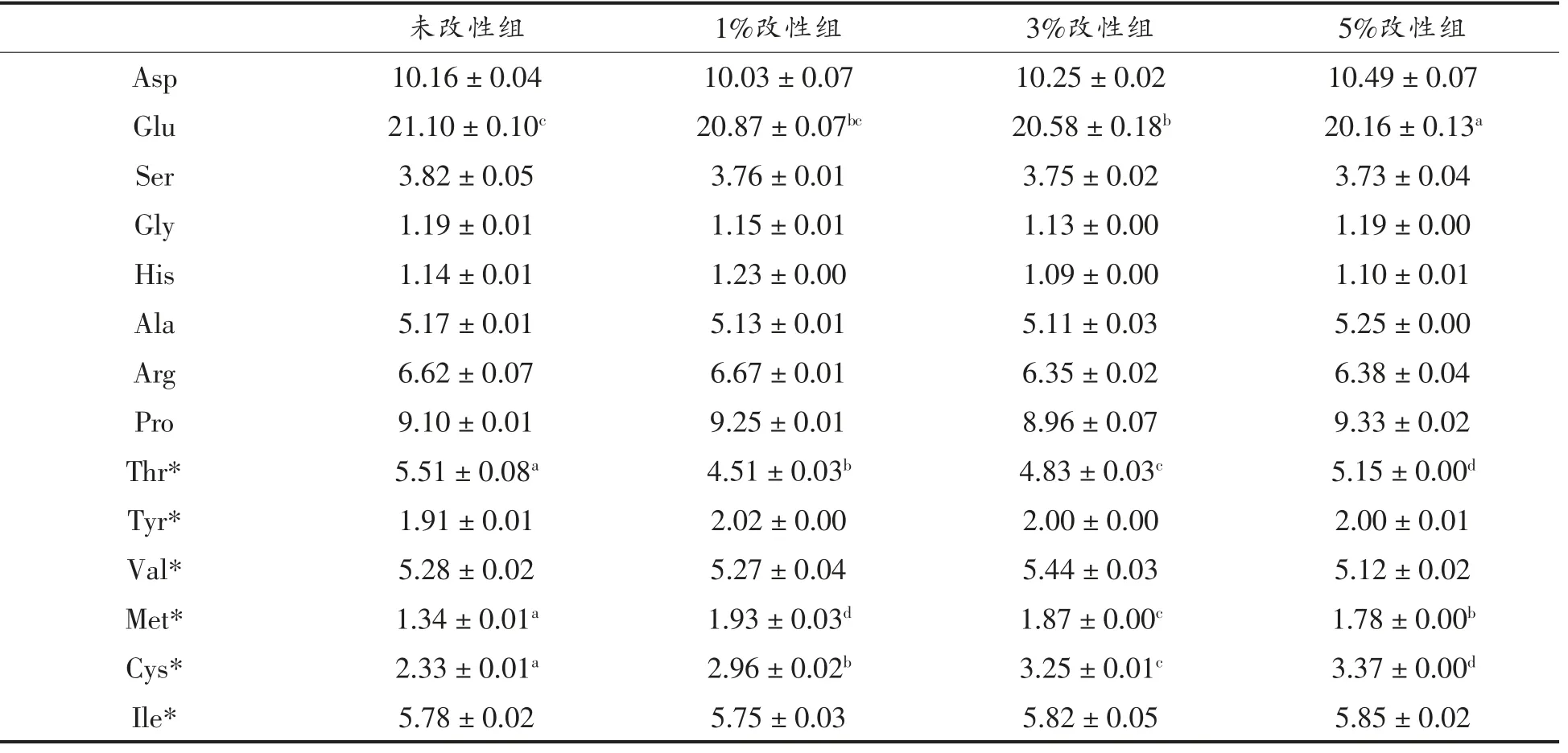
表1 改性前、后WPI 氨基酸含量(%)Table1 Percentage of amino acids of WPI before and after modification(%)
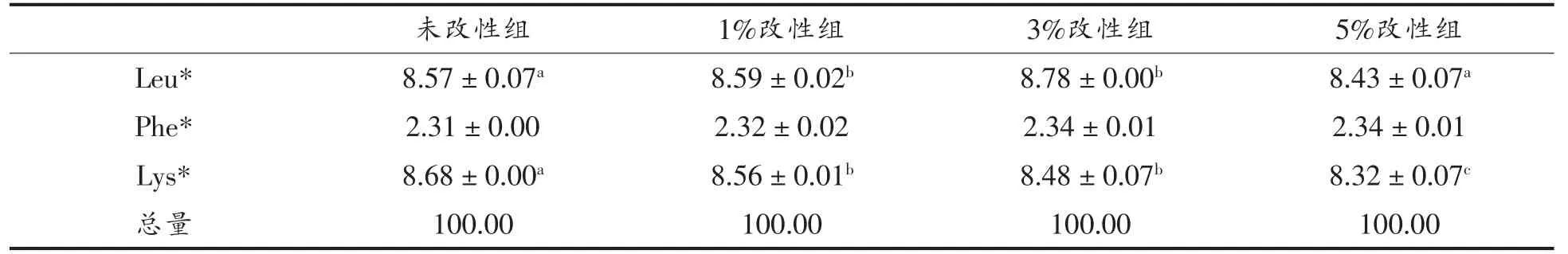
(续表2)
理论上来说,氨基酸在人体内的吸收是以其配比及其在必需氨基酸中所占比例进行的[27]。改性前、后WPI 必需氨基酸的AAS、RCAA 及SRCAA 比较结果见表2。在各样品组中,苯丙氨酸+酪氨酸(Phe+Tyr)的RCAA 最低,为第一限制性氨基酸,且与缬氨酸(Val)均相对不足(RCAA<1)。磷酸化改性后,Lys 的AAS 随改性程度的增大而降低,其RCAA 仍大于1 且更接近1,说明改性后Lys 仍相对过剩且更接近模式氨基酸。SRCAA 越接近100,氨基酸组成与标准模式越接近,营养价值越高。由表2可看出,未改性组和改性组的SRCAA 均高于75 且无明显差异,说明改性不影响其营养价值。
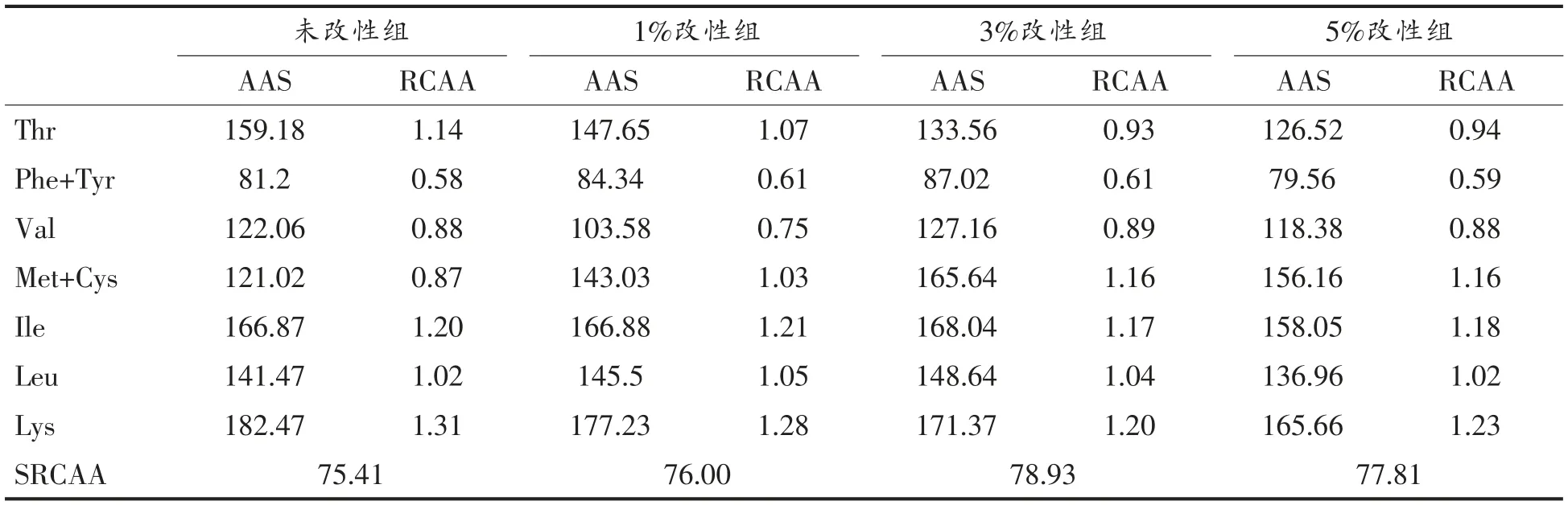
表2 改性前、后WPI 的氨基酸评分(AAS)、氨基酸比值系数(RCAA)及氨基酸比值系数分(SRCAA)比较Table2 Amino acid score(AAS),ratio coefficient of amino acid(RCAA)and score of RC(SRCAA)of WPI before and after modification
2.3 WPI 磷酸化改性对其消化的影响
改性组与未改性组的胃消化率、胃肠总消化率无显著差异(P>0.05,见图3)。WPI 在改性后,其分子结构未发生变化,磷酸化程度对分子质量的分布无显著影响(图4)。经模拟胃消化后,未改性WPI 及改性后的WPI 都产生新的分子质量小于11 ku 的条带,且未改性组和改性组的分子条带无明显差别,说明磷酸化改性对模拟胃消化无显著性影响。经模拟肠消化后,与未消化前相比,WPI 分子质量较大的条带消失,改性WPI 分子条带的分布与未改性的没有明显差别。以上说明WPI 磷酸化改性对其胃、肠消化无显著性影响。
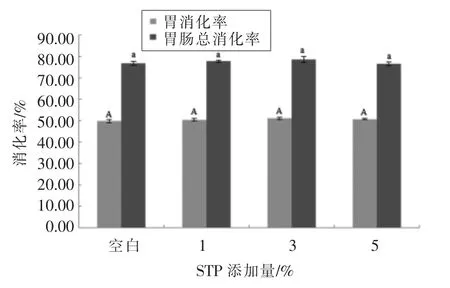
图3 STP 添加量对WPI 消化率的影响Fig.3 Effects of STP addition on digestibility of WPI
对胃、肠消化产物进行氨基酸组成测定,结果显示:改性WPI 的Val、半胱氨酸(Cys)和Lys的含量降低,天冬氨酸(Asp)、Glu 及Leu 的含量升高(表3),说明WPI 磷酸化改性对其模拟胃、肠消化产物的氨基酸组成有影响。
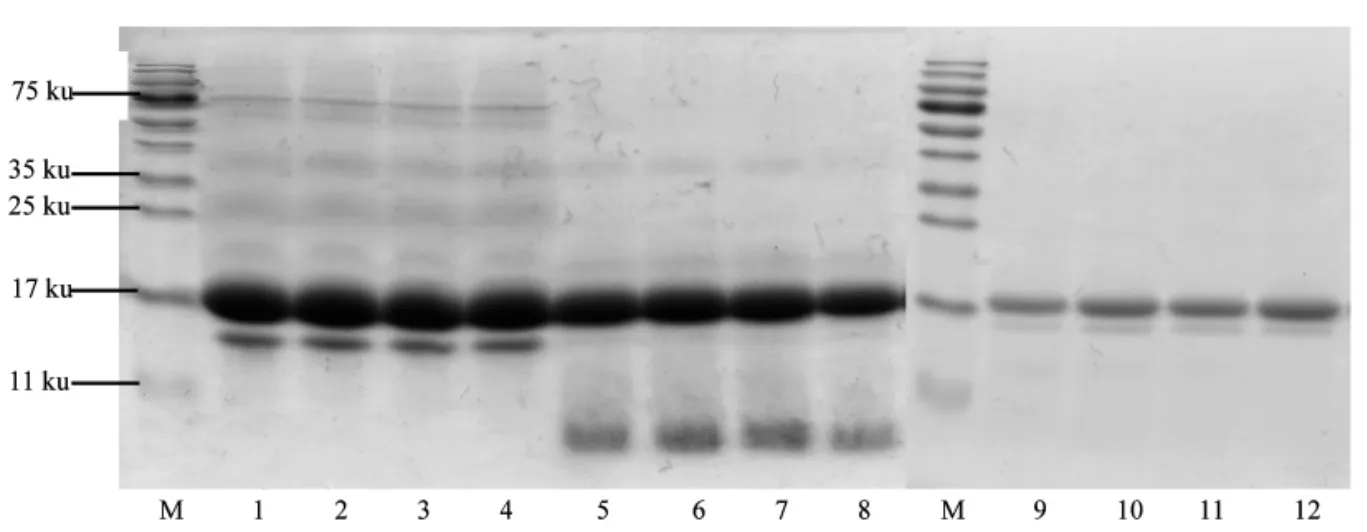
图4 STP 添加量对WPI 分子质量的影响Fig.4 Effects of STP addition on molecular weight of WPI
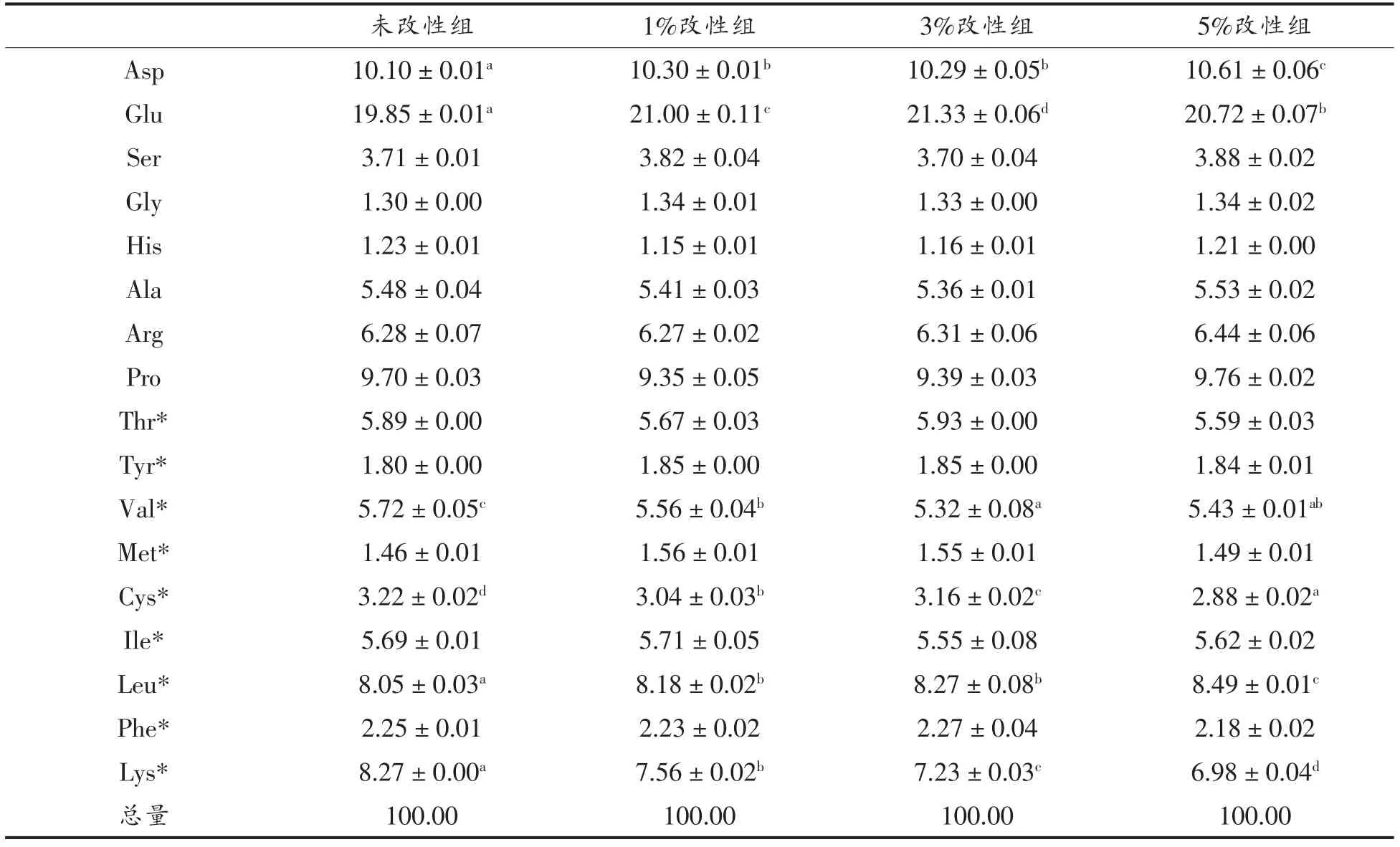
表3 体外模拟胃、肠消化后WPI 氨基酸含量(%)Table3 Percentage of amino acids of WPI after simulation digestion in vitro(%)
2.4 WPI 磷酸化改性对其吸收的影响
改性后,WPI 肽氮转运率为10.24%~10.79%,游离氨基氮转运率为4.65%~4.80%(图5),数据分析表明肽氮及氨基氮转运率与改性前没有显著差异(P>0.05)。对转运产物的氨基酸组成进行分析,发现各氨基酸组成没有显著差异(P>0.05,见表4),说明WPI 磷酸化改性对消化后的氨基酸组成有一定的影响,而对氨基酸的吸收无显著影响。
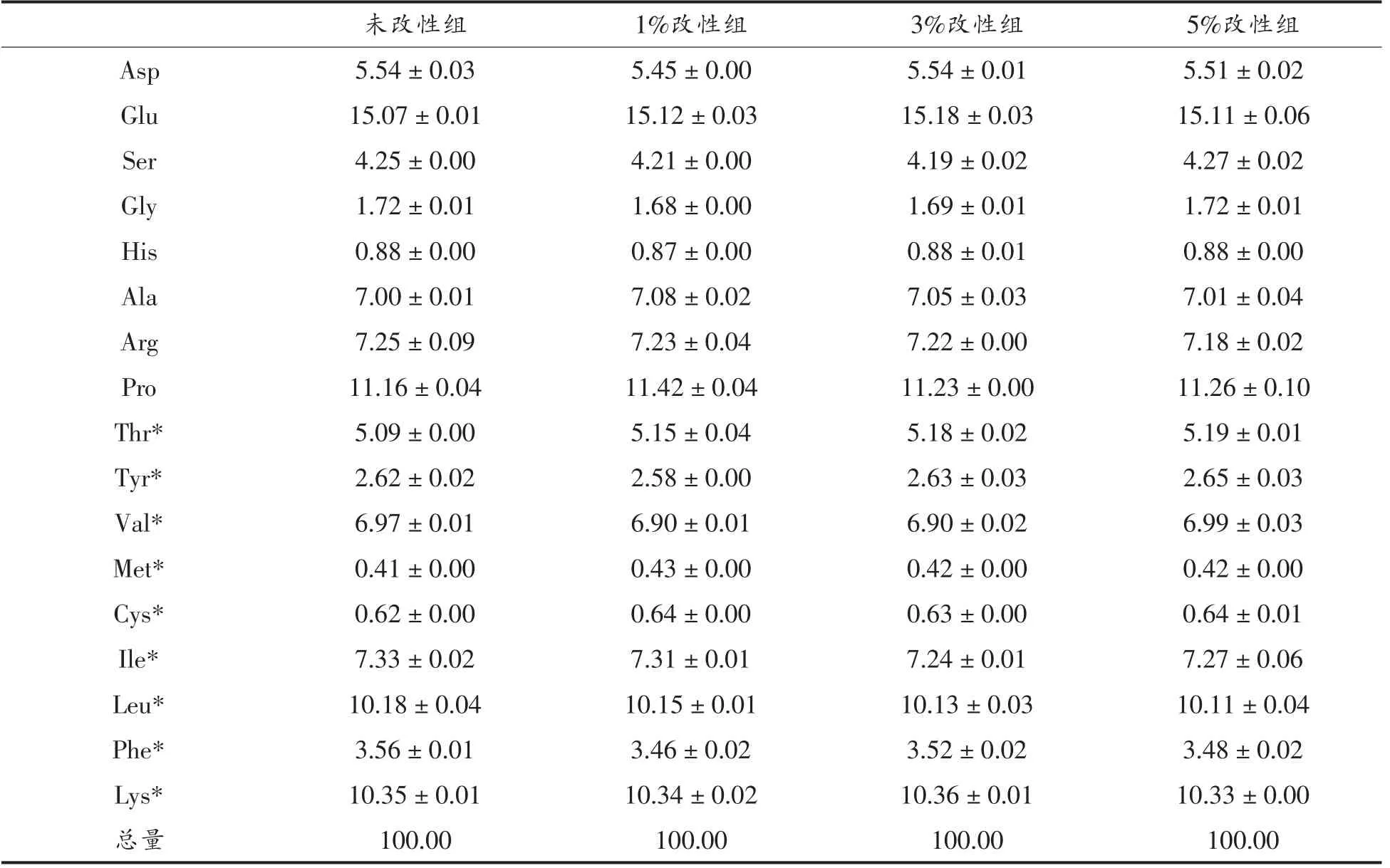
表4 模拟小肠吸收后WPI 氨基酸组成(%)Table4 Percentage of amino acids of WPI after simulation absorption in vitro(%)
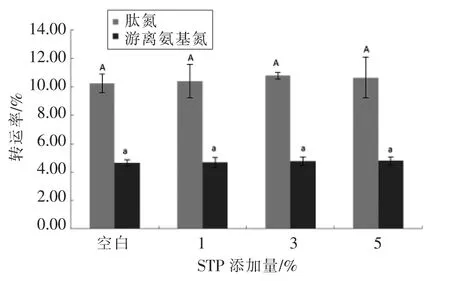
图5 STP 添加量对WPI 转运率的影响Fig.5 Effects of STP addition on transport rates of WPI
3 讨论
近年来,大量的研究是关于各种蛋白质的改性。Thompson 等[28]利用琥珀酰胺对乳清蛋白进行改性并应用到冰淇淋生产中,提高了冰淇淋的耐融化性和稳定性。Enomoto 等[29]将α-乳白蛋白在干热条件下进行糖基化和磷酸化改性,结果发现改性明显提高了乳清蛋白的热稳定性及乳化性。刘丽莉等[30]将鸡蛋清蛋白进行磷酸化改性,提高了蛋白的水溶性、保水性及乳化性等特性。
然而,目前对改性蛋白的营养安全性研究较少,影响在工业上的应用。本文研究WPI 改性对蛋白质营养品质的影响。评价食品蛋白质的营养品质首先要考虑其必需氨基酸的含量和比例。联合国粮农组织(FAO)和世界卫生组织(WHO)在1973年提出了符合成人需要的8 种必需氨基酸模式和AAS 的概念[24],SRCAA[25]广泛用于评价蛋白质的营养价值。本研究全面评价了磷酸化改性程度对WPI 营养价值的影响,以FAO/WHO 提出的必需氨基酸模式为基础,利用AAS、RCAA 和SRCAA 对改性蛋白进行营养评价,结果显示:随着STP 添加量从1%增到7%,改性程度增至3.97%,WPI 的功能性质有所改善,各必需氨基酸的AAS 虽有所降低,但SRCAA 均大于75 且无明显差别,说明改性不影响WPI 的营养价值。
此外,评价蛋白质的营养品质还应考虑机体对其消化利用程度。人体试验通常花费昂贵且在伦理方面也有争议。随着科技的发展,体外模拟消化吸收模型被逐渐地开发和完善。体外模拟消化模型中,胃蛋白酶和胰蛋白酶消化法是模拟人体胃和十二指肠的消化过程,可反映食物蛋白质在不同消化阶段的消化情况。而体外模拟吸收模型中,Caco-2 细胞吸收转运模型具有与体内小肠上皮细胞相同的细胞极性、转运系统以及酶系统,被证实是目前研究小肠吸收功能最可靠的体外模型,被广泛用于研究中。李倩等[31]采用胃蛋白酶-胰蛋白酶两步消化法探究乳清蛋白的热变性率与消化率的关系。Feng M 等[32]以胶原蛋白为原料,利用胃蛋白酶-胰蛋白酶消化模型和Caco-2 细胞吸收转运模型探究胶原蛋白酶解与其消化性和转运率的关系。本研究采用体外模拟消化模型和Caco-2 细胞吸收模型研究WPI 磷酸化改性对其消化吸收的影响。
不同的改性方法对蛋白质的消化率有不同的影响。李燕燕[33]用微波和酰化复合改性大米蛋白,改性后蛋白的消化率提高。姜燕等[34]通过谷氨酰胺转移酶(TGase)对大豆分离蛋白膜、小麦面筋蛋白膜等进行改性,结果表明TGase 处理显著降低了蛋白膜的消化率。而在本研究中,磷酸化改性在蛋白质的侧链基团中引入磷酸根离子,改性程度在4%以内时,改性前、后WPI 的消化率没有显著性差异。唐文婷[35]用STP 对小麦面筋蛋白进行改性,结果发现改性程度在4%以内时蛋白体外消化率无明显变化,与本研究结果一致。本研究结果显示,虽然在模拟胃、肠消化过程中改性WPI 的氨基酸组成与未改性的有差异,但Caco-2 细胞吸收转运实验表明WPI 磷酸化改性对其吸收转运率及吸收产物氨基酸组成无显著影响,这说明WPI磷酸化改性不影响其消化吸收。
4 结论
随着磷酸化改性程度的增大,WPI 的功能性质有所改善,SRCAA 均大于75 且与未改性的无明显差别,在模拟胃、肠消化和Caco-2 细胞吸收转运后,改性后的WPI 消化吸收率、氨基酸组成与未改性的无显著差异。
综上,WPI 磷酸化改性在改善其功能性质的同时,不影响其营养价值和消化利用,可更广泛地应用在食品工业生产中。
