子宫癌肉瘤与低危型子宫内膜癌的磁共振参数差异分析
2020-05-23程千千李蔚洪戴一川陈雀芦
程千千,李蔚洪,戴一川,陈雀芦
(温州市中心医院放射科,浙江 温州 325000)
子宫内膜癌(endometrial cancer,EC)起源于子宫内膜上皮,其中国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期为Ⅰ期,肿瘤直径<2cm,肌层浸润<1/2且病理分级为G1或G2的腺癌通常被认为是低危型EC,淋巴结转移风险较低且患者预后情况良好,手术治疗时可不行淋巴结清扫术(lymphadenectomy,LD)[1]。子宫癌肉瘤(uterine carcinosarcoma,CS)近年来因发病率升高和预后较差逐渐引起临床重视,该肿瘤源自子宫内膜上皮细胞和间质成分,分化程度较低,且术后极易复发而导致患者死亡,因此术中需同步行LD以完善分期和减少复发[2-3]。CS和低危型EC临床表现大致相同,二者治疗方案又存在显著差异,因此术前进行准确鉴别对合理治疗和改善预后极为重要。磁共振成像(magnetic resonance imaging,MRI)是妇科肿瘤术前诊断和分期常用影像学方法,其中扩散加权成像(diffusion weighted imaging,DWI)和动态增强扫描(dynamic contrast enhanced,DCE)均可对CS和EC进行定性和定量分析[4-5]。本文主要研究CS和低危型EC在MRI的各参数差异,为两者鉴别诊断和治疗提供详细参考依据。
1资料与方法
1.1一般资料
选取2014年6月至2019年6月于温州市中心医院接受手术治疗的CS患者26例和低危型EC患者47例临床资料进行回顾性分析,CS组年龄38~74岁,平均(58.72±9.46)岁,体质量指数(body mass index,BMI)为20.4~31.7kg/m2,平均(25.09±3.14)kg/m2,FIGO分期为Ⅰ期17例、Ⅱ期6例、Ⅲ期3例;EC组年龄为35~72岁,平均(56.94±8.73)岁,BMI为19.8~30.9kg/m2,平均(24.36±2.84)kg/m2,FIGO分期为Ⅰa期16例、Ⅰb期18例以及Ⅰc期13例,病理分级为G1级29例和G2级18例。纳入标准:①经术后病理检查确诊为CS和EC;②术前均完成MRI检查;③患者年龄为18~80岁;④患者及家属知情并同意本研究。排除标准:①伴其它盆腔疾病;②合并其它类型恶性肿瘤;③MRI成像治疗欠佳或患者临床资料不完整。
1.2研究方法
所有患者术前均采用Siemens Megnetom Skyra 3.0T MR扫描仪和体部相控阵线圈自脐至耻骨联合进行扫描,患者取仰卧并自由呼吸。①先常规行横断面T1WI和T2WI扫描,参数设置:T1WI为TR 550ms,TE 10ms,层厚4mm,层间距1.2mm,视野250mm×250mm,矩阵320×320;T2WI为TR 4490mm,TE 83mm,层厚4mm,层间距1.2mm,视野350mm×350mm,矩阵256×256;②完成后行DWI扫描:TR 2800ms,TE 81ms,层厚5mm,视野250mm×329mm,矩阵268mm×512mm,翻转角90°,b值分别取0和800s/mm2;③DCE扫描采用VIBE序列,先进行校正T1横断位扫描,TR 5.08ms,TE 1.74ms,层厚3.6mm,层间距0.72mm,视野260mm×260mm,矩阵138×192,采集次数8次,翻转角为2°和15°;④完成后采用高压注射器以3mL/s的速度经肘静脉注射对比剂Gd-DTPA注射液20mL并行动态增强扫描,参数设置为TR 4.24ms,TE 1.66ms,层厚3.6mm,矩阵138×192,翻转角15°,采集次数为35次;⑤将扫描数据导入syngo Multimodality Workplace进行处理、校正和匹配。
具体处理方法为:①首先在T1WI和T2WI图像上分析病灶特点、信号强度并进行量化评分,其中囊性病灶计1分,实性计2分,囊性伴实性为3分;信号强度T1WI/T2WI等或低信号各计1分,T1WI/T2WI高信号各计2分,T1WI/T2WI混杂信号各计3分;②在病灶最大截面测量子宫内膜厚度及宫腔前后径,并计算比值(endometrial thickness/anteroposterior diameter of uterine cavity,ET/AP);③在b值=800s/mm2的DWI图像上于实体肿瘤中心选择信号均匀的感兴趣区域(region of interest,ROI),面积约为30mm2,分别测量表观弥散系数(apparent diffusion coefficient,ADC)并取平均值,然后在闭孔内径最大横截面选取ROI并计算ADC,将病灶和闭孔ADC比值记为rADC;④应用Tissue 4D分析软件测量DCE扫描参数,先在T1WI动态增强图像中早期强化和对比度最明显者手动勾画ROI,计算获得ROI区域容积转运常数(volume transport constant,Ktrans)、回流速率常数(reflux rate constant,Kep)和容积分数(fractional volume,Ve)图,然后在相应伪彩图上测量Ktrans、Kep和Ve等参数并取平均值。
1.3统计学方法

2结果
2.1两组T1WI和T2WI参数比较
CS组病灶性质评分和ET/AP明显高于EC组(t=4.446,P<0.05),两组T1WI和T2WI信号强度差异无统计学意义(P>0.05),见表1。

表1 两组T1WI和T2WI参数比较
2.2 两组DWI测量参数比较
CS组ADC和rADC明显低于EC组(t=2.151、2.903,均P<0.05),见表2。

表2 两组DWI测量参数比较
2.3 两组DCE扫描参数比较
CS组Ktrans、Kep和Ve明显高于EC组(t=6.445、6.118、7.451,均P<0.05),见表3。

表3 两组DCE扫描参数比较
2.4 MRI各序列参数对CS和低危型EC诊断价值分析
ROC曲线分析显示,病灶性质评分、ADC和rADC对CS和低危型EC鉴别诊断价值一般,AUC值分别为0.670、0.696和0.682,ET/AP、Ktrans、Kep和Ve对CS和低危型EC鉴别诊断价值较高,AUC值分别为0.722、0.851、0.782和0.937,见表4及图1~3。
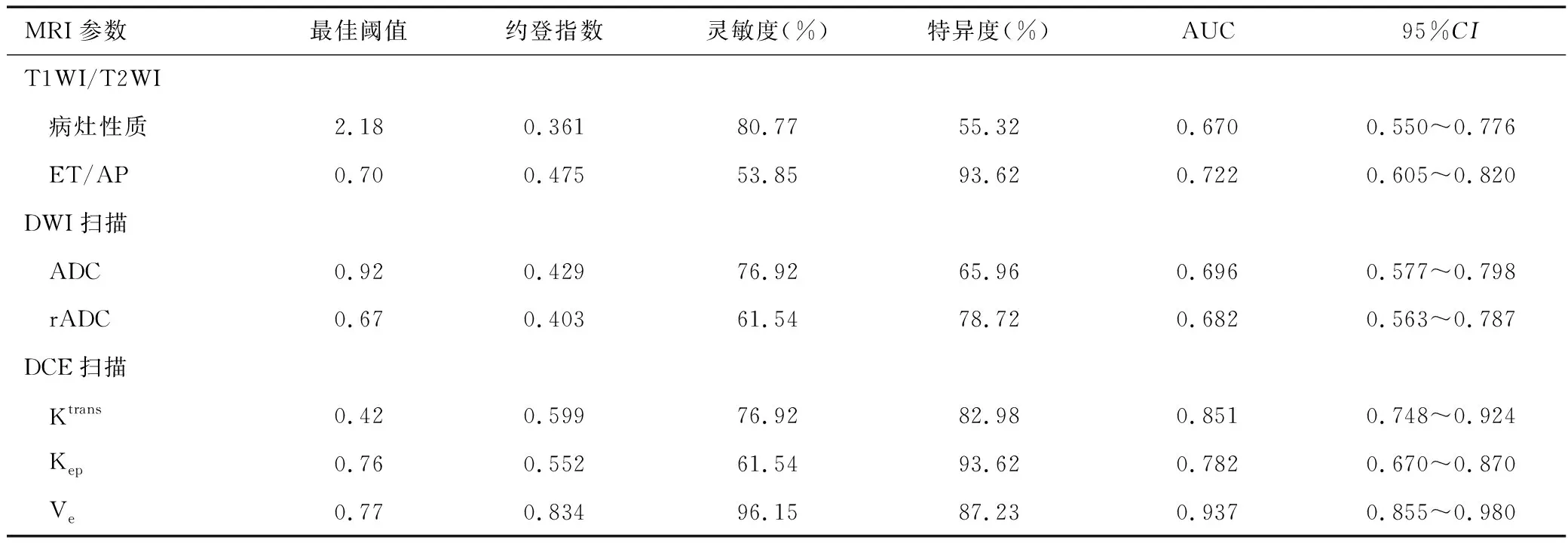
表4 MRI各序列参数对CS和低危型EC诊断价值分析
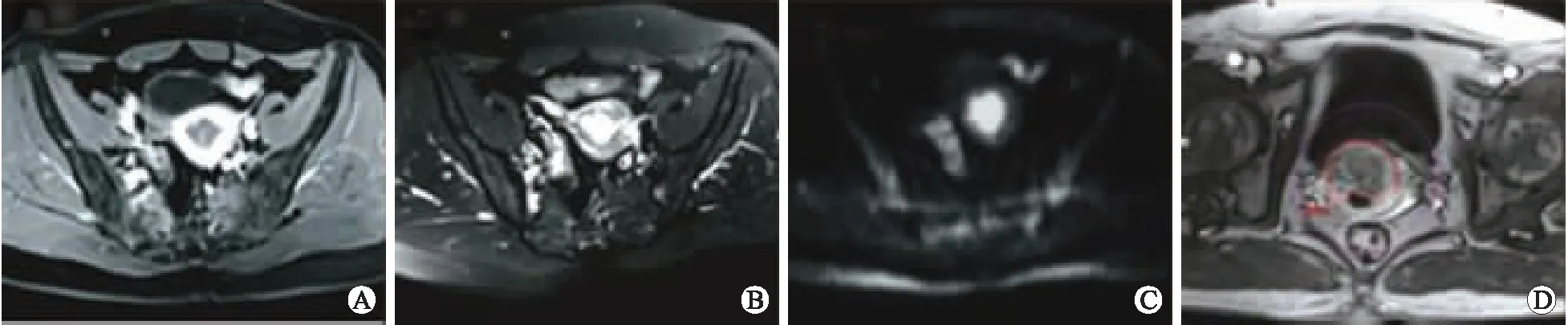
注:A:T1WI显示病灶不均匀强化;B:T2WI可见宫腔内高信号影;C:DWI图像病灶表现为明显高信号结节;D:DCE增强扫描图像勾画ROI。
图1低危型CE患者MRI参数,56岁
Fig.1 MRI parameters of patient with low-risk CE of 62 years old
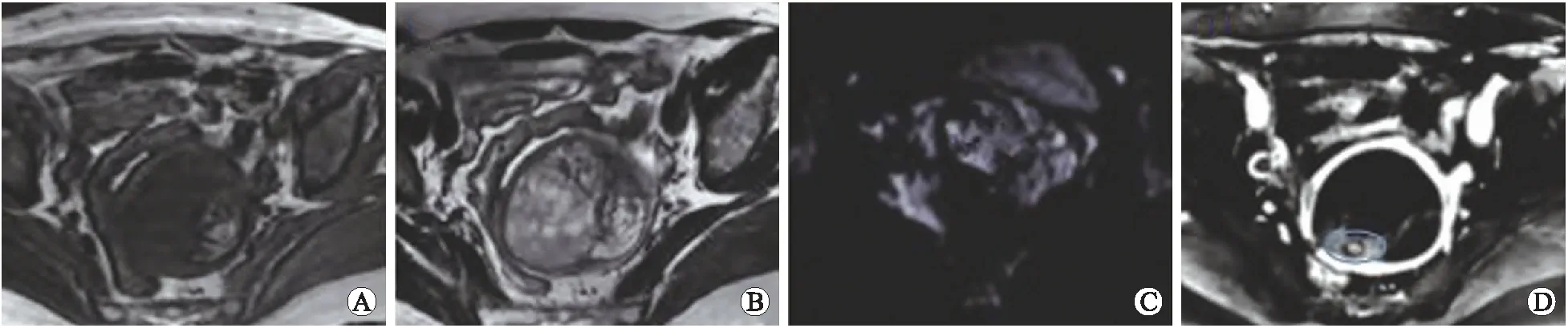
注:A:T1WI表现为高信号实性病灶;B:T2WI可见混杂信号和血管流空影;C:DWI显示弥漫性高信号;D:DCE增强扫描图像勾画ROI。
图2CS患者MRI参数,62岁
Fig.2 MRI parameters of patientwith CS of 62 years old
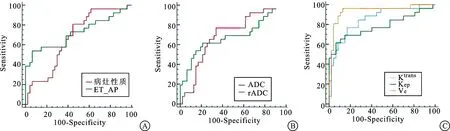
图3 MRI各参数对CS和低危型CE鉴别诊断的ROC曲线
3讨论
EC发病率在女性中仅次于乳腺癌、肺癌及大肠癌,随着早期检出率和治疗水平提升,多数患者可及时获得准确诊断和治疗,预后情况近年来明显改善,手术目前仍是EC首选治疗方案,且早期患者疗效尤为显著,文献报道5年总体生存率可超过90%[6-7]。CS生物学行为特征与高级别EC极为相似,极易在早期发生转移而导致预后不良,故欧洲肿瘤学会-欧洲妇科肿瘤协会-欧洲放射肿瘤学会(European Society for Medical Oncology-European Society of Gynaecological Oncology-European Society for Radiotherapy & Oncology,ESMO-ESGO-ESTRO)共识会议将其划分为高危型EC并主张行LD及相关辅助治疗,在治疗方案上与低危型EC差异较大,术前进行准确鉴别诊断极为重要[8]。
3.1 CS和EC患者T1WI、T2WI参数分析
MRI多序列、多参数及多角度成像特点,不仅可清楚显示子宫及周围组织形态特征,DWI和DCE等新型技术还可从代谢和功能水平对病灶进行定量分析,为疾病诊断和鉴别提供丰富参考依据。顾亮亮等[9]对93例EC患者临床资料进行回顾性分析发现,Ⅱ型患者ADC值明显低于Ⅰ型,因此测量ADC有助于EC患者分型,对临床选择合理治疗方案极为重要。郭永梅等[10]等研究表明DCE-MRI定量参数分析有主对EC病理分化程度进行进一步区分,为术前评估提供更多的影像学信息。张国福等[11]报道显示DWI定量分析联合MRI常规序列有助于鉴别子宫肉瘤和子宫肌瘤。本研究回顾性分析26例CS患者和47例低危型EC患者MRI各序列检查,结果显示两者T1WI均表现为等或低信号,T2WI多表现为高或稍高信号,部分病例可见混杂信号,且两组T1WI和T2WI信号强度评分无明显差异,与Takeuchi等[12]认为CS瘤体信号强度变化不均的结果基本一致。在形态学特征方面,两组病灶性质均以实性为主,CS组可见病灶性质评分明显高于EC组,其原因可能为CS恶性程度较高且生长速度快,容易导致瘤体内部发生出血或坏死,因此囊性和实性常合并存在,沈逸青等[13]等研究认为混杂信号、囊性变和血管流空影等有利于CS鉴别。本研究分析显示通病灶性质对CS和低危型EC进行鉴别的AUC为0.670,诊断价值较为一般,以评分>2.18为临界值时特异度仅为55.32%,其原因可能为部分CS患者病灶内未发生出血或坏死而被误认为低危型EC,可见根据形态特征进行鉴别存在较多不足。CS生长方式主要为浸润型或外生型两种,因而肿瘤体积一般较大,本研究结果显示CS组ET/AP明显高于EC组,且采用ET/AP进行鉴别诊断的AUC为0.722,该方法测量简单且直观,对CS和低危型EC鉴别具有较高参考价值,但结果容易受外界因素影响,因此其准确性还有待进一步观察和证实。
3.2 CS和EC患者DWI、DCE参数分析
DWI是无创观察水分子随机扩散运动的MRI技术,通过测量ADC值描述病灶内水分子不同方向弥散速度和范围来评估水分子扩散受限情况,从而反映组织结构和生理功能[14]。癌症病灶因肿瘤细胞迅速生长和堆积导致细胞外间隙减小,ADC值较正常组织明显减小,此外ADC还容易受血流灌注信号影响,因此常选取b值为800或1000s/mm2以减少其他因素干扰,同时保障图像信噪比[15]。本研究中CS组ADC和rADC明显低于EC组,分别以ADC和rADC为变量分析其鉴别诊断价值显示两者AUC分别为0.696和0.682,分析原因为CS肿瘤细胞分化程度较低且排列紧密,导致细胞间隙水分子扩散受限和ADC值降低,但病灶内广泛分布的坏死和囊性成分又可造成ADC值升高,因而不同患者ADC差异明显,导致其诊断准确性下降,rADC虽然可有效排除个体差异,但诊断价值仍然较为一般,这与Yan等[16]报道结果大致相近。DCE-MRI是反映对比剂在病灶和毛细血管间扩散规律的成像方法,既往研究认为恶性病变Ktrans普遍高于良性病变,但关于Kep和Ve的变化目前还存有争议[10]。本研究中CS组患者Ktrans、Kep和Ve均明显高于EC组,作ROC曲线分析显示Ktrans、Kep和Ve对CS和低危型EC鉴别诊断的AUC分别达0.851、0.782和0.937,均显示出良好鉴别诊断价值。Ktrans和Ve均是反映肿瘤病灶血管新生情况的重要指标,随着恶性程度增加,病灶内血管不成熟或破坏的比例明显升高,从而导致对比剂分子外漏和Ktrans值升高;Kep则代表对比剂从病灶回流到血管的能力,其值升高说明肿瘤血管通透性和病灶内对比剂浓度增加[17-18]。本研究显示Ktrans、Kep和Ve对CS和低危型EC均有良好鉴别能力,其中以Ve>0.77为临界值时灵敏度和特异度分别达96.15%和87.23%,这与CS病灶存在大量不成熟血管关系密切,表明DCE检查和定量分析对CS和低危型EC鉴别诊断具有重要参考价值。
综上所述,MRI是子宫肿瘤重要检查方法,通过对T1WI、T2WI、DWI和DCE等序列参数进行定量分析,可为CS和低危型EC鉴别诊断提供详细参考依据,其中DCE扫描参数Ktrans、Kep和Ve具有较高诊断价值。
