蚕豆抗性淀粉的压热法工艺优化及其结构表征
2020-05-21,*,*
,*,*
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014; 2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076; 3.青海省农林科学院,青海西宁 810000)
蚕豆,又称佛豆、夏豆、南豆等,由于部分籽粒偏大,也被称为大豆或大豌豆,在中国经常被用作重要的食用豆类[1]。中国蚕豆的发展历史悠久[2],主要产于长江流域[3],青海、甘肃、宁波和张家口蚕豆可视为中国四大最有价值的蚕豆品种[4]。蚕豆中的成分复杂多样,蛋白质约占总重30%左右,淀粉占48%~62%,脂肪约占0.8%,膳食纤维约占3.1%。因此,蚕豆具有富含蛋白质、淀粉,脂肪低这三大优点[5-6]。此外,蚕豆中还含有丰富的维生素和少量的微量元素[7],也含有原花青素、黄酮类、抗营养因子等生物活性物质[8-9],可作为功能性食品的来源。
淀粉中有一些不被酶作用的成分,Englyst将其命名为抗性淀粉(Resistant Starch,RS)[10]。目前抗性淀粉可总结为4类:物理包埋淀粉(Physically Trapped Starch,RS1)、抗性淀粉颗粒(Resistant Starch Granules,RS2)、老化淀粉(Retrograded Starch,RS3)以及化学改性淀粉(Chemically Modified Starch,RS4)[11]。对抗性淀粉这一物质的研究作为近些年来人们广泛关注的热点,原因之一是它具有与膳食纤维相似的一些生理功能,RS在体内不能在胃和小肠中消化,到达大肠后,可以进行部分分解。此过程与调节餐后血糖浓度[12]、维护肠道健康及促进维生素和矿物质的吸收等[13]息息相关,对许多慢性病的防治有着重要的意义,抗性淀粉也正因为具有这些特性而受到广泛关注,开发前景十分广阔。RS3型抗性淀粉是抗性淀粉的主要成分,利用压热法制备RS3型抗性淀粉在研究中较为常见[14],根据RS形成理论,淀粉乳在高温高压下完全糊化,然后缓慢冷却生成老化淀粉,不同的制备条件影响着抗性淀粉的得率。蚕豆富含淀粉,是制备RS的良好原料。
本文以蚕豆淀粉为原料,通过单因素实验,分析了不同条件下压热对蚕豆抗性淀粉制备的影响,并进一步结合响应面试验优化蚕豆抗性淀粉制备工艺,结合大型仪器,得出蚕豆抗性淀粉的表观形貌、红外吸收光谱及X射线衍射图谱,为获得青海蚕豆抗性淀粉的最佳制备工艺和继续深加工给出了良好的技术理论。
1 材料与方法
1.1 材料与仪器
蚕豆GF19 由青海省农林科学院提供;胃蛋白酶(1200 U/mg)、耐热α-淀粉酶(20000 U/mg)、葡萄糖淀粉酶(100000 U/mL) 苏州美高美生物科技有限公司;氢氧化钙、氢氧化钾、盐酸、氯化钾、氢氧化钠、葡萄糖等(均为分析纯) 国药集团化学试剂有限公司;3,5-二硝基水杨酸法显色试剂(DNS试剂)、克拉克缓冲液、柠檬酸盐缓冲液、乙酸钠缓冲液 实验室自制。
UV-5500PC紫外-可见分光光度计 上海分析仪器有限公司;FE28 pH计 上海梅特勒-托利多仪器有限公司;LDZX-50KBS立式压力灭汽灭菌锅 上海申安医疗器械厂;LXJ-IIB离心机 上海安亭科学仪器厂;DKE-450B型电热恒温振荡水槽 上海森信实验仪器有限公司;DGG-9140A电热恒温鼓风干燥箱 上海森信实验仪器有限公司;D2 PHASER X-射线衍射仪 德国Bruker公司;EVO-LS10扫描电子显微镜 德国Zeiss公司;Nicolet iS50傅里叶变换红外光谱仪 美国Thermo公司。
1.2 实验方法
1.2.1 蚕豆淀粉的提取 蚕豆淀粉的提取采用碱提法[15]:取出磨碎的豆粉,通过100目筛,加入氢氧化钙溶液处理1.5 h(每过15 min/h搅拌);浸泡后的蚕豆粉过100目滤网,过滤后水洗滤渣并重复3次,收集全部滤液;再过200目滤网,过滤后用水洗涤筛网和滤渣,收集所有滤液,4000 r/min、15 min离心,将沉降物洗涤4次以上,直至上清液无色透明,取出剩余物质于鼓风干燥箱中,40 ℃条件下干燥48 h以上,粉碎,过200目筛,即为蚕豆淀粉。
1.2.2 蚕豆抗性淀粉的制备 抗性淀粉制备的工艺流程[16]:称量1.2.1中的蚕豆淀粉,配制成一定浓度的淀粉乳,在一定温度下,处理一定时间后取出,置于一定温度下回生一定时间,后在95 ℃下干燥,压碎,通过100目筛,即为蚕豆抗性淀粉。
1.2.3 抗性淀粉的纯化 取上述制备的蚕豆抗性淀粉,加入适量的胃蛋白酶、耐热α-淀粉酶和糖化酶3种酶对其处理,离心后水洗,重复3次以上,干燥后粉碎过100目筛,并进行结构表征。
1.2.4 单因素实验
1.2.4.1 淀粉乳浓度对RS得率的影响 选择浓度分别为20%、30%、40%、50%、60%、70% 6种不同浓度水平的淀粉乳,固定压热温度121 ℃、压热时间40 min、回生温度4 ℃、回生时间24 h。
1.2.4.2 压热温度对RS得率的影响 选择105、115、121、126 ℃ 4种不同水平的压热温度,固定淀粉乳浓度30%、压热时间40 min、回生温度4 ℃、回生时间24 h。
1.2.4.3 压热时间对RS得率的影响 分别选择30、40、50、60、70 min 5个不同水平的压热时间,固定淀粉乳浓度30%、压热温度121 ℃、回生温度4 ℃、回生时间24 h。
1.2.4.4 回生温度对RS得率的影响 分别选择4、20、40、60 ℃ 4个不同水平的回生温度,固定淀粉乳浓度30%、压热温度121 ℃、压热时间40 min、回生时间24 h。
1.2.4.5 回生时间对RS得率的影响 分别选择0、2、6、12、24、36 h 6个不同水平的回生时间,固定淀粉乳浓度30%、压热温度121 ℃、压热时间40 min、回生温度4 ℃。
1.2.5 响应面试验 在响应面试验设计中,参考Box-Behnken实验设计原理,根据单因素对RS得率的影响顺序,选择淀粉乳浓度、压热温度、压热时间、回生时间作为因子,RS得率为响应值,设计响应面试验因素与水平(见表1),并对试验进行回归分析和显著性检验。

表1 响应面试验因素与水平表Table 1 Factor and level table of response surface experiment
1.2.6 蚕豆抗性淀粉得率(RS%)的测定
1.2.6.1 葡萄糖标准曲线的制作 1 mg/mL葡萄糖标准溶液的配制:称量100 mg D-无水葡萄糖,并用水稀释后于100 mL容量瓶中定容。吸取葡萄糖标准溶液0、0.20、0.40、0.60、0. 80、1.00、1.20、1.40 mL分别加入到25 mL容量瓶中,加水使总体积为2 mL,加入2 mL DNS试剂,摇匀后放入沸水浴,5 min后取出用水冷却,最后加水定容。用水作空白试验,并通过紫外分光光度计在520 nm下测量吸光度 A。以葡萄糖含量X(mg)与吸光度Y(A)为横、纵坐标[17],得到回归方程Y=0.8762X-0.0895,R2=0.9998。
1.2.6.2 蚕豆抗性淀粉得率(RS%)的计算 参照Champ的测定方法[18]:称量样品100 mg,置于50 mL尖底离心管。加入pH为2.0的克拉克缓冲液10 mL,完全湿润样品,再加入0.2 mL胃蛋白酶,于37 ℃恒温水浴振荡60 min,除去蛋白质;在室温下冷却后,将pH调节至中性并加入pH6.0的柠檬酸盐缓冲液,再加入耐高温的α-淀粉酶,95 ℃下水浴振荡30 min;冷却至室温,4000 r/min、15 min离心,弃去上层清液,用去离子水洗涤沉降物3次;向沉淀中加入3 mL的去离子水使其充分混匀后,加入3 mL 4 mol/L的KOH溶液,混匀,于室温下不断振荡30 min;将pH调节至中性,加入pH4.5的乙酸钠缓冲液,再加入葡萄糖淀粉酶,并在60 ℃下水浴中振荡60 min;冷却,4000 r/min、15 min离心,收集上层清液,洗涤沉降物,重复3次,并合并所有上清液,加水定容至100 mL,取出2 mL,用3,5-二硝基水杨酸法测定溶液中的葡萄糖含量,并换算为抗性淀粉含量。抗性淀粉得率的计算公式如下:
式中:G表示葡萄糖含量;0.9437表示葡萄糖转换为抗性淀粉的换算系数。
1.2.7 蚕豆淀粉与抗性淀粉的结构表征
1.2.7.1 X-射线衍射分析 测量条件:采用Cu-ka靶,石墨单色仪,Ni过滤器,加速电压40 kV,电流30 mA,测量角2θ=5~80°,步宽2θ=0.02°,扫描速度2°/min[19]。
1.2.7.2 傅里叶红外光谱分析 称取适量的样品和纯溴化钾在100 ℃的烘箱中干燥至恒重,称取一定量的纯溴化钾,8~10 min后加入1~3 mg样品,继续充分研磨,然后将上述混合物压片,在范围400~4000 cm-1的波数范围内扫描分析[20]。
1.2.7.3 电子显微镜扫描观察 把实验专用胶贴在载物台上,挑取微量的绝干样品粘在上面,并使其分布均匀无聚堆现象,放入镀金器中真空镀金,然后经过短暂干燥,放进扫描电子显微镜中,在实验所需的放大倍数下扫描、观察和拍摄特征图片[21]。
1.3 数据处理
所有试验重复3次,数据均以算数平均值带入,采用Origin 8.0软件作图,使用SPSS 16.0软件分析数据结果,设置显著水平P<0.05,极显著水平P<0.01,中心组合数据处理使用Design Expert 8.0.6软件进行。
2 结果与分析
2.1 单因素实验
2.1.1 不同淀粉乳浓度对RS得率的影响 不同淀粉乳浓度对RS得率的影响如图1所示。由图1可知,一开始增加淀粉乳浓度,蚕豆抗性淀粉得率一直增加,当淀粉乳浓度为30%时,蚕豆抗性淀粉得率最多,随着淀粉乳浓度持续增长,蚕豆抗性淀粉得率并没有继续升高。这可能是水分进入到淀粉体系内,水分含量增加使其变黏,颗粒吸收水分膨胀而导致分子结晶受阻;或者可能在一定温度下糊化造成直链淀粉分子分开,在后来的冷却回生中,体系中水分不够而不能继续糊化,分子无法进入结晶区内,使分子间氢键破坏不彻底,不能形成双螺旋结构,直链淀粉分子不溶出,无法重结晶,进而导致蚕豆抗性淀粉得率降低[22-23]。因此,淀粉乳浓度选择为30%。

图1 淀粉乳浓度对抗性淀粉得率的影响Fig.1 Effect of starch concentrationon the yield of resistant starch
2.1.2 不同压热温度对RS得率的影响 不同压热温度对RS得率的影响如图2所示。首先,蚕豆抗性淀粉得率随着温度的增加而升高,并在121 ℃达到峰值。当升至126 ℃时,得率下降。这可能是淀粉溶解和溶胀的原因,两者都在压热后随温度升高而增加。淀粉乳体系黏度降低,直链淀粉分子得到充分伸展,结合成氢键,利于分子溶出,过高的温度会使淀粉颗粒破裂,淀粉分子逸出,导致双螺旋中的部分氢键开始断裂,范德华力被削弱[24-25];也可能是由于淀粉破裂成其他小分子,不能再聚合成晶体[26]。因此,压热温度选择为121 ℃。

图2 压热温度对抗性淀粉得率的影响Fig.2 Effect of temperature on yield of resistant starch
2.1.3 不同压热时间对RS得率的影响 不同压热时间对RS得率的变化如图3所示。在一定时间内,蚕豆抗性淀粉的得率随时间增加,在40 min到达峰值,随后得率逐渐下降。这可能是因为分子降解严重,并且由于聚合度不足,直链淀粉分子四处运动而难以重新结合而不再增加[27]。因此,当压热时间选择为40 min。
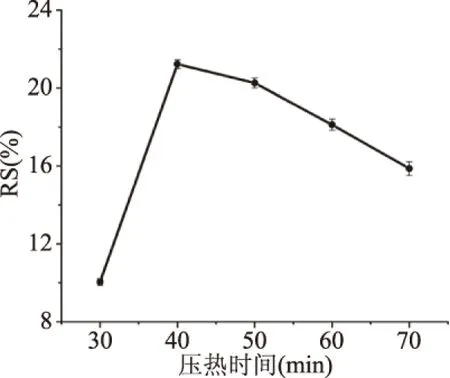
图3 压热时间对抗性淀粉得率的影响Fig.3 Effect of compression heat timeon yield of resistant starch
2.1.4 不同回生温度对RS得率的影响 不同回生温度对RS得率的变化如图4所示。蚕豆抗性淀粉的得率随着温度的增加而迅速下降,当到达40 ℃时,得率最低,且继续上升温度,得率仍低于4 ℃[28]。在回生过程中,一定的温度可促进抗性淀粉的形成,因为低温能加速晶核和晶体的生长,或者淀粉乳的黏度大,晶体生长在后期回生阶段受到阻碍,如果涉及到支链分子,晶体的生长还将受到严重抑制[29]。因此,蚕豆抗性淀粉的回生温度选在4 ℃较为合适。
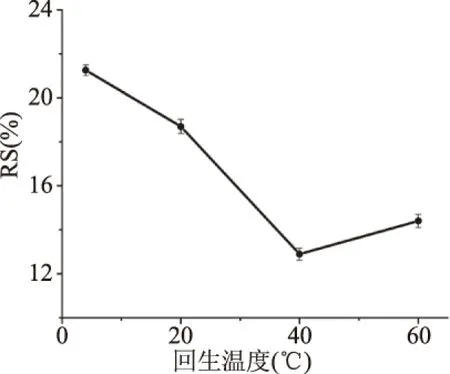
图4 回生温度对抗性淀粉得率的影响Fig.4 Effect of regeneration temperatureon the yield of resistant starch
2.1.5 不同回生时间对RS得率的影响 不同回生时间对RS得率的变化如图5所示。一开始,蚕豆抗性淀粉的得率随时间升高,这可能是在回生过程中,晶核增长的特点是由慢到十分缓慢,开始2 h内形成一半的总晶核量,且在12 h内,晶核的生成速率较快,12 h过后开始变慢,时间超过24 h后,回生过程基本趋于平缓[30],这与上述结果一致。然而,在实验过程中,抗性淀粉从24 h缓慢增加至36 h,这可能是部分支链淀粉也参与了回生所致,考虑到实验便利和经济,回生时间不宜过长,因此回生时间选在24 h较为适宜。

图5 回生时间对抗性淀粉得率的影响Fig.5 Effect of regeneration timeon the yield of resistant starch
2.2 响应面试验
2.2.1 响应面试验结果及方差分析 响应面试验设计与结果见表2所示。根据表2中的数据,因子(A、B、C、D)和响应值(Y)之间的多元二次回归方程

表2 响应面试验设计与结果Table 2 Design and results of response surface experiment
如下:
Y=25.41+1.01A+1.90B-0.13C+1.54D-0.18AB+0.35AC-0.83AD+1.72BC+0.74BD-1.56CD-3.42A2-5.53B2-1.94C2-1.49D2
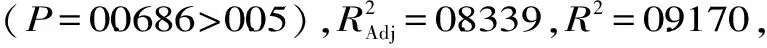
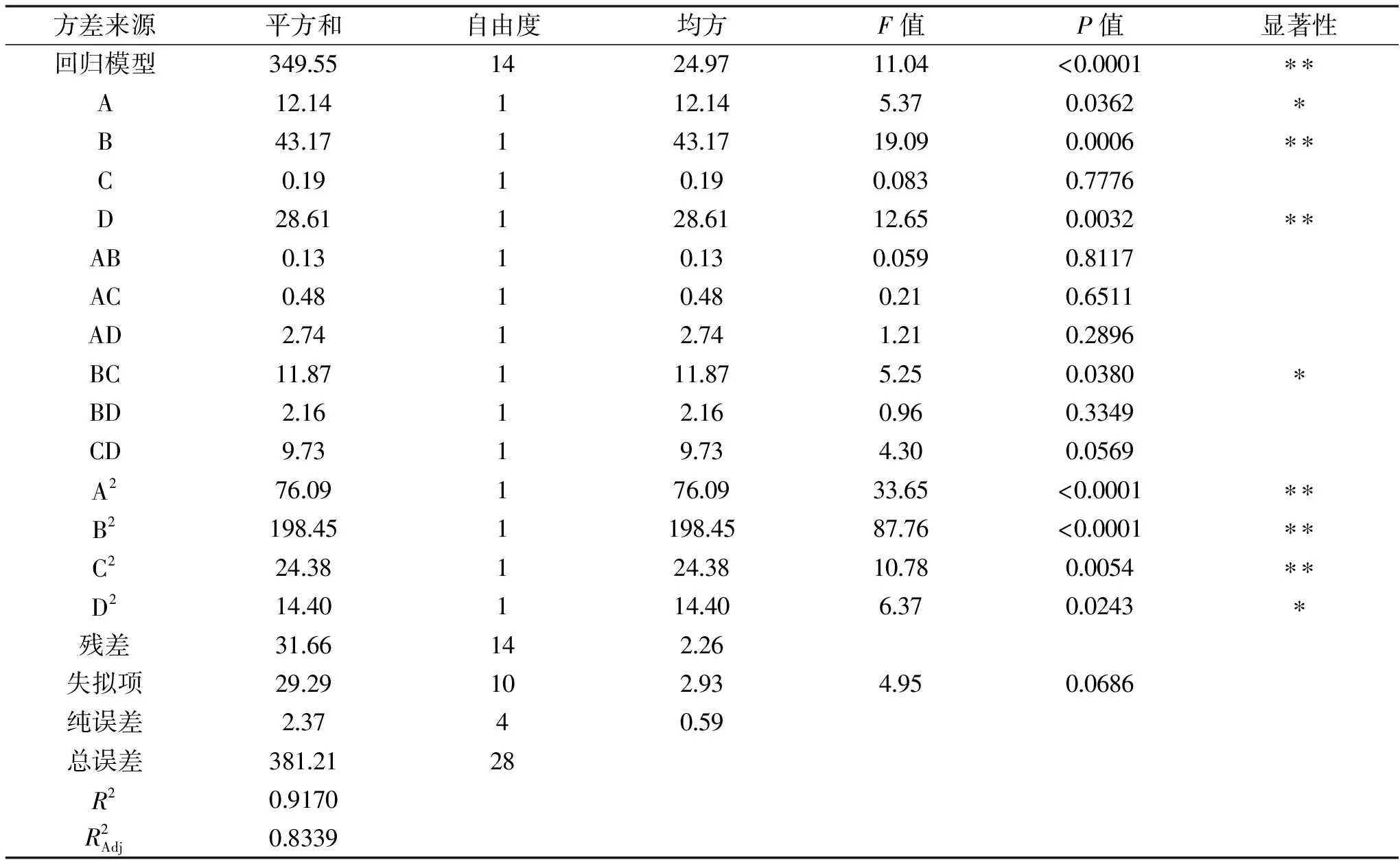
表3 响应面试验设计回归方程系数显著性检验Table 3 Regression equation coefficient significance test for response surface experiment design
2.2.2 交互作用的响应曲面分析 RS在制备过程中,控制因素条件的改变会影响其得率,响应曲面图弯曲度和等高线形状及其密集程度与两因素在交互作用的显著性相关。从图6可以看出,控制淀粉乳为30%且回生24 h,RS得率随压热温度的增加而先升高后降低,随压热时间的延长也先升高后降低,当温度达到为120.5 ℃,时间在40 min时,RS达到最大,但后者的变化对RS得率影响较大,且响应面坡度较陡峭,说明两者之间的相互作用对RS得率有显著影响,这与方差分析的结果一致。

图6 压热温度和压热时间对抗性淀粉得率影响的响应面图和等高线图Fig.6 Response surface diagram and contour diagram ofthe influence of pressing temperature andheating time on the yield of resistant starch
2.2.3 最佳工艺参数确定与验证 采用Desigin-Expert 8.05软件分析,得到蚕豆抗性粉制备的最佳工艺条件为:淀粉乳浓度为30.51%,121.49 ℃下压热37.8 min,4 ℃下回生31.91 h,模型预测的蚕豆抗性淀粉最大预测得率为26.13%±1.50%。考虑到实际操作的可加工性,调整后的制备参数是:淀粉乳浓度31%,121 ℃下压热38 min,4 ℃下回生32 h,三次验证试验表明,抗性淀粉的平均得率为26.80%±0.82%,相对误差仅为2.56%,表明回归模型可以有效指导制备过程的优化。
2.3 淀粉与抗性淀粉的结构表征
2.3.1 结晶结构分析 从图7和数据分析可知,蚕豆淀粉在15.07、16.77、17.26、17.97和22.45 °时显示出强烈的衍射峰。抗性淀粉在14.87、15.94、17.06、17.83和23.16 °呈现强衍射峰,根据上述内容可将两种淀粉分别划分为A型淀粉、C型淀粉[31],淀粉的整体结晶度为10.3%,抗性淀粉的整体结晶度有所升高,为11.7%[32]。这可能是由于在将淀粉制备成抗性淀粉期间,加热改变了晶体结构,导致各个特征峰的消失和新特征峰的出现。而抗性淀粉在16.77和23.16 °时有出现不同的特征峰,说明RS中淀粉分子结构被打乱破坏重新凝聚成晶体结构。
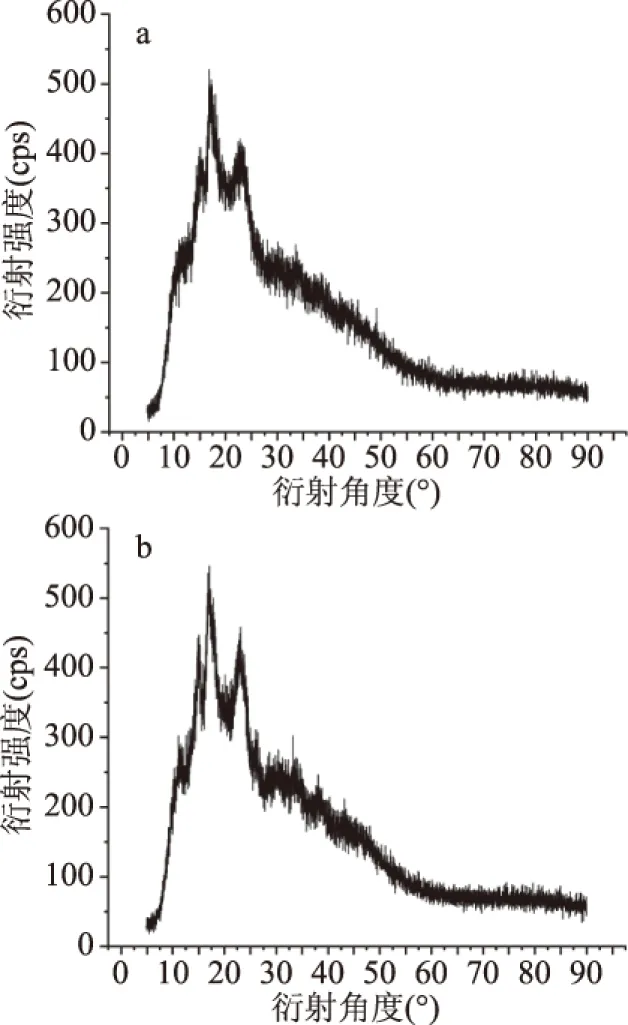
图7 蚕豆淀粉(a)与抗性淀粉(b)的X-射线衍射分析图Fig.7 X-ray diffraction analysis ofbroad bean starch(a)and resistant starch(b)
2.3.2 红外光谱分析 图8是蚕豆淀粉与其抗性淀粉的红外光谱扫描图。蚕豆淀粉与其抗性淀粉在3280 cm-1,3360、3290 cm-1处分别显示出较强羟基缔合-OH伸缩振动;在2980、2990 cm-1时分别出现强饱和-CH伸缩振动;在1770、1710 cm-1,1780、1710 cm-1下分别出现醛基C=O伸缩振动特征吸收峰[33];在1480 cm-1下出现的强特征吸收峰均是CH3对称和非对称的弯曲振动;在1180、1130 cm-1下均出现伯、仲醇羟基相连的C-O-C的特征伸缩振动;D型吡喃葡萄糖的I型吸收带(吡喃环的不对称伸缩振动),则出现在995、999 cm-1处;在877、815 cm-1,874、827 cm-1下出现D-吡喃葡萄糖的α型吸收带;与蚕豆淀粉相比,抗性淀粉的-OH伸缩振动峰向低波数方向位移,表明在其制备过程中发生了氢键的相互作用[34];1180、874 cm-1处的吸收峰减弱,这是由于压热后醛基和分子间羟基形成的氢键破坏所致;在999 cm-1处的吸收峰增强,但小于蚕豆淀粉995 cm-1处的吸收峰表明在蚕豆淀粉经压热处理后D-吡喃葡萄糖的I型吸收带减弱。

图8 红外光谱扫描图Fig.8 Scanning infrared spectrum
2.3.3 表观形貌分析 蚕豆淀粉及其抗性淀粉的扫描电镜图(×1000)如图9所示。由图9可知,蚕豆淀粉颗粒多为完整的大小不一的椭球形,且表面较为平整(左);压热处理后,形态发生显著变化,呈不规则地层叠或多边形堆积,表面粗糙,起皱(右)。这可能是由于淀粉在加压加热处理过程中氢键断裂,范德华力削弱导致晶体结构受到破坏;或者在热处理之后,淀粉双螺旋分子链溶解并连续延伸和折叠以形成不同形状的层状结构[33,35]。

图9 蚕豆淀粉(a)和抗性淀粉(b)扫描电子显微镜图Fig.9 Scanning electron micrograph ofbroad bean starch(a)and resistant starch(b)
3 结论
蚕豆抗性淀粉制备的最佳参数为:淀粉乳浓度31%,121 ℃下压热38 min,4 ℃回生32 h,抗性淀粉的平均得率为26.80%±0.82%,与预测值相对误差仅为2.56%。压热处理前后,抗性淀粉的表面结构从原始光滑完整的椭圆形颗粒转变为不规则粗糙的褶皱块,蚕豆淀粉在制备成抗性淀粉前后属于物理变化,但蚕豆抗性淀粉的-OH伸缩振动峰形变宽,发生红移,分析蚕豆淀粉与抗性淀粉的衍射角,发现两种淀粉从A型变为C型,且结晶度整体上升。
