宁麦9号与扬麦158株高及其构成因素的遗传解析
2020-05-21张平平马鸿翔
姜 朋 何 漪 张 旭 吴 磊 张平平 马鸿翔
宁麦9号与扬麦158株高及其构成因素的遗传解析
姜 朋 何 漪 张 旭 吴 磊 张平平 马鸿翔*
江苏省农业科学院 / 江苏省农业生物学重点实验室 / 江苏省现代作物生产协同创新中心, 江苏南京 210014
宁麦9号与扬麦158是我国长江中下游麦区的主栽品种和骨干亲本, 长江中下游麦区近3年来审定品种中80%都是其衍生后代, 研究其性状的遗传具重要意义。以宁麦9号与扬麦158为亲本构建的包含282个家系的重组自交系群体为材料, 利用Illumina 90k芯片对群体进行基因型分析, 建立高密度遗传图谱。连续3个生长季对株高及节间长度、穗长等株高构成因素进行测定, 结合遗传图谱对株高及相关性状进行QTL定位, 获得14个控制株高及其构成因素的稳定表达位点。通过进一步位置比对, 聚焦到6个染色体区段, 初步明确了各节间对株高的遗传调控机制。同时, 将6个染色体区段中同源性较低的连锁标记转化为适用于高通量筛选的KASP标记, 利用101份区域试验材料进行标记效应验证, 结果显示聚合与两个位点具有较高的选择效率, 继续聚合后, 中选材料显著减少, 可能降低选择效率; 对与两个一因多效位点的选择建议以降低株高的等位变异为主;可作为穗下节间(D1)的选择标记对株高展开优化选择。期望以上结果能为长江中下游麦区的小麦株高遗传改良提供帮助。
小麦; 宁麦9号; 扬麦158; 株高; KASP标记
株高是小麦重要的农艺性状, 影响植株的形态结构, 并与田间群体产量密切相关。小麦矮秆基因的利用是绿色革命的重要组成部分, 对现代小麦育种具有深远影响[1]。经典遗传学研究表明, 小麦株高是一个复杂性状, 由多个基因控制, 存在主效基因, 也有微效位点。迄今为止, 已有25个基因被命名[2-4]。位于 4B 和 4D 染色体上的和基因, 以及2D染色体上的基因在世界范围内广为应用, 其相关分子标记已成功开发[5-6]。此外, 在小麦21条染色体上均检测到影响株高的QTL[7-11]。McCartney等[12]利用RL4452בAC’ Domain构建的DH群体对包括株高在内的多个农艺性状进行QTL分析, 在 2D、 4B、4D、5B、7A和7B染色体检测到6个株高QTL, 其中和的定位区间与和位置重合。Griffiths等[13]利用4个DH群体进行了株高meta-QTL分析, 在除3D、4A、5D及第7同源群外的15条染色体上找到16个meta-QTL。Liu等[9]在5个生长阶段对小麦株高进行了跟踪调查, 利用条件与非条件QTL作图方法进行分析, 检测到8个条件QTL与9个非条件QTL。其中在2个时期被重复检测到, 表型贡献率达13.42%~16.13%, 此研究表明株高基因的表达具有一定的时空特异性。小麦株高是主穗长与各节间长的总和, 但控制主穗长及各茎节间长的遗传位点对小麦株高的遗传贡献并不一致。Cui等[14]利用条件QTL与非条件QTL相结合的分析方法在单个QTL水平揭示了株高与穗长及各节间长之间的关系, 其中倒三节对株高影响最大。Zhang等[15]测定了不同时期的各个节间长度, 明确了5个稳定的株高QTL的表达模式及贡献率。
遗传连锁图为遗传定位、标记开发及候选基因发掘等提供了强有力的工具。近年来发展起来的SNP标记具有遗传稳定、数量多、分布广等特点, 并且适于高通量检测, 基于其开发的9k、90k、660k等基因型芯片集合了成千上万个SNP标记, 不仅加快了小麦遗传图谱构建速度, 也大大提高了小麦遗传图谱的密度[16-18]。中国春小麦参考基因组序列的公布, 有助于小麦遗传图谱质量的提高, 并可直接基于目标区段进行候选基因预测[19]。
长江中下游麦区是我国第二大麦区, 同时也是我国最大的弱筋小麦产区, 是我国小麦生产的重要组成部分。宁麦9号与扬麦158分别是由江苏省农业科学院与江苏里下河地区农业科学研究所育成的高产优质抗病小麦品种, 都曾经是生产上的主栽品种, 具有较大的推广面积, 而且目前仍是重要的骨干亲本, 以此为基础育成了数十个小麦品种[20-21]。宁麦9号的衍生品种宁麦13、扬辐麦4号等, 扬麦158的衍生品种扬麦20等均已成为当前生产中的主栽品种及常用亲本。在生产中, 宁麦9号株高一般在80~ 85 cm, 扬麦158约为90~95 cm, 呈现较大差异, 明确其株高遗传机制对小麦育种工作具有重要的指导意义。本研究以来源于宁麦9号/扬麦158的282份重组自交系为材料, 结合高密度遗传图谱, 对株高及其构成开展QTL定位研究, 以期为长江中下游麦区育种工作中的株高选择提供帮助。
1 材料与方法
1.1 试验材料
以宁麦9号×扬麦158构建重组自交系(RIL)群体(F2:8), 包括282个家系。宁麦9号是扬麦6号与日本西风小麦的杂交后代, 前者具有骨干亲本南大2419与江东门的遗传背景; 扬麦158来源于St1472/506与扬麦4号杂交组合, St1472/506是黄淮麦区的常用亲本, 扬麦4号含有南大2419、胜利麦与阿夫等多个骨干亲本的遗传背景。宁麦9号与扬麦158株高及各节间长度、穗长等性状差异显著(图1)。通过Ellis等[5]和Asplund等[6]报道的分子标记确定宁麦9号与扬麦158均为/变异类型, 均不含位点(图2), 其株高差异可能来源于其他位点。

图1 宁麦9号与扬麦158的田间表现

图2 宁麦9号与扬麦158株高相关分子标记检测
a: 宁麦9号; b: 扬麦158; M: marker。
a: Ningmai 9; b: Yangmai 158; M: marker.
1.2 田间试验及数据处理
2016—2017、2017—2018和2018—2019连续3个生长季将RIL群体及其亲本种植于江苏省农业科学院六合基地, 为方便描述, 以收获年份2017、2018和2019分别表示3个环境。采用随机区组设计, 单行种植, 每行60粒, 行长1.6 m, 行距0.25 m, 2次重复, 常规田间管理。
于小麦乳熟期从每个家系中取10个单茎, 从茎基部开始向上利用直尺测量每个节间-倒五节(The fifth internode from the top, D5)、倒四节(The fourth internode from the top, D4)、倒三节(The third internode from the top, D3)、倒二节(The second internode from the top, D2)、倒一节(The first internode from the top, D1)长度及穗长, 株高为各节间与穗长之和, 并计算平均值用于进一步统计分析。另同时测量101份2018国家及省区域试验材料的株高, 用于后续验证。
采用Microsoft Excel 2016进行表型初步统计与相关分析, 采用SPSS 19.0进行方差分析及检测。依据He等[22]的方法, 按2=δ2/(δ2+δ2/+δ/)计算遗传力, 其中δ2表示基因型方差,δ2表示基因型与环境互作方差,δ2为误差,代表环境数目,代表重复数。
1.3 遗传图谱与QTL分析
采用Illumina 90k芯片获取基因型。遗传图谱覆盖21条染色体, 包含41个连锁群, 2285个bin标记, 总长为3022 cM[23]。采用QTL IciMapping 4.1软件[24]的完备区间作图法(inclusive composite interval mapping, ICIM)进行QTL定位[25], 设walking step为0.1 cM, LOD阈值为2.5。
1.4 KASP标记的开发
根据SNP位点和侧翼序列设计PCR扩增引物, 开发KASP分子标记。设计每个标记2条SNP特异性引物(F1/F2)和一条通用引物(R), F1尾部添加能够与FAM荧光结合的特异性序列, F2尾部添加能够与HEX荧光结合的特异性序列。利用Polymarker (http://www.polymarker.info/)设计KASP引物, 由生工生物工程(上海)股份有限公司合成。
从RILs群体中随机挑选46份材料进行幼嫩叶片取样, 采用CTAB法[25]提取基因组DNA。KASP反应总体系为5 μL, 包含2×KASP Master Mix 2.5 μL、KASP Assay Mix (引物混合工作液) 0.07 μL、浓度为20 ng μL–1的模板DNA 2.43 μL。KASP反应程序第一步为94℃, 15 min; 第二步为94℃, 20 s, 61~55℃, 1 min, 每个循环降低0.6℃, 共进行10个循环; 第三步为94℃, 20 s, 55℃, 1 min, 共进行26个循环, 在LGC公司为Hydrocycler-16水浴PCR仪中进行PCR。通过KASP荧光分析仪(LGC公司型号为PHERAstar plus)扫描分析PCR结果。
2 结果与分析
2.1 株高及其构成因素的表型分析
在连续3年的调查中(表1), 扬麦158的各节间长度、穗长及株高均高于宁麦9号, 其中D5与D4差异较小, 一般为1~2 cm, D3、D2与D1差异较大, 约为2~3 cm, 穗长相差约1 cm, 最终造成株高相差约10 cm。在RIL群体中, 各节间长度、穗长及株高均呈现较大变异, D5变异系数最大, 约20%, 其余节间、穗长及株高变异系数在10%左右, 最大株高与最小株高差异均超过30 cm, 节间差距从D5的5 cm左右递增至D1的近20 cm。从D5至D1, 性状遗传力从0.43逐步增大至0.83, 穗长与株高遗传力均超过0.7。
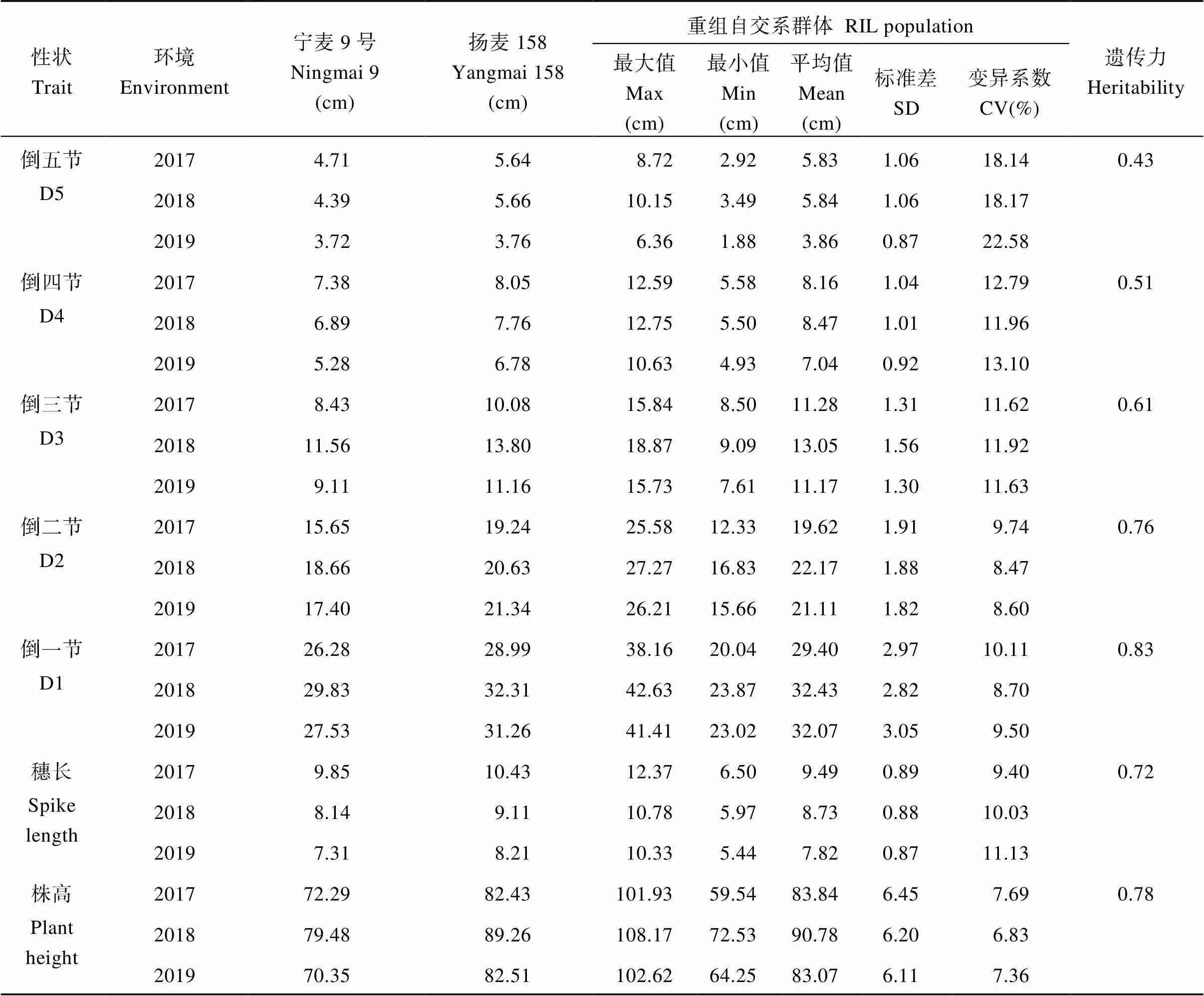
表1 株高及其构成因素的表型统计
D5: the fifth internode from the top; D4: the fourth internode from the top; D3: the third internode from the top; D2: the second internode from the top; D1: the first internode from the top.
株高、穗长及各节间长度在不同基因型与不同年份间差异极显著, 同时基因型与年份的互作对其也有极显著影响(表2)。各节间长度间均呈极显著正相关, 而与穗长相关系数普遍较低。株高与各节间长度、穗长均呈极显著正相关, 而同一节间在不同环境间亦呈现出良好的相关性(表3)。
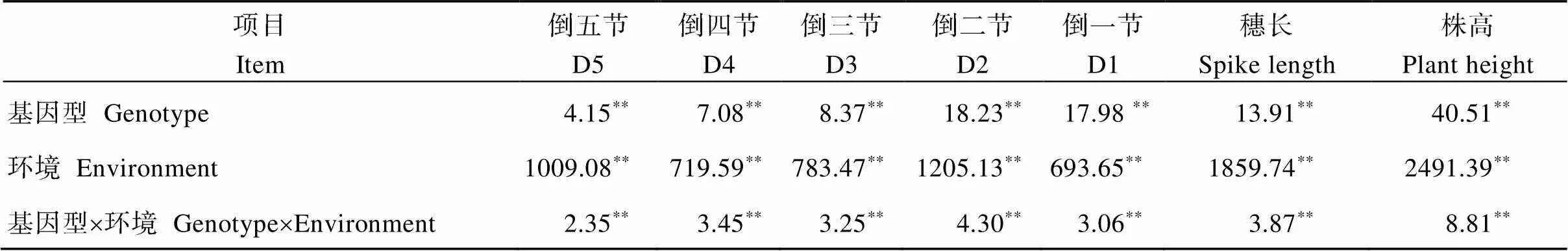
表2 株高及其构成因素的方差分析(F值)
*和**分别表示0.05和0.01显著水平。
*and**indicate significant difference at the 0.05 and 0.01 probability levels, respectively. Abbreviations are the same as those given in Table 1.
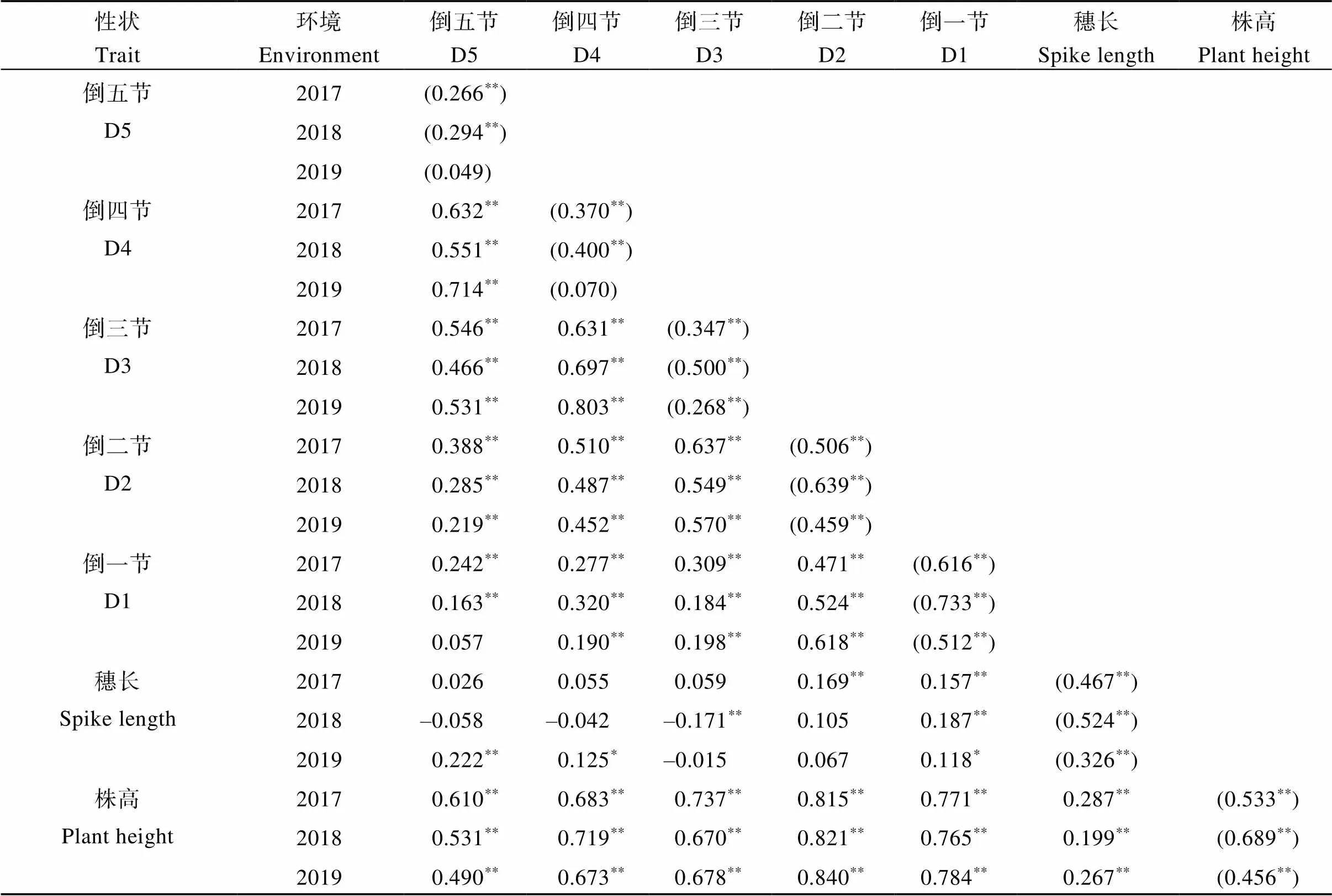
表3 株高及其构成因素的相关分析
*和**分别表示0.05和0.01显著水平; 对角线上括号内数字为同一性状不同环境间的相关系数, 2017为2017年度与2018年度间相关系数, 2018为2018年度与2019年度间相关系数, 2019为2019年度与2017年度间相关系数。
*and**indicate significant difference at the 0.05 and 0.01 probability levels, respectively. The figures in brackets on the diagonal line indicate correlation coefficients between the same traits in different environments. The correlation coefficients between 2017 and 2018 are put in the line of 2017, and those between 2018 and 2019, 2019 and 2017 are put in lines of 2018 and 2019, respectively. Abbreviations are the same as those given in Table 1.
2.2 株高及其构成因素的QTL分析
综合3个环境表型数据, 利用完备区间作图法共鉴定到96个QTL, 分布在18条染色体上, 表型贡献率为1.72%~12.32%。其中, D5至D1分别检测到7、14、17、13和13个QTL, 与穗长相关的QTL有11个, 控制最终株高的QTL有21个。进一步对这些QTL比较分析, 最终在2A、2D、5A、5D、7A等5条染色体上获得14个多环境表达的稳定QTL (图2和表4)。其中, 控制D5、D4及D3长度的QTL均为1个, 控制D2与D1均为3个, 而控制株高的为5个, 没有检测到与穗长相关的稳定QTL。
通过位置比对发现,、、、、和遗传位置接近或重合, 很可能为1个一因多效QTL, 同时控制多个节间的长度。、与,与, 均是相同的情况。为方便描述, 将与分别简写为、与。除此3个QTL外,对D1具有调节作用,同时对D4与D3产生影响。以株高及各节间长度减少定义其加性效应, 这3个位点对应多个性状的加性效应表现一致,的加性效应来源于扬麦158, 而与的加性效应来源于宁麦9号。此外,加性效应来源于宁麦9号,与加性效应来源于扬麦158。
2.3 KASP标记开发
根据定位结果, 我们最终获得6个株高及其构成因素控制区段(图3), 每个区段内含有多个SNP标记, 选择其中序列同源性较低的标记进行KASP标记开发, 最终将IAAV880 ()、IACX9152 ()、BobWhite_c1796_701 ()、BS00098207_51 ()、Kukri_c7786_81 ()与wsnp_JD_c6050_ 7214383 ()等成功转化(表5和图4)。
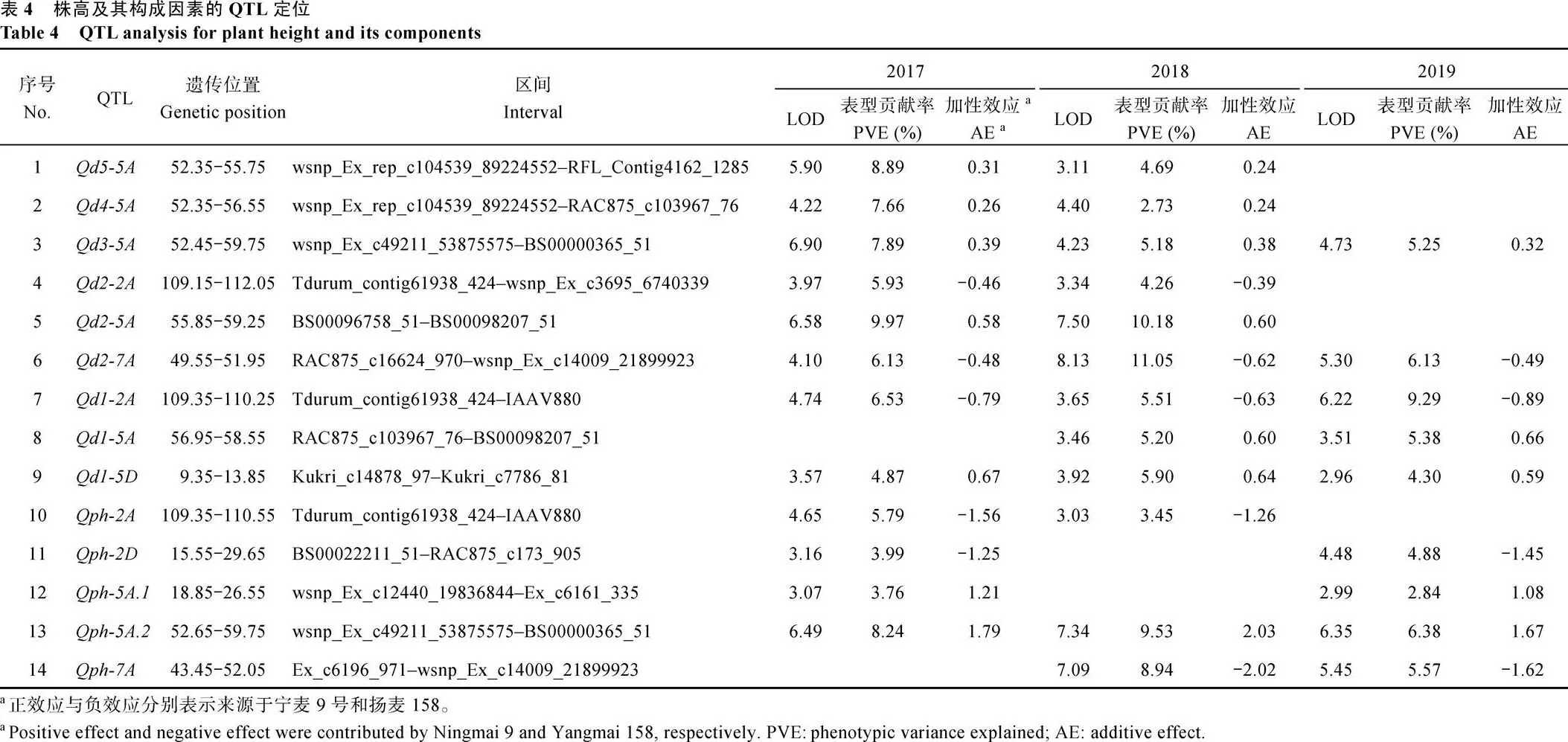
图3 株高及其构成因素的QTL定位
Fig. 3 QTL mapping for plant height and its components
图中数字与表4中QTL的序号一致。
The numbers in the figure are consistent with the sequence numbers of QTL in Table 4.
2.4 KASP标记的验证
为检测已开发KASP标记的功效, 利用101份2018国家及省区域试验材料进行验证。结果显示, 除与外, 其他4个标记的加性效应与定位结果一致(表6)。对于与位点, 仅有不到10%的检测材料中含有宁麦9号等位变异, 这可能影响统计检测结果的准确性; 而主要调控D1长度, 对最终株高影响不显著。在其他3个位点中,对株高有显著影响, 可产生近2 cm的株高差异,、分别产生0.59 cm、1.32 cm的差异, 但未达到显著水平。

表5 株高及其构成因素的KASP标记序列
F1、F2为SNP特异性引物, F1尾部添加能够与FAM荧光结合的特异性序列, F2尾部添加能够与HEX荧光结合的特异性序列; R为通用引物。
F1 and F2 are the specific primers for the SNP, specific sequence with FAM binding fluorescence is added to the end of F1, and that with HEX binding fluorescence is added to the end of F2; R is common primer.
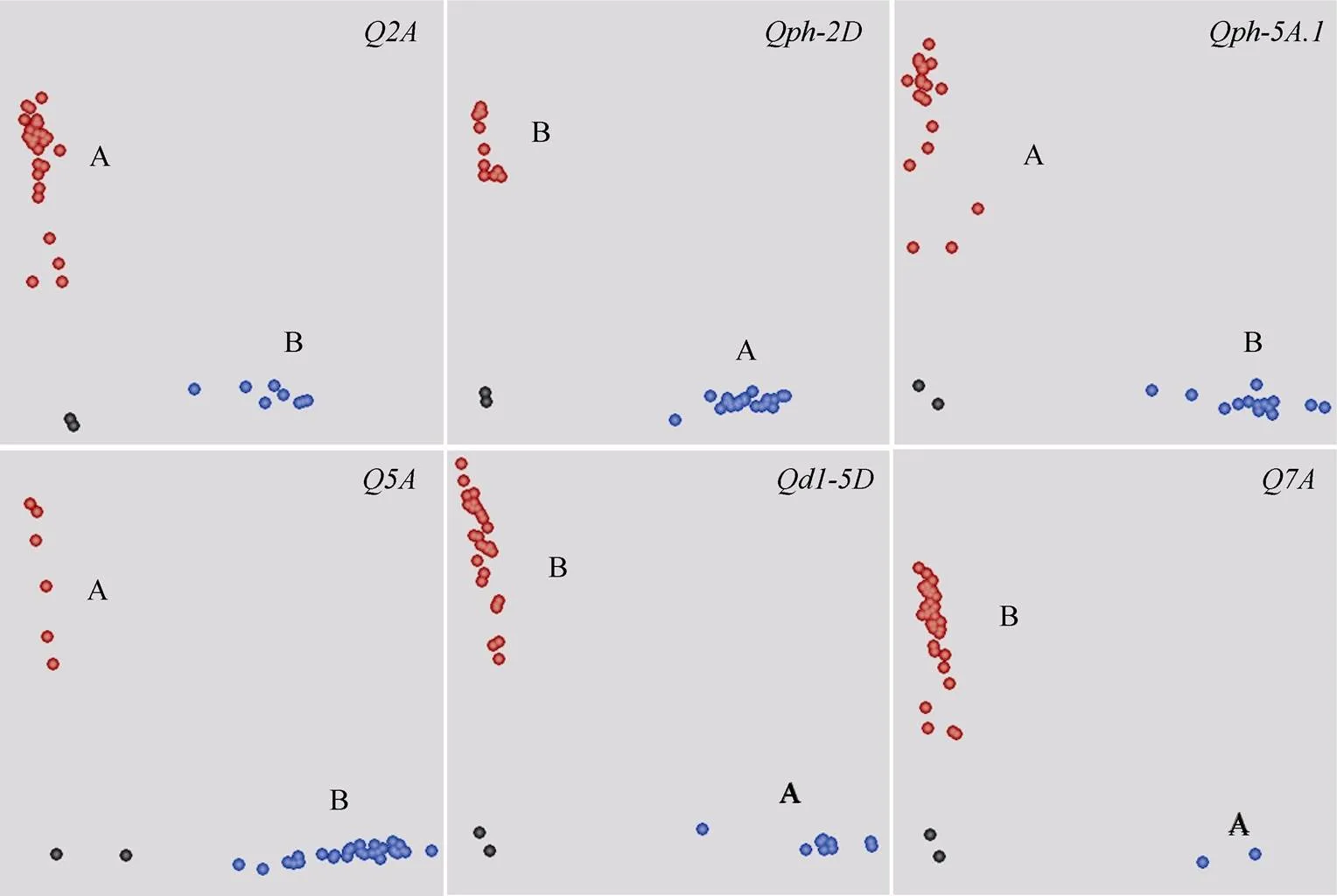
图4 株高及其构成因素的KASP标记开发
Fig, 4 Development of KASP markers for plant height and its components
A表示宁麦9号等位变异类型, B表示扬麦158等位变异类型。
A indicates the allele of Ningmai 9 and B indicates the allele of Yangmai 158.
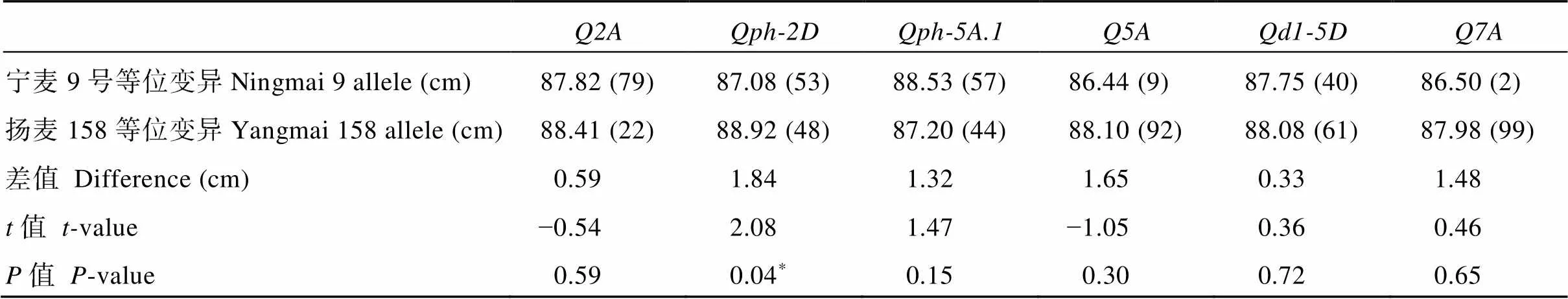
表6 区域试验材料中不同等位变异的t-检测
*表示0.05显著水平; 括号中数字表示携带相应等位变异的材料数量。
*indicates significant difference at the 0.05 probability level. The figures in brackets indicate the number of the materials with corresponding alleles.
按照差异大小逐步分析几个位点的聚合效应发现, 当聚合与位点时, 株高可相差4 cm, 进一步聚合后, 差异超过10 cm, 但材料数量急剧减少, 从降低株高的角度出发, 结合与较单一分子标记选择更加有效, 当聚合更多标记后, 株高降低不显著, 而入选材料有所减少, 选择效率降低。
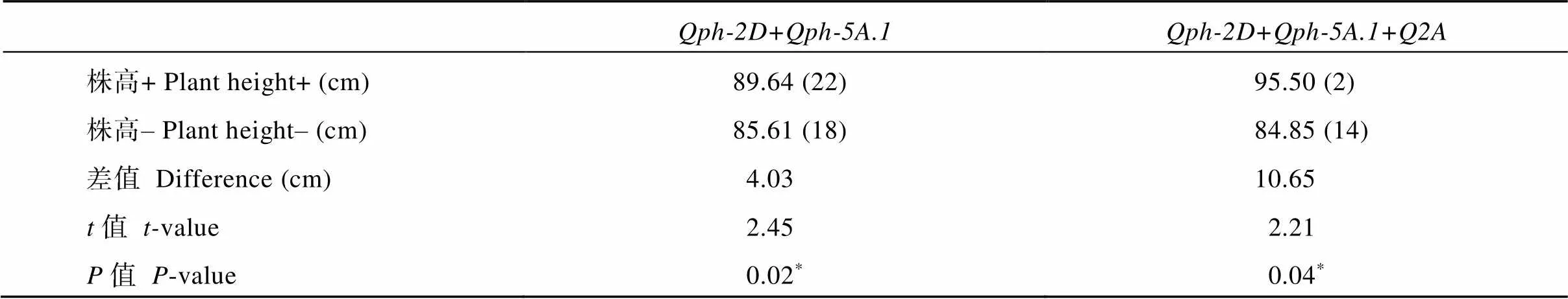
表7 QTL聚合的效应分析
“+”表示增加株高的等位变异组合, “‒”表示降低株高的等位变异组合;*表示0.05显著水平; 括号中数字表示携带相应等位变异的材料数量。
“+” indicates the combination of the alleles which increase plant height, and “‒” indicates the combination of the alleles which reduce plant height;*indicates significant difference at the 0.05 probability level; the figures in brackets indicate the number of the materials with corresponding alleles.
3 讨论
宁麦9号与扬麦158分别于1997年和1993年通过品种审定, 育成后均在生产上大面积种植, 为长江中下游麦区乃至全国具有重大影响力的品种。扬麦158适应性广, 且具有良好的农艺性状和较好的赤霉病抗性[27], 宁麦9号具有突出的弱筋小麦品质, 且多花多粒、结实性高、丰产性好, 还是我国小麦栽培品种赤霉病抗性QTL-的主要供体[28]。这2个品种已经育成超过20年, 在生产中已被后代品种替代, 但它们目前仍被作为杂交亲本应用于小麦育种。当前小麦生产中大面积推广的宁麦13、扬辐麦4号、扬麦20等均为宁麦9号或扬麦158的衍生后代。据统计, 近3年江苏省淮南麦区与国家长江中下游麦区通过审定的小麦品种中, 超过80%是宁麦9号或扬麦158的衍生后代(http://www.jsseed. cn/, http://www.moa.gov.cn/)。此外, 作为我国小麦品种中的主要来源, 宁麦9号已被引入其他麦区作为赤霉病抗性亲本加以利用[29]; 轮选16、轮选66及轮选166等国家黄淮南片麦区的审定品种均含有扬麦158的遗传背景。鉴于此, 针对其重要农艺性状开展遗传研究对更好地在育种中利用这2个材料具实践意义。
宁麦9号与扬麦158株高差异较大。本研究显示扬麦158各节间长度与穗长均大于宁麦9号, 同时遗传因素在株高及其构成因素中占主导作用, 与前人研究结果一致[30-31]。我们通过分子标记检测确定宁麦9号与扬麦158均为/变异类型, 均不含位点。对遗传定位结果比对分析, 最终将影响株高的QTL聚焦到6个染色体区段。通过物理位置比对,位于2D染色体短臂中部, 与位于2D染色体短臂末端的[32]相距较远, 而与Wang等[33]利用条件与非条件QTL作图检测到的接近。梁子英等[34]在5A染色体–区段检测到株高、D4与D5的控制位点, 其位置与基本重合, 而在2019环境中与D4、D3也表现相关。位于5A染色体长臂, 与的关联标记位置接近, 并且来源于日本小麦品种, 而亦来源于含有日本西风小麦血统的宁麦9号, 推测可能为同一位点[32]。位于5D染色体, 其连锁标记、均与相近, 但由于5D染色体标记较少, 覆盖度不足, 是否为同一位点有待进一步验证[32]。前人在2A染色体上鉴定到多个株高控制位点[10,33-34], 但与均相距较远。Peng等[35]在7A染色体短臂末端–区间定位到, 而位于7A染色体短臂中部, 可能为不同的位点。
在小麦育种中, 一般将株高较低的基因型作为优势等位变异。与在101份区域试验材料中呈现较强的选择效应, 多数材料在位点处呈现来源于扬麦158的优势等位变异,与所有节间长度都有关, 可能为一个非常重要的选择位点, 并且很可能经历过早代选择, 使其在高代材料中分布频率较低; 针对此位点, 今后可在低代材料中进行验证, 并同时构建次级分离群体, 为进一步精细定位奠定基础。通过比较基因组学分析发现,附近区域为许多小麦重要农艺、抗性、品质性状控制位点的热点聚集区, 包括开花期、叶枯病、黄色素含量等[36-39], 对其中某些性状的定向选择促使某种基因型被大量保留, 最终导致呈现大量的非优势等位变异。
各节间长度与不同的农艺性状具有一定的相关性[40-41], 特别是植株抗倒性, 研究表明矮秆、D5较短、D1较长的植株有利于协调高产与抗倒性[42]。本研究显示同时调控D1与株高,同时调控D5、D1与株高, 且其对应各性状的加性效应来源一致, 无法通过这2个位点实现D1与D5、株高的差异化选择。前述在多数区域试验材料中呈现来源于扬麦158的降低株高、缩短各节间长度的等位变异,也是多数保留了来源于宁麦9号的降低株高的等位变异, 表明育种家在株高选择中仍以整株株高为主要选择目标, 未考虑各节间的差异性选择, 在选择方向上对这2个一因多效位点的选择以降低株高的等位变异为主。仅控制D1长度, 且对整体株高影响不大(表4和表6), 可作为D1的选择标记。
4 结论
共定位到6个株高控制区段, 并成功转化为适用于大规模筛选的KASP标记, 经过初步验证, 聚合、标记对整体株高具有较高的选择效率; 继续聚合后, 中选材料显著减少, 可能降低选择效率, 而对需要在早代育种材料进一步验证, 并且对与一因多效位点的选择建议以降低株高的等位变异为主;可作为D1的选择标记对株高进行优化选择。
[1] Hedden P. The genes of the green revolution., 2003, 19: 5–9.
[2] Mo Y, Vanzetti L S, Hale I, Spagnolo E J, Guidobaldi F, Al-Oboudi J, Odle N, Pearce S, Helguera M, Dubcovsky J. Identification and characterization of, a locus on chromosome arm 6AS affecting wheat plant height, heading time, and spike development., 2018, 131: 2021–2035.
[3] Tian X, Wen W, Xie L, Fu L, Xu D, Fu C, Wang D, Chen X, Xia X, Chen Q, He Z, Cao S. Molecular mapping of reduced plant height genein bread wheat., 2017, https://doi.org/10.3389/fpls.2017.01379.
[4] McIntosh R A, Dubcovsky J, Rogers W J, Morris C, Xia X C. Catalogue of gene symbols for wheat: 2017 supplement. https://shigen.nig.ac.jp/wheat/komugi/genes/macgene/supplement2017. pdf. Accessed 17 Feb 2018.
[5] Ellis M, Spielmeyer W, Gale K, Rebetzke G, Richards R. “Perfect” markers for theanddwarfing genes in wheat., 2002, 105: 1038–1042.
[6] Asplund L, Leino M W, Hagenblad J. Allelic variation at thelocus in a 19th century wheat collection., 2012, 2012: 385610.
[7] Börner A, Schumann E, Fürste A, Cöster H, Leithold B, Röder S, Weber E. Mapping of quantitative trait loci determining agronomic important characters in hexaploid wheat (L.)., 2002, 105: 921–936.
[8] Peng J, Yefim R, Tzion F, RiDer M S, Youchun L, Eviatar N, Abraham K. Domestication quantitative trait loci in, the progenitor of wheat., 2003, 100: 2489–2494.
[9] Liu G, Xu S B, Ni Z F, Xie C J, Qin D D, Li J, Lu L H, Zhang J P, Peng H R, Sun Q X. Molecular dissection of plant height QTLs using recombinant inbred lines from hybrids between common wheat (L.) and spelt wheat (L.)., 2011, 56: 1897–1903.
[10] Griffiths S, Simmonds J, Leverington M, Wang Y, Fish L, Sayers L, Alibert L, Orford S, Wingen L, Snape J. Meta-QTL analysis of the genetic control of crop height in elite European winter wheat germplasm., 2012, 29: 159–171.
[11] Tobias W, Langer S M, Longin C F H. Genetic control of plant height in European winter wheat cultivars., 2015, 128: 865–874.
[12] Mccartney C A, Somers D J, Humphreys D G, Lukow O, Ames N, Noll J, Cloutier S, McCallum B D. Mapping quantitative trait loci controlling agronomic traits in the spring wheat cross Rl4452x ‘AC Domain’., 2005, 48: 870.
[13] Griffiths S, Simmonds J, Leverington M, Wang Y, Fish L, Sayers L, Alibert L, Orford S, Wingen L, Herry L, Faure S, Laurie D, Bilham L, Snape J. Meta-QTL analysis of the genetic control of ear emergence in elite European winter wheat germplasm., 2009, 119: 383–395.
[14] Cui F, Li J, Ding A, Zhao C, Wang L, Wang X, Li S, Bao Y, Li X, Feng D, Kong L, Wang H. Conditional QTL mapping for plant height with respect to the length of the spike and internode in two mapping populations of wheat., 2011, 122: 1517–1536.
[15] Zhang N, Fan X, Cui F, Zhao C, Zhang W, Zhao X, Yang L, Pan R, Chen M, Han J. Characterization of the temporal and spatial expression of wheat (L.) plant height at the QTL level and their influence on yield-related traits., 2017, 130: 1235–1252.
[16] Cavanagh C R, Shiaoman C, Shichen W, Bevan Emma H, Stuart S, Seifollah K, Kerrie F, Cyrille S, Brown-Guedira G L, Alina A. Genome-wide comparative diversity uncovers multiple targets of selection for improvement in hexaploid wheat landraces and cultivars., 2013, 110: 8057–8062.
[17] Wang S, Wong D, Forrest K, Allen A, Chao S, Huang B E, Maccaferri M, Salvi S, Milner S G, Cattivelli L. Characterization of polyploid wheat genomic diversity using a high-density 90,000 single nucleotide polymorphism array., 2014, 12: 787–796.
[18] Cui F, Zhang N, Fan X, Zhang W, Zhao C, Yang L, Pan R, Chen M, Han J, Zhao X. Utilization of a wheat660k SNP array-derived high-density genetic map for high-resolution mapping of a major QTL for kernel number., 2017, 7: 3788.
[19] Consortium T I W G S. Shifting the limits in wheat research and breeding using a fully annotated reference genome., 2018, 361: eaar7191.
[20] 张晓, 张伯桥, 江伟, 吕国锋, 张晓祥, 李曼, 高德荣. 扬麦系列品种品质性状相关基因的分子检测. 中国农业科学, 2015, 48: 3779–3793. Zhang X, Zhang B Q, Jiang W, Lyu G F, Zhang X X, Li M, Gao D R. Molecular detection for quality traits-related genes in Yangmai series wheat cultivars., 2015, 48: 3779–3793 (in Chinese with English abstract).
[21] Jiang P, Zhang P P, Zhang X, Ma H X. Genetic contribution of Ningmai 9 wheat to its derivatives evaluated by using SNP markers., 2016, 2016: 3602986.
[22] He X, Lillemo M, Shi J, Wu J, Bjørnstad Å, Belova T, Dreisigacker S, Duveiller E, Singh P. QTL characterization ofhead blight resistance in CIMMYT bread wheat line Soru#1., 2016, 11: e0158052.
[23] Jiang P, Zhang X, Wu L, He Y, Zhuang W, Cheng X, Ge W, Ma H, Kong L. A novel QTL on chromosome 5AL of Yangmai 158 increases resistance tohead blight in wheat., 2020, 69: 249–258.
[24] Meng L, Li H H, Zhang L Y, Wang J K. QTL IciMapping: integrated software for genetic linkage map construction and quantitative trait locus mapping in biparental populations., 2015, 3: 269–283.
[25] Li H, Ye G, Wang J. A modified algorithm for the improvement of composite interval mapping., 2007, 175: 361–374.
[26] Saghai-Maroof M A, Soliman K M, Jorgensen R A, Allard R W. Ribosomal DNA spacer-length polymorphisms in barley: mendelian inheritance, chromosomal location, and population dynamics., 1984, 81: 8014–8018.
[27] 程顺和, 张勇, 张伯桥, 高德荣, 吴宏亚, 陆成彬, 吕国锋, 王朝顺. 小麦抗赤霉病育种2条技术路线的探讨. 扬州大学学报(农业与生命科学版), 2003, 24: 59–62. Cheng S H, Zhang Y, Zhang B Q, Gao D R, Wu H Y, Lu C B, Lyu G F, Wang C S. Discussion of two ways of breeding scab resistance in wheat.(Agric & Life Sci), 2003, 24: 59–62 (in Chinese with English abstract).
[28] 朱展望, 徐登安, 程顺和, 高春保, 夏先春, 郝元峰, 何中虎. 中国小麦品种抗赤霉病基因的鉴定与溯源. 作物学报, 2018, 44: 473–482. Zhu Z W, Xu D A, Cheng S H, Gao C B, Xia X C, Hao Y F, He Z H. Characterization ofhead blight resistance geneand its putative ancestor in Chinese wheat germplasm., 2018, 44: 473‒482 (in Chinese with English abstract).
[29] 张宏军, 宿振起, 柏贵华, 张旭, 马鸿翔, 李腾, 邓云, 买春艳, 于立强, 刘宏伟, 杨丽, 李洪杰, 周阳. 利用基因功能标记选择提高黄淮冬麦区小麦品种对赤霉病的抗性. 作物学报, 2018, 44: 505–511. Zhang H J, Su Z Q, Bai G H, Zhang X, Ma H X, Li T, Deng Y, Mai C Y, Yu L Q, Liu H W. Improvement of resistance of wheat cultivars tohead blight in the Yellow-Huai rivers valley winter wheat zone with functional marker selection ofgene., 2018, 44: 505‒511 (in Chinese with English abstract).
[30] 陈广凤, 陈建省, 田纪春. 小麦株高相关性状与SNP标记全基因组关联分析. 作物学报, 2015, 41: 1500–1509. Chen G F, Chen J S, Tian J C. Genome-wide association analysis between SNP markers and plant height related traits in wheat., 2015, 41: 1500–1509 (in Chinese with English abstract).
[31] 武炳瑾, 冯洁, 崔紫霞, 张传量, 孙道杰. 利用90k基因芯片进行小麦株高QTL分析. 麦类作物学报, 2017, 5: 578‒584. Wu B J, Feng J, Cui Z X, Zhang C L, Sun D J. QTL analysis of plant height by using 90k chip technology., 2017, 5: 578–584 (in Chinese with English abstract).
[32] Ellis M H, Rebetzke G J, Azanza F, Richards R A, Spielmeyer W. Molecular mapping of gibberellin-responsive dwarfing genes in bread wheat., 2005, 111: 423–430.
[33] Wang Z H, Wu X S, Ren Q, Chang X P, Li R Z, Jing R L. QTL mapping for developmental behavior of plant height in wheat (L.)., 2010, 174: 447–458.
[34] 梁子英, 李美霞, 王竹林, 沈玮囡, 奚亚军, 孙风丽, 刘曙东. 小麦株高相关性状的QTL分析. 西北农业学报, 2014, 23: 64–72. Liang Z Y, Li M X, Wang Z L, Shen W N, Xi Y J, Sun F L, Liu S D. Mapping quantitative trait loci for plant height related characteristics in wheat.,2014, 23: 64–72 (in Chinese with English abstract).
[35] Peng Z S, Li X, Yang Z J, Liao M L. A new reduced height gene found in the tetraploid semi-dwarf wheat landrace Aiganfanmai., 2011, 10: 2349.
[36] Roncallo P F, Cervigni G L, Jensen C, Miranda R, Carrera A D, Helguera M, Echenique V. QTL analysis of main and epistatic effects for flour color traits in durum wheat., 2012, 185: 77–92.
[37] Kamran A, Iqbal M, Spaner D. Flowering time in wheat (L.): a key factor for global adaptability., 2014, 197: 1–26.
[38] Botwright Acuña T L, Rebetzke G J, He X, Maynol E, Wade L J. Mapping quantitative trait loci associated with root penetration ability of wheat in contrasting environments., 2014, 34: 631–642.
[39] Dreisigacker S, Wang X, Martinez Cisneros B A, Jing R, Singh P K. Adult-plant resistance toblotch in hexaploid spring wheat., 2015, 128: 2317–2329.
[40] Kelbert A J, Spaner D, Briggs K G, King J R. The association of culm anatomy with lodging susceptibility in modern spring wheat genotypes., 2004, 136: 211–221.
[41] 朱新开, 郭文善, 李春燕, 封超年, 彭永欣. 小麦株高及其构成指数与产量及品质的相关性. 麦类作物学报, 2009, 29: 1034‒1038.Zhu X K, Guo W S, Li C Y, Feng C N, Peng Y X. Relationship of plant height component indexes with grain yield and quality in wheat., 2009, 29: 1034–1038 (in Chinese with English abstract).
[42] 朱新开, 王祥菊, 郭凯泉, 郭文善, 封超年, 彭永欣. 小麦倒伏的茎秆特征及对产量与品质的影响. 麦类作物学报, 2006, 26: 87–92. Zhu X K, Wang X J, Guo K Q, Guo W S, Feng C N, Peng Y X. Stem characteristics of wheat with stem lodging and effects of lodging on grain yield and quality., 2006, 26: 87–92 (in Chinese with English abstract).
Genetic analysis of plant height and its components for wheat (L.) cultivars Ningmai 9 and Yangmai 158
JIANG Peng, HE Yi, ZHANG Xu, WU Lei, ZHANG Ping-Ping, and MA Hong-Xiang*
Jiangsu Academy of Agricultural Sciences / Jiangsu Provincial Key Laboratory for Agrobiology / Jiangsu Collaborative Innovation Center for Modern Crop Production, Nanjing 210014, Jiangsu, China
Ningmai 9 and Yangmai 158 are the main wheat cultivars and core parents in the middle and lower reaches of the Yangtze River in China. In the past three years, 80% of the released varieties in the middle and lower reaches of the Yangtze River had the background of Ningmai 9 or Yangmai 158. To make better use of these two parents, the genetic mechanism of their traits need to be further clarified. A high-density genetic map was constructed by Illumina 90k chip using 282 recombinant inbred lines (RILs) from the cross between Ningmai 9 and Yangmai 158. In this study, the traits including plant height, internode length, and spike length were determined in three consecutive growing seasons, and 14 stable QTLs were obtained by QTL mapping. By further position alignment, we focused on six chromosome intervals, which preliminarily revealed the genetic regulatory mechanism of the internode on plant height. KASP markers suitable for high-throughput analysis were developed based on the low-homology markers in the six chromosome intervals, and they were further validated in 101 wheat accessions. The polymerization ofandhad high selection efficiency which might be decreased if further intruding. It suggests that the selection ofandshould mainly focus on the alleles reducing plant height, andcould be used in marker-assisted selection for internode length below spike (D1). The results in this study may provide assistance for wheat height genetic improvement in the middle and lower reaches of the Yangtze River.
wheat (L.); Ningmai 9; Yangmai 158; plant height; KASP marker
10.3724/SP.J.1006.2020.91063
本研究由国家重点研发计划项目(2017YFD0100801), 国家现代农业产业技术体系建设专项(CARS-3)和国家自然科学基金项目(31671690)资助。
This study was supported by the National Key Project for the Research and Development of China (2017YFD0100801), the China Agriculture Research System (CARS-3), and the National Natural Science Foundation of China (31671690).
马鸿翔, E-mail: hxma@jaas.ac.cn
E-mail: hmjp2005@163.com
2019-10-15;
2020-01-15;
2020-02-17.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20200215.1946.004.html
