柔嫩艾美耳球虫裂殖子入侵对MDBK细胞凋亡因子表达的影响
2020-05-20王黎霞宋丽聪张建军
王黎霞,宋丽聪 ,张建军,安 健*
(1.北京农业职业学院,北京 102442;2.北京农学院 动物科学技术学院,北京 102206)
鸡球虫感染后入侵肠上皮细胞,引起鸡精神萎靡,肠黏膜损伤,临床血便,甚至死亡,严重影响家禽养殖业,全球每年因为球虫及球虫病造成的损失十分巨大,安健等前期研究发现,鸡柔嫩艾美耳球虫裂殖子入侵可以抑制MDBK细胞凋亡的诱导,深入研究入侵和凋亡抑制的机制,可以为研制新型抗球虫疫苗和治疗药奠定基础。
细胞凋亡时,线粒体跨膜电位发生改变,该情况与Bcl-2家族的凋亡因子有关,这些凋亡因子起抑制和促进凋亡两种作用,前者如Bcl-2、Bcl-W、Bcl-XL等,起凋亡抑制作用,后者如Bax、Bak、Bid等,起凋亡促进作用[1]。Bcl-2是Ced9的同源物[1]。Bcl-2家族都有一个或者多个BH(硼氢酸特异结合位点)结构片段。试验证明Bax与Bcl调节细胞凋亡是依赖TM(单次跨膜区)结构域。凋亡早期,Bax与Bal-XL转移到线粒体膜[2]。Bad因为没有TM片段而存在于胞浆,诱导细胞凋亡时,转移到线粒体膜,除去TM后的Bcl-2抑制凋亡作用改变[3]。在无死亡信号刺激时,Bcl-2被膜蛋白包裹存在于胞质中[4]。当死亡信号刺激细胞后,Bcl-2发生构象变化,移动到细胞器(主要是线粒体)的膜上,导致细胞凋亡。以上两个分子主要定位于线粒体膜和内质网膜等[5],在诱导剂的作用后,Bcl-2和Bcl-xl被蛋白激酶磷酸化而启动凋亡。Bax是最先被发现的促凋亡分子,Bid蛋白是Bcl -2家族中促凋亡类的蛋白,在细胞凋亡中起着重要的作用[6]。
本课题组前期试验发现,乙醇可以诱导细胞凋亡,发现鸡柔嫩艾美耳球虫裂殖子入侵体MDBK细胞2.5 h后可以抑制细胞凋亡的诱导,本试验在鸡柔嫩艾美耳球虫裂殖子入侵体MDBK细胞后,用终浓度6%乙醇进行凋亡诱导,采用qRT-PCR定量分析凋亡相关因子的变化,初步研究球虫裂殖子入侵细胞后抗凋亡诱导的机制。
1 试验材料和方法
1.1 试验材料
E.tenella,河北某鸡场分离,经过单卵囊纯化,保存于北京农学院 动物科学技术学院试验室;MDBK细胞,中国农业大学寄生虫试验室馈赠;胎牛血清、DMEM细胞培养基、胰酶(购自Gibco公司)。
1.2 试验方法
分离纯化裂殖子,参考安健等的方法[7]。
试验共分4组,A组,未入侵,未诱导凋亡;B组,未入侵,诱导凋亡;C组,入侵,未诱导凋亡;D组,入侵,诱导凋亡。MDBK细胞培养于125 cm2的斜颈培养瓶中,于37 ℃,5%CO2的细胞培养箱中培养24 h,胰酶消化,调整每瓶细胞达到3.0×105个,培养温度调至41 ℃,培养24 h后每瓶添加裂殖子9.0×105个,共培养1.5 h后,用Hank’s清洗细胞4次,除去未入侵细胞的裂殖子。用6%的乙醇培养基诱导凋亡培养2.5 h,然后胰蛋白酶消化3 min,收集细胞,用冷的PBS洗涤,1 000 r/min离心5 min,获得MDBK细胞,RNA提取、反转录按试剂盒说明进行。
根据GenBank中牛基因序列的CDs保守区设计Bcl-2、Bax、Bcl-XL、Bid和内参基因β-actin的特异性引物(表1),以β-actin为内参qRT-PCR检测Bcl-2、Bax、Bcl-XL、Bid的表达变化,qRT-PCR检测按试剂盒说明进行。
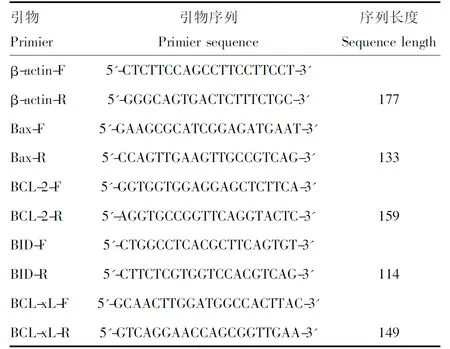
表1 Bcl-2、Bax、Bcl-XL、Bid和内参基因β-actin的引物序列Tab.1 Primiers of Bcl-2,Bax,Bcl-XL,Bid and β-actin for PCR
数据处理采用SPSS17.0软件进行,用方差齐性检验和单因素方差分析(One Way ANOVA)进行多组间比较分析,以P<0.05表示差异有统计学意义。
2 结 果
2.1 Bcl-xL基因表达变化
与未感染球虫未诱导凋亡组比较,各试验组Bcl-xL基因表达显著下调(P<0.05),但感染凋亡诱导组基因下调显著大于未感染凋亡诱导组(图1)(P<0.05)。
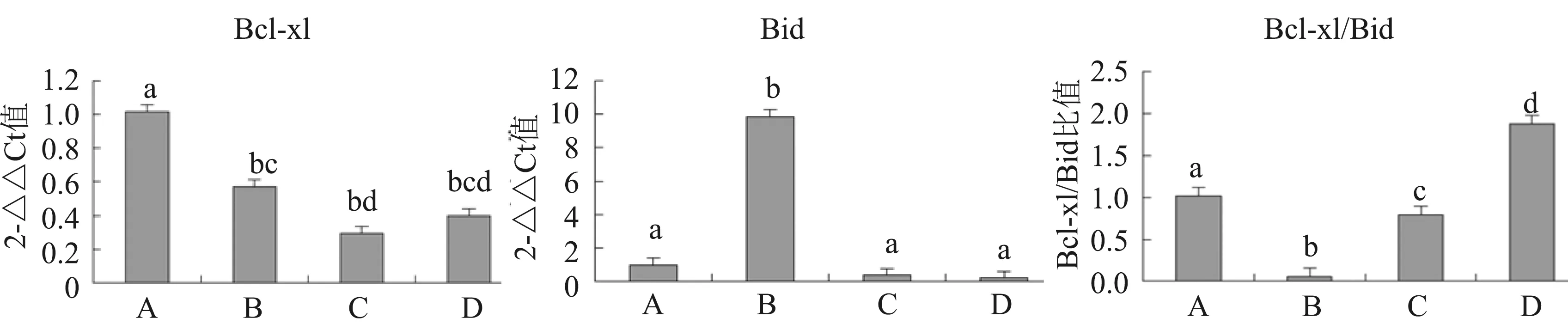
注:A.未感染球虫,未诱导凋亡;B.未感染球虫,诱导凋亡;C.感染球虫,未诱导凋亡;D.感染球虫,诱导凋亡;a,b,c,d不同表示差异显著图1 球虫感染和凋亡诱导对Bcl-xL、Bid、Bcl-xL/Bid基因表达影响Note: A.no invasion and no apoptosis induced; B.no invasion and apoptosis induced; C.invasion and no apoptosis induced; D.invasion and apoptosis induced,a,b,c,d differences is significantFig.1 The differential expression of Bcl-xL, Bid, Bcl-xL/Bid gene under E.tenella invasion and apoptosis induced
2.2 Bid基因表达变化
与未感染球虫未诱导凋亡组比较,Bid基因攻虫凋亡诱导组表达下调,而未感染凋亡诱导组表达上调,且差异显著(P<0.05)(图1)。
Bcl-xL/Bid的比值攻虫凋亡诱导组表达均相对上调,而未攻虫凋亡诱导组表达均相对下调,且均差异显著,(P<0.05)(图1)。
2.3 Bcl-2基因表达变化
与未感染球虫未诱导凋亡组比较,未攻虫凋亡诱导组Bcl-2基因表达显著下调(P<0.05),攻虫未凋亡诱导组显著上调(P<0.05),攻虫凋亡诱导组基因表达下调量略低于凋亡组(图2),但差异不显著。
2.4 Bax基因表达变化
与未感染球虫未诱导凋亡组比较,未感染凋亡诱导组Bax基因表达相对上调,攻虫凋亡诱导组表达相对下调,且差异显著(P<0.05)(图2)。
Bcl-2/Bax的比值攻虫凋亡诱导组表达均相对上调,而凋亡诱导组表达均相对下调,且均差异显著,(P<0.05)(图2)。

注:A未感染球虫,未诱导凋亡;B未感染球虫,诱导凋亡;C感染球虫,未诱导凋亡;D感染球虫,诱导凋亡a,b,c不同表示差异显著图2 球虫感染和凋亡诱导对Bcl-2、Bax和Bcl-2/Bax基因表达影响Note: A no invasion and no apoptosis induced; B no invasion and apoptosis induced; C invasion and no apoptosis induced; D invasion and apoptosis induced,a,b,c differences is significantFig.2 The differential expression of Bcl-2,Bax和Bcl-2/Bax gene under E.tenella invasion and apoptosis induced
3 讨 论
随着细胞生物学的迅猛发展,检测细胞凋亡的标志物也越来越多。其中Bcl-2和Bax的比值(Bcl-2/Bax)是比较易行且同时具有代表意义,该比值能够说明细胞发生凋亡的进程和结局。Bcl-2与Bax基因处于细胞凋亡通路调节的上游,在正常状态下,Bax与Bcl-2形成异源二聚体使细胞处于稳态。当受到凋亡信号刺激后,Bax被解离出来,形成同源二聚体从而诱导细胞凋亡。因此,细胞内Bcl-2/Bax的比值是决定细胞受到某种刺激后是否发生凋亡的重要因素。雷萍等(2012)[8]研究了灰树花提取物对脾虚小鼠脾脏Bax,Bcl-2表达的影响,证实了Bcl-2/Bax比值的提高可以抑制脾淋巴细胞的凋亡。雷博婷等(2015)[9]发现峨参提取物浓度的增加及作用时间的延长,Bcl-2/Bax的比值下降,肿瘤凋亡率增加。冯全服等(2015)[10]证明川芎嗪显著降低Bcl-2/Bax比值,诱导肿瘤HepG2细胞凋亡,抑制癌细胞的增殖,且呈时间剂量依赖关系。冯颖等(2015)[11]证明胰腺实性假乳头状瘤退变区Bcl-2/Bax比值下调,实性区Bcl-2/Bax比值上调,因此Bcl-2与Bax表达的比率决定着细胞在受到凋亡刺激信号后是生存还是凋亡, 其比例增高对凋亡有抑制作用。
在本试验中,与未感染球虫未诱导凋亡组比较,未攻虫凋亡诱导组Bcl-2基因表达显著下调(P<0.05),攻虫未凋亡诱导组显著上调(P<0.05),攻虫凋亡诱导组基因表达下调量略低于凋亡组(图1),但差异不显著,是由于加入凋亡诱导剂后Bcl-2基因表达受到抑制,使裂殖子感染早期抑制细胞凋亡。Bax基因未感染凋亡诱导组表达相对上调,攻虫凋亡诱导组表达相对下调,且差异显著(P<0.05)。Bcl-2/Bax的比值攻虫凋亡诱导组升高,而未感染凋亡诱导组下降,且均差异显著,(P<0.05)。说明裂殖子感染通过调节Bcl-2及Bax的表达量达到抑制宿主细胞凋亡的作用。
Bcl-2家族的另一对凋亡相关因子:Bcl-xl和Bid在细胞凋亡中也起着重要的作用,Bcl-xl蛋白通过抑制线粒体释放细胞色素C(Cyto C)[12]和凋亡诱导因子达到抑制细胞凋亡的作用,且Bcl-xl抗凋亡作用要强于Bcl-2,而Bid蛋白则可以增加这两种物质的释放从而促进凋亡[13]。张蕾蕾等(2015)[14]发现Zeylenone诱导宫颈癌细胞时Bcl-xL表达大幅下调,使其凋亡。郭文娟等(2010)[15]证实了Bcl-XL/Bid比值的降低与腺癌的发生相关,正常小肠组织中Bcl-XL/Bid比值要远远高于小肠腺癌组织。在死亡受体途径中,tBid进入线粒体,抑制Bcl-XL的表达。受到死亡信号的刺激后,胞浆中的Bid等因子会转至线粒体上,促进释放Cyto C,而线粒体外膜上Bcl-2和Bcl-XL则抑制Cyto C的释放[16]。线粒体释放出Cyto C后,Cyto C与Apaf-1结合,促进细胞凋亡[6]。在本试验中,Bcl-XL各试验组基因表达相对下调,但攻虫凋亡诱导组基因下调量大于未感染凋亡诱导组。Bid基因攻虫凋亡诱导组表达下调,而未感染凋亡诱导组表达上调,且差异显著(P<0.05)。Bcl-XL/Bid的比值攻虫凋亡诱导组表达均相对上调,而未感染凋亡诱导组表达均相对下调,且均差异显著,(P<0.05)。证明鸡柔嫩艾美耳球虫裂殖子抑制宿主细胞凋亡与Bcl-XL/Bid的比值呈正相关性。
综上所述,裂殖子入侵后通过抑制宿主细胞Bcl-XL/Bid,Bcl-2/Bax两对异源二聚体的解离抑制细胞凋亡。
