Toll样受体4与KDM2B在卵巢癌组织中的表达及其临床意义
2020-05-19杨慧兰易叶叶侯海瑞苏善恒谭彩春况燕
杨慧兰 易叶叶 侯海瑞 苏善恒 谭彩春 况燕△
(1.广西医科大学第一附属医院妇产科,广西 南宁 530021;2.长沙医学院附属第一医院妇产科,湖南 长沙 410005)
卵巢癌是女性生殖系统三大恶性肿瘤之一,死亡率居妇科肿瘤之首[1]。由于肿瘤的生物学特性和卵巢的位置,在早期诊断该病一直很困难,确诊卵巢癌时大多数患者已为晚期[2]。因此研究影响卵巢癌的发生发展的机制,寻找卵巢癌早期诊断及治疗的新靶点是我们刻不容缓需要解决的问题。Toll样受体4(TLR4)及KDM2B均在肿瘤的发生发展过程中起着不同程度的作用,但两者之间关系在卵巢癌的研究中未见报道。本研究采用免疫组化法检测TLR4及KDM2B在不同卵巢组织中的表达情况,分析两者之间的相互关系以及与卵巢癌临床病理特征的相关性,为卵巢癌发生发展的机制研究奠定实验基础。
1 材料与方法
1.1研究对象 收集2017年12月至 2019年9月在广西医科大学第一附属医院进行诊治的100例卵巢疾病患者的卵巢组织标本,包括20例正常卵巢组织(来源于患子宫肌瘤或子宫腺肌病行全子宫双附件切除术的患者),25例良性卵巢肿瘤组织(14例粘液性囊腺瘤,11例浆液性囊腺瘤),55例卵巢癌组织(30浆液性腺癌、22例黏液性腺癌,3例透明细胞癌)。所有病例在取材前均未接受药物、放疗等特殊治疗,并经过组织病理学检查明确诊断。本研究经医院伦理委员会批准。
1.2主要试剂 TLR4兔多克隆抗体(Abcam公司,批号:ab13556)KDM2B兔多克隆抗体(SAB公司,批号:47690),SP试剂盒(博士德生物公司,批号:SV0002)和DBA显色试剂盒(博士德生物公司,批号:AR1022)。
1.3实验方法 应用免疫组化SP法分别检测正常卵巢组织、良性卵巢肿瘤组织、卵巢癌组织中TLR4及KDM2B的表达情况,实验过程严格按照试剂使用说明书进行。其中TLR4及KDM2B抗体的工作液浓度分别为 1∶1 000、1∶200,以磷酸盐缓冲液代替一抗作为阴性对照,以已知阳性切片作为阳性对照。最终在显微镜下观察结果。
1.4结果评定标准 TLR4与KDM2B阳性定位分别是细胞膜及细胞核,故在细胞膜或细胞核内出现棕黄褐色颗粒定义为阳性表达。在400倍高倍镜下,每张切片均随机取5个视野,每个视野根据染色强度计分和阳性细胞百分比。染色程度评定:不着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比评定: <25% 为1分,25%~50% 为2分,50%~75%为3分,>75%为4分。最后将染色程度和阳性细胞百分比相乘作为最终判定结果:0分为阴性(-) ,1~4 分为弱阳性( + ),4~8分为中度阳性( + + ),8~12 分为强阳性 ( + + + )。其中( + ) 、( + + ) 、( + + + ) 均为阳性表达。
1.5统计学方法 采用SPSS 25.0软件进行统计学分析。计数资料以n(%)表示,采用χ2检验;采用 Spearman相关系数进行相关性分析;以P<0.05 为差异有统计学意义。
2 结 果
2.1TLR4及KDM2B在不同卵巢组织中的表达情况 免疫组化结果显示,卵巢癌中TLR4及KDM2B阳性表达率均明显高于良性卵巢肿瘤组织和正常卵巢组织(P均<0.05)。见表1、图 1。
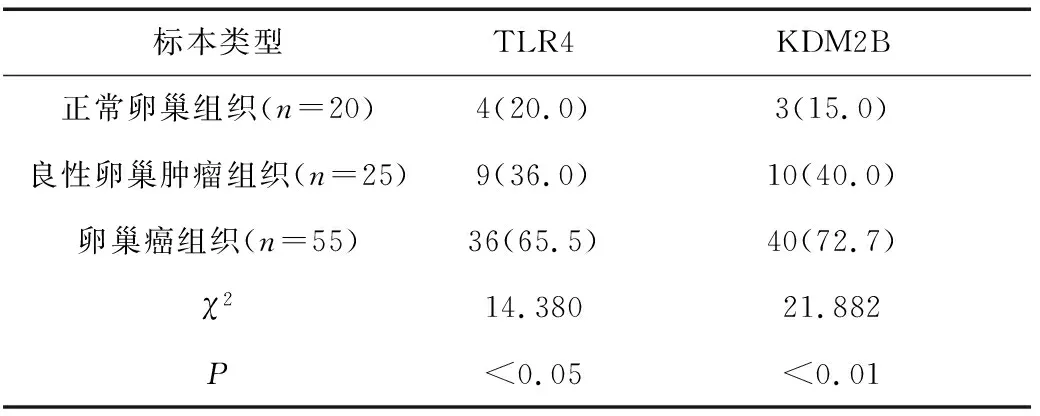
表1 TLR4和KDM2B在不同卵巢组织中的表达情况[n(%)]
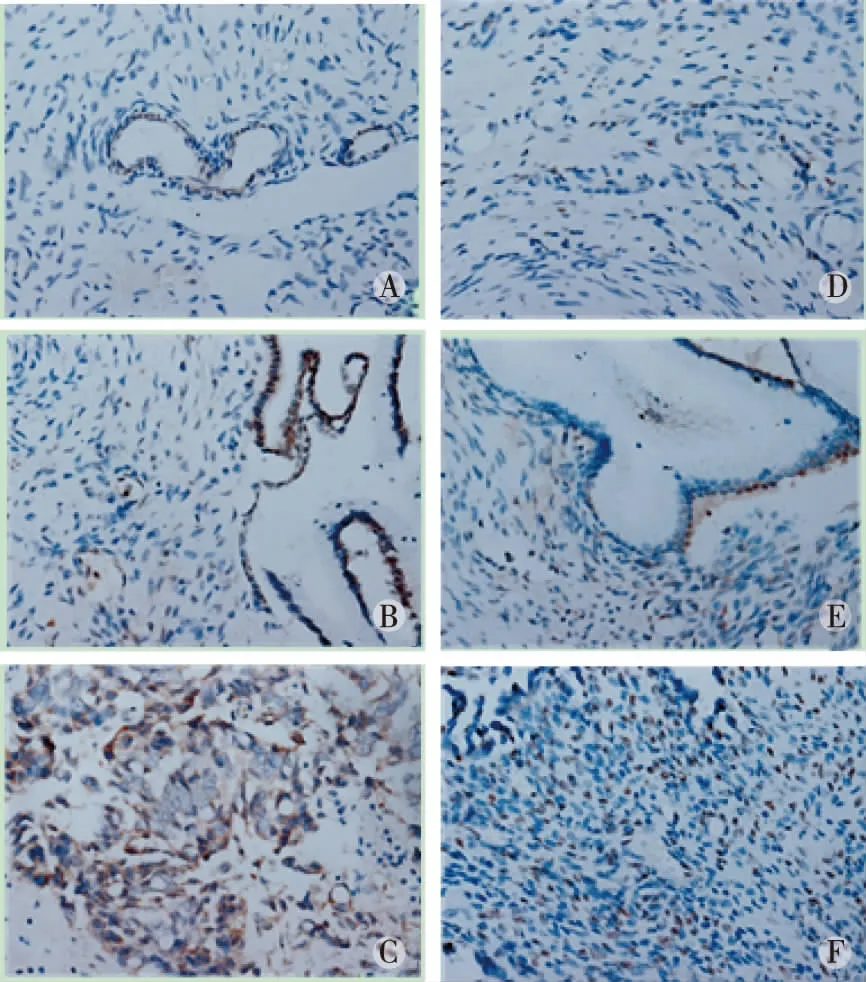
注:A、B、C分别为TLR4在正常卵巢组织、良性卵巢肿瘤组织及卵巢癌组织中的表达情况;D、E、F分别为KDM2B在正常卵巢组织、良性卵巢肿瘤组织及卵巢癌组织的表达情况。图1 TLR4和KDM2B分别在不同卵巢组织中的表达情况(DAB染色,×400)
2.2TLR4及KDM2B阳性表达情况与卵巢癌临床病理学特征的关系 TLR4及KDM2B在低分化卵巢癌组织中阳性表达率均较高分化卵巢癌组织高(P<0.05),且随着国际妇产科协会(FIGO)分期的增加而升高(P<0.05),其中有淋巴结转移者表达阳性率较高(P<0.05)。两者的阳性表达率与年龄无关,差异无统计学意义(P>0.05) 。见表2。
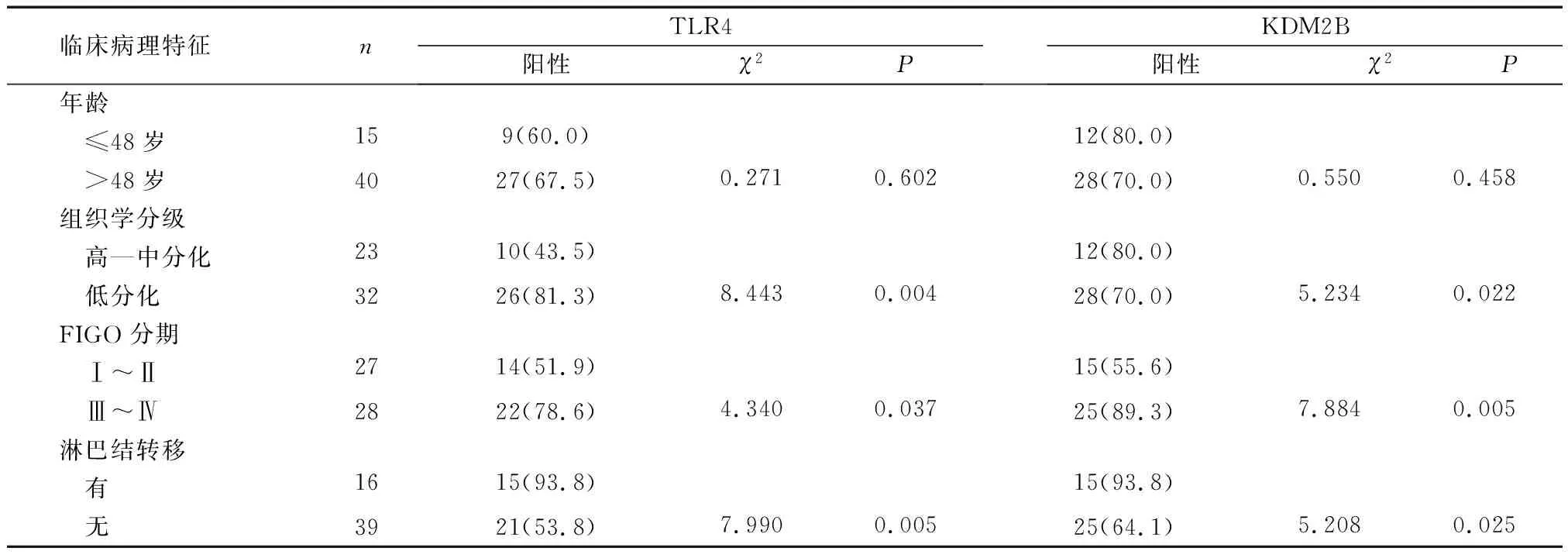
表2 TLR4及KDM2B阳性表达与卵巢癌患者临床病理学特征的关系[n(%)]
2.3TLR4与KDM2B在卵巢癌中表达的相关性分析 在卵巢癌组织中TLR4与KDM2B的表达呈正相关(r=0.310,P=0.021<0.05)。
3 讨 论
Toll样受体(TLRs)是一种进化保守的膜结合蛋白,广泛表达在免疫细胞表面。TLRs在真核生物的免疫、神经发生和发育过程中起着重要作用[3]。TLR4作为TLR家族的一员,主要在免疫细胞中表达,并且在先天和获得性免疫中发挥着重要作用[4]。Y.Li等[5]研究发现,TLR4激活在多个位点诱导组蛋白甲基化变化,其中KDM3A通过参与TLR4对肺腺癌细胞Foxp3转录的调控,促进抑制细胞因子的分泌,从而促进肺癌细胞的免疫逃逸,揭示了表观遗传组蛋白甲基化在肺癌细胞免疫逃逸调控中的重要作用。TLR4也在胃癌、肠癌等多种肿瘤组织和细胞中呈高表达,并起到促进肿瘤生长、转移和免疫逃逸的作用[6-7]。本研究通过免疫组化法检测TLR4在不同卵巢组织中的表达,结果显示TLR4在卵巢癌组织中的表达均高于良性卵巢肿瘤和正常卵巢组织(P<0.05),且TLR4的表达阳性率随着肿瘤组织分级及 FIGO 分期的增加而升高(P<0.05), 存在淋巴结转移者TLR4的表达阳性率较高(P<0.05),这一结果与G.Vlad等[8]结果相似,提示TLR4可能在卵巢癌的发生发展过程中起着重要作用。
KDM2B(也称为NDY1、FBXL10、JHDM1B和CxxC2),是JHDM (jmjc domain-containing histone demethylase)家族的成员之一[9]。它是一种普遍存在的核蛋白,对H3K36me2和H3K4me3 进行脱甲基[10-11]。KDM2B具有抑制细胞衰老,防止细胞分化,促进细胞增殖和迁移,调节干细胞自我更新等多种生物学作用[12]。研究[13-14]发现KDM2B的过表达促进了MoMuLV诱导的T细胞淋巴瘤,急性淋巴细胞白血病(ALL)和急性骨髓性白血病(AML)的进展。敲除ALL、慢性髓细胞白血病和AML细胞系中的KDM2B,不仅减少了细胞生长,而且减少了小鼠的肺转移。KDM2B在基底样三阴性(ER-,PR-和Her2-)乳腺癌中高表达,并与其不良预后有关[15]。A.Tzatsos等[16]研究表明KDM2B激活MYC和KDM5A基因的表达从而促进胰腺癌的进程,其直接作用于MYC启动子,进而抑制胃癌的糖酵解.KDM2B可通过增加EMT促进转录因子的表达,从而膀胱癌的细胞增殖,迁移,血管生成和癌症干细胞自我更新[17]。此外,KDM2B可以通过激活PI3K/mTOR途径促进鼻咽癌的进展[18]。综上说明KDM2B在多种肿瘤的发生发展过程起着重要作用。本研究结果显示KDM2B在卵巢癌组织中的表达均高于良性卵巢肿瘤及正常卵巢组织(P<0.05),KDM2B的表达阳性率随着肿瘤组织分级及 FIGO 分期的增加而升高(P<0.05),存在淋巴结转移者KDM2B的表达阳性率较高(P<0.05),与Y.Kuang等[19]研究结果相似,提示KDM2B的高表达影响卵巢癌的发生发展。并且研究结果显示TLR4与KDM2B在卵巢癌中的表达呈正相关,由此我们推测TLR4与KDM2B可能一同参与了卵巢癌的发生发展。
综上所述,在卵巢癌组织中TLR4与KDM2B均呈高表达,两者在卵巢癌发生发展中的具体作用机制可能不同。其中TLR4激活时在多个位点诱导组蛋白甲基化变化,而KDM2B是一种去甲基化酶,那么KDM2B是否在TLR4激活时参与卵巢癌的发生发展过程则有待深入研究。这将拓展卵巢癌的发生发展机制研究范畴,为卵巢癌的临床治疗提供新思路。
