ACTB基因引物的设计及其在医学本科分子生物学实验教学中的应用
2020-05-14宋辉张婷禹文峰
宋辉 张婷 禹文峰
摘 要:目的 针对ACTB基因设计引物,并在医学本科分子生物实验教学中通过聚合酶链式反应(PCR)让学生认识真核基因内含子和外显子结构的特点。方法 通过在线软件Primer-BLAST设计针对ACTB基因的引物,通过改变退火温度,优化PCR体系,同时,结合实验教学结果评价引物的特异性。结果 针对ACTB基因外显子3和外显子4设计了两对引物,引物1和引物2。引物1在退火温度68℃时,表现出较高的特异性和PCR产量。以基因组DNA(gDNA)和cDNA为模板,PCR产物大小相差441bp。以此条件,引物1在实验教学中也表现出较好的效果,目的基因扩增成功率达到90%以上。结论 引物1在退火温度68℃时,利用PCR技术结合琼脂糖凝胶电泳结果,学生们可以形象的理解真核生物基因的结构特点,值得在医学本科分子生物学实验教学中推广。
关键词:ACTB;PCR;真核基因结构;分子生物学;实验教学
Abstract: Objective To design specific primer for ACTB and apply it in the molecular biology experiment teaching for medical undergraduate to help them understand the structure characteristics of eukaryotic genes with intron and exon through PCR. Methods ACTB primers were designed using online tool Primer-BLAST. PCR system was optimized by different annealing temperatures. Primer specificity was evaluated based on experiment teaching results. Results Two ACTB primers (primer 1 and primer 2) were designed spanning exon 3 and exon 4. Primer 1 showed high specificity and PCR yield at annealing temperature of 68 ℃. There was 441 bp difference of PCR product between genomic DNA (gDNA) and cDNA as template. Under this condition, we also obtained a satisfied experiment teaching result for primer 1, with more than 90% successful amplification rate of target gene. Conclusion Students can easily understand the structural characteristics of eukaryotic genes by PCR using primer 1 at annealing temperature of 68 ℃, which is worth popularizing in the molecular biology experiment course for medical undergraduates.
聚合酶链式反应(polymerase chain reaction,PCR)是一种体外酶促扩增特定DNA片段的分子生物学技术,由变性、退火和延伸三步反应组成,具有特异性强、灵敏度高、操作简便的特点[1]。目前,PCR技术已经广泛应用于疾病诊断、微生物檢测、法医鉴定和基因工程等领域[2-5]。在医学本科分子生物学实验教学中,开设PCR实验课有助于学生们将理论与实践相结合,增强动手能力。本实验以ACTB基因为例,从引物设计、PCR条件优化、产物检测、教学实践等多个环节,让学生们认识真核基因中内含子和外显子结构的特点。
一、材料和方法
(一)材料
HEK-293T细胞(ATCC),DMEM培养基(Hyclone),血清(四季青)。TRIzol(Invitrogen),基因组提取试剂盒(天根,#DP348-02),逆转录试剂盒(Thermo Fisher Scientific,#K1622),Taq 酶(TaKaRa,#R001BM),引物合成(上海生工)。
(二)细胞培养
EK-293T细胞接种于直径10cm的培养皿中,加入含10%血清的DMEM培养基,置于37℃,5% CO2培养箱中。48h后PBS冲洗一次,胰蛋白酶消化2min,加入新鲜培养基终止消化,离心收集细胞,分装成6管,直接或加入1ml TRIzol后,-80℃保存。
(三)基因组DNA提取
在所收集的细胞沉淀中加入300μl PBS,轻轻吹打,成细胞悬液。按照基因组提取试剂盒说明书,提取基因组DNA,NanoDrop 2000分光光度计测定DNA的浓度,-20℃保存。
(四)总RNA的提取和cDNA的合成
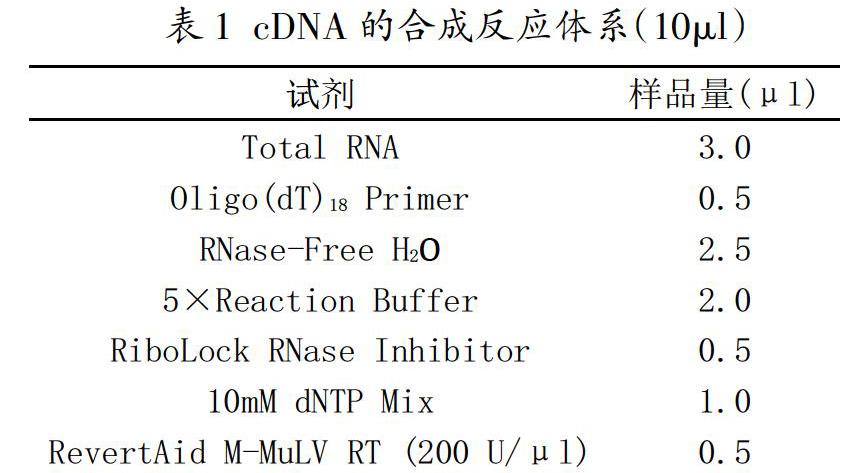
利用TRIzol法提取HEK-293T细胞的总RNA,NanoDrop 2000分光光度计测定RNA的浓度。取3μl RNA,按照表1配制逆转录反应体系,反应条件42℃ 60min,70℃ 5min,-20℃保存。
(五)引物设计
从NCBI中获取ACTB基因(NM_001101.5)的mRNA序列,利用在线软件Primer-BLAST设计引物,送至上海生工进行合成。
(六)PCR
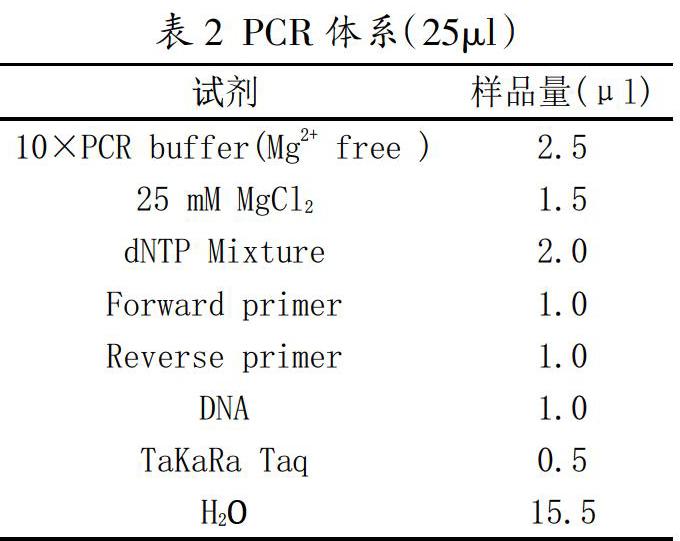
按照表2配制反应体系,混合均匀,在ABI PCR ProFlex仪上进行PCR。反应条件:预变性95℃ 5min;变性95℃ 30s,退火68℃ 30s,延伸72℃ 40s,30个循环;终末延伸72℃ 5min。
表2 PCR体系(25μl)
(七)琼脂糖凝胶电泳
配制1%的琼脂糖凝胶,加热使融解,待冷却至50℃左右,加入10mg/ml溴化乙锭(5μl/100ml 1%的琼脂糖凝胶),混匀,倒入制胶板中,室温放置45min,向25μl PCR产物中加入6×加样缓冲液5μl,混匀后取8μl,点样。120V,电泳45min,在凝胶成像系统(Bio-Rad)下拍照,记录结果。
二、实验结果
(一)引物设计
通过NCBI查找基因ACTB的mRNA序列,发现该基因含有6个外显子和5个内含子,其中外显子3和外显子4间隔441bp(图1A)。因此,跨外显子3和外显子4设计引物,可以很好地鉴别内含子的结构。依据引物的特性,我们利用Primer-BLAST针对外显子3和外显子4的序列设计引物,我们获得两对引物,Primer 1(Forward primer:GGCATCCTCACCCTGAAGTA;Reverse primer:TAGCACAGCCTGGATAGCAA)和Primer 2(Forw
ard primer:CTGAAGTACCCCATCGAGCA;Reverse primer:AGCCTGGATAGCAACGTACA)(图1B)。
(二)PCR条件优化
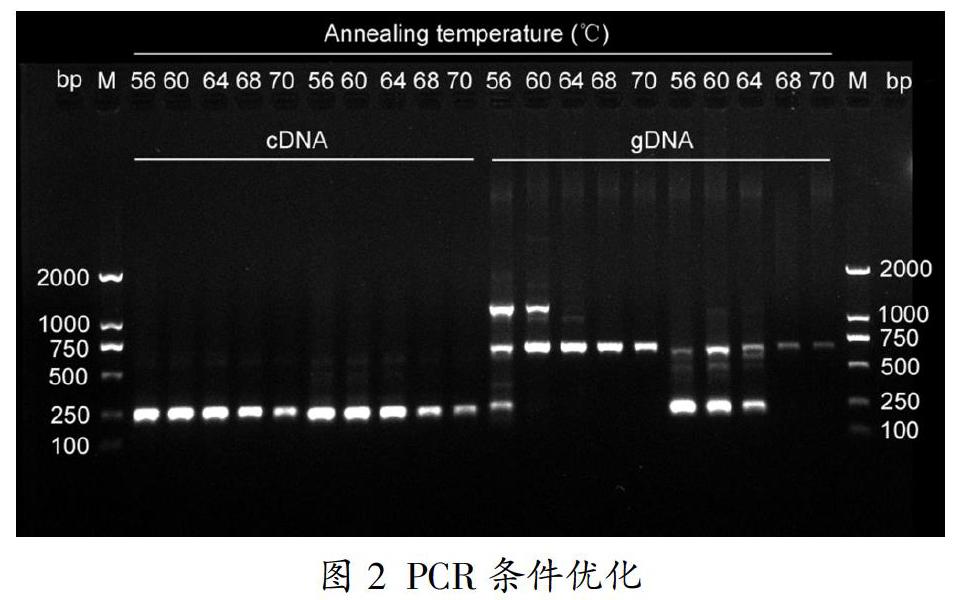
我们所提取的总RNA浓度为1054.1ng/μl,gDNA浓度为440.7ng/μl。在不同退火温度(56℃、60℃、64℃、68℃和70℃)条件下,对引物的特异性进行了检测。如图2所示,以cDNA为模板,引物1和引物2均显示出了较高的特异性;以gDNA为模板,引物1和引物2在68℃和70℃时表现出较高的特异性,但是在相同温度下,引物1的目的DNA片段的扩增效率高于引物2。因此,我们选择引物1和退火温度68℃,作为实验教学的PCR条件。
(三)实验教学效果
本科生物技术和化学生物学专业学生合计153人,两人一组,合计77组,分为7个班进行授课。在实验教学中,RNA浓度最低267.1ng/μl,最高2283.4ng/μl,800-1200ng/μl组数最多,占31.2%(23/77)(图3A);gDNA浓度最低25.5ng/μl,最高512.7ng/μl,200-300ng/μl组数最多,占27.3%(21/77)(图3B)。如图4所示,引物1在实验教学中显示出较好的效果,统计发现,以cDNA为模板,目的DNA片段扩增正确率92.2%(71/77),以gDNA为模板,目的DNA片段扩增正确率90.9%(70/77),仅1组cDNA的PCR产物大小不正确,大小在400bp左右。通过琼脂糖凝胶电泳,学生观察到分别以gDNA和cDNA为模板,PCR产物大小相差400bp左右,与预期结果一致。
三、讨论
人ACTB基因位于第7号染色体p22.1,长度36,637bp,所编码的蛋白β-actin大小约42kDa,属于肌动蛋白家族[6]。β-actin高度保守,分布广泛,表达水平高,常用作内参基因。然而,受一些生化刺激或在疾病状态下,β-actin的表达水平也会发生变化[7]。研究发现,β-actin参与多种生物学过程,包括:细胞骨架形成,细胞生长、运动和迁移,组蛋白修饰和基因表达调控等[8-10]。ACTB表达异常或突变与肿瘤的发生,Baraitser-Winter综合症,血小板缺少症以及贝克痣综合征等密切相关[11-14]。
与原核生物不同,大多数真核生物基因都是断裂基因,转录产物需要去除内含子,将外显子拼接成连续的序列。我们在设计引物时考虑到本实验的目的是認识真核生物的结构,因此上、下游引物必须跨外显子。其次,为了更直观的观察到内含子的结构,最好只跨一个内含子,这样便于学生理解。再次,内含子的大小,太大会延长上课时间,太短无法直观区分PCR产物大小的差异。因此,我们针对外显子3和外显子4设计上、下游引物。
PCR的温度控制十分关键,尤其退火温度。退火温度主要影响PCR的特异性和产量:退火温度过低,会出现非特异性杂带;提高温度可以提高引物特异性,但温度过高,引物不能与模板的结合,PCR产量降低。在预实验中,我们也观察到随着退火温度的提高,非特异性杂带减少。对引物1和引物2来说,当采用68℃和70℃的退火温度时,非特异性条带明显减少,但70℃的PCR产量低于68℃。在同一温度(68℃或70℃)下,引物2的PCR产量明显低于引物1。因此,在实验教学中,我们采用引物1和退火温度68℃。
从教学结果来看,90%以上学生的结果与预期一致。在对电泳结果进行分析时,我们发现漏加试剂成为实验失败的主要原因。由于每个学生操作的个体差异,总RNA和gDNA的浓度差异较大,成为影响PCR产量的重要原因。而在科学研究中,实验结果必须具有良好的可重复性,应尽量避免人为因素对实验结果的干扰。在未来的实验教学中,除了讲解实验原理和步骤,应在操作的规范方面加强训练。
四、结束语
从教学效果来看,我们所设计的ACTB引物1和本文所采用的PCR条件可以很好地让学生理解真核生物基因的结构特点;同时,将PCR技术引入到医学本科分子生物学实验教学中,可以培养学生的科研思维,提高分析问题和解决问题的能力,值得在医学本科分子生物学实验教学中推广。
参考文献:
[1]WATERS DL, SHAPTER FM. The polymerase chain reaction(PCR): general methods[J]. Methods Mol Biol, 2014,1099:65-75.
[2]MEDFORD AJ, GILLANI RN, PARK BH. Detection of Cancer DNA in Early Stage and Metastatic Breast Cancer Patients[J]. Methods Mol Biol, 2018,1768:209-227.
[3]COMAR M, DAL MOLIN G, D'AGARO P, et al. HBV, HCV, and TTV detection by in situ polymerase chain reaction could reveal occult infection in hepatocellular carcinoma: comparison with blood markers[J]. J Clin Pathol, 2006,59(5):526-529.
[4]MORLING N. PCR in forensic genetics[J]. Biochem Soc Trans, 2009,37(Pt2):438-440.
[5]WON M, DAWID IB. PCR artifact in testing for homologous recombination in genomic editing in zebrafish[J]. PLoS One, 2017,12(3),e0172802.
[6]SHETERLINE P, CLAYTON J, SPARROW J. Actin[J]. Protein Profile, 1995,2(1):1-103.
[7]ZHANG B, WU X, LIU J, et al. β-Actin: Not a Suitable Internal Control of Hepatic Fibrosis Caused by Schistosoma japonicum[J]. Front Microbiol, 2019,10:66.
[8]POLLARD TD, COOPER JA. Actin, a central player in cell shape and movement[J]. Science, 2009,326(5957):1208-1212.
[9]BUNNELL TM, BURBACH BJ, SHIMIZU Y, et al. β-Actin specifically controls cell growth, migration, and the G-actin pool[J]. Mol Biol Cell, 2011,22(21):4047-4058.
[10]RODRIGUEZ A, KASHINA A. Posttranscriptional and Posttranslational Regulation of Actin[J]. Anat Rec (Hoboken), 2018,301(12):1991-1998.
[11]GUO C, LIU S, WANG J, et al. ACTB in cancer[J]. Clin Chim Acta, 2013,417:39-44.
[12]RIVI?魬RE JB, VAN BON BW, HOISCHEN A, et al. De novo mutations in the actin genes ACTB and ACTG1 cause Baraitser-Winter syndrome[J]. Nat Genet, 2012,44(4):440-444,S1-2.
[13]LATHAM SL, EHMKE N, REINKE PYA, et al. Variants in exons 5 and 6 of ACTB cause syndromic thrombocytopenia[J]. Nat Commun, 2018,9(1):4250.
[14]CAI ED, SUN BK, CHIANG A, et al. Postzygotic Mutations in Beta-Actin Are Associated with Becker's Nevus and Becker's Nevus Syndrome[J]. J Invest Dermatol, 2017,137(8):1795-1798.
