当归补血汤中4 种成分在大鼠血浆中的药动学研究
2020-05-12刘雅琳王文恺李秋芳薛
刘雅琳王文恺李秋芳薛 梅
[1.河南中医药大学,河南 郑州 450046;2.南京中医药大学中医学院·中西医结合学院,江苏 南京 210023;3.河南省中医院(河南中医药大学第二附属医院), 河南 郑州 450002]
当归补血汤源自李东垣《内外伤辨惑论》,由黄芪、当归2 味药材按5∶1 比例组成,是补益剂代表方,主治血虚阳浮发热证,对劳倦内伤、气血两虚、浮阳外越、女人行经、产后血虚发热、长阳久溃不愈有明显疗效[1],具有促进骨折愈合[2-3]、治疗再生障碍性贫血[4]、调节免疫[5]、减少2 型糖尿病引起的肾脏损伤、抗炎、抗氧化等作用。
药代动力学是应用动力学原理与数学处理方法,定量描述药物通过各种途径(如静脉注射、静脉滴注、口服给药等)进入体内后吸收、分布、代谢、排泄过程“量时”或血药浓度“经时”变化动态规律的一门学科,在阐明中药进入体内后的动态变化规律、指导临床合理用药、对某些药理现象作出准确解析等方面发挥着越来越重要的作用。因此,本实验在文献[6]的基础上通过UPLCMS/MS 法研究当归补血汤在大鼠血浆中的药代动力学,为该方临床应用提供参考。
1 材料
1.1 试剂与药物 黄芪为蝶形花科植物内蒙古黄芪Astragalus membranaceus(Fisch.)Bunge.的根,当归为伞形科植物当归Angelica sinensis(Oliv.)Diels 的根,均购自北京同仁堂大药房,经南京中医药大学药理教研室卞勇老师鉴定为正品。
阿魏酸(批号MUST-17010908)、毛蕊异黄酮(批号 MUST-14070923)、芒柄花黄素(批号MUST-14091205)、黄芪甲苷(批号 MUST-15072911)、橙皮素(批号MUST-17040814)对照品均由成都曼斯特生物科技有限公司提供(质量分数>99%)。甲醇、乙腈、甲酸均为色谱纯,购自上海安谱实验科技股份有限公司;水为超纯水(Milli-Q 纯水机生产)。
1.2 仪器 AcquityTMUPLC 色谱仪(配置四元泵溶剂系统、在线脱气机、自动进样器)、AcquityTMUPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)、XevoTMTQ 质谱系统、Mass Lynx4.1 质谱工作站软件(美国Waters 公司);Milli-Q 超纯水器(美国Millipore 公司);涡旋仪(海门市齐林贝尔仪器制造有限公司);SPD-2010 离心浓缩装置、SL16R 高性能台式冷冻离心机(美国Thermo Fisher Scientific 公司);RC 2 Basic 低温冷却循环泵(德国IKA 公司);Freezone-12 L 冷冻干燥机(美国Labconco 公司);旋转蒸发仪(巩义市予华仪器有限责任公司);MS7-H550-Pro 加热型磁力搅拌器(美国赛洛捷克公司)。
1.3 动物 清洁型雄性SD 大鼠,体质量(250±10)g,购于南京市江宁区青龙山动物繁殖场,动物生产许可证号SCXK(苏)2017-0001,自由摄食饮水。环境温度22~24 ℃,相对湿度50%,12 h白天/12 h 黑夜模式,每天7:00 至19:00。大鼠适应性饲养1 周后,开始实验。
2 方法与结果
2.1 分析条件 Waters BEH C18色谱柱(2.1 mm×50 mm,1.7 μm);柱温30 ℃;流动相0.1%甲酸(A)-乙腈(B),梯度洗脱(0~1 min,95% A,5% B;1~4 min,95%A~0,5%~100% B;4~6 min,100% B);体积流量0.4 mL/min;样品盘温度10 ℃;进样量2 μL。电喷 雾正离 子源(ESI+);MRM 采集方式;毛细管电压3 kV;离子源温度150 ℃;去溶剂气温度350 ℃。主要MS 参数见表1。
2.2 溶液制备 精密称取阿魏酸、毛蕊异黄酮、芒柄花黄素、黄芪甲苷对照品适量,甲醇分别制成1.980、4.540、1.332、1.100 g/L,精密量取适量,甲醇制成每 1 mL 分别含四者 495.00、1 135.00、333.13、275.00 μg 的混合标准品溶液。精密称取橙皮素(内标)对照品适量,加甲醇制成0.332 mg/mL,再进一步稀释成3.32 μg/mL 内标溶液。上述溶液均置于4 ℃冰箱中保存备用。
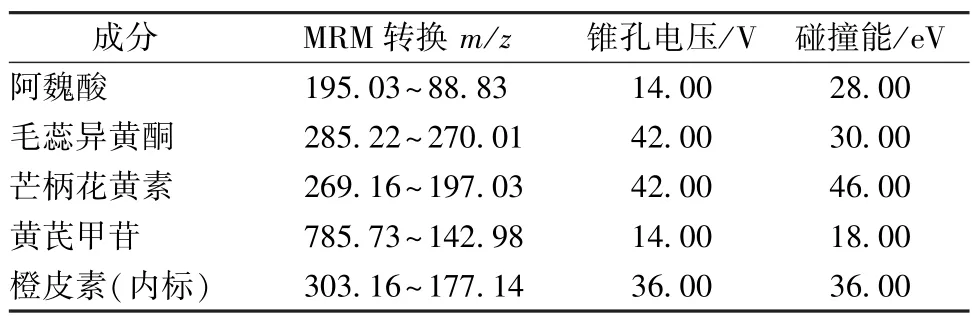
表1 各成分主要MS 参数Tab.1 Main MS parameters for various constituents
2.3 样品准备
2.3.1 当归补血汤冻干粉制备 黄芪、当归按5∶1比例称取300 g,置于烧杯中,8 倍量纯水室温下浸泡60 min,置于加热型磁力搅拌器上,设定温度为550 ℃,加热至沸腾后380 ℃下继续煎煮30 min,8 层脱脂纱布过滤,得到汤剂药液A,残渣再倒入6 倍量水,重复上述方法煎煮过滤,得到汤剂药液B,合并2 次药液,60 ℃下浓缩至300 mL,冷冻干燥24 h,即得。得率(冻干粉量/生药量)为40.55%(121.6 g/300 g),取出后将其迅速转移至自封袋中,置于低温、干燥避光处保存备用。另外,课题组前期[7]测得当归补血汤中阿魏酸、毛蕊异黄酮、芒柄花黄素、黄芪甲苷质量分数分别为0.34、0.64、0.67、0.113 mg/g。
2.3.2 灌胃药液制备 取适量冻干粉置于烧杯中,加入80 ℃热水溶解,制成相当于2 g/mL 生药量的汤剂,灌胃体积为10 mL/kg,相当于生药量20 g/kg(为临床用量的5 倍,约含阿魏酸6.8 mg/kg、毛蕊异黄酮12.8 mg/kg、芒柄花黄素13.4 mg/kg、黄芪甲苷2.26 mg/kg)[7]。
2.3.3 血浆样品采集 取6 只雄性大鼠,给药前12 h 禁食,自由饮水,在灌胃给予当归补血汤后0.083、0.167、0.25、0.5、0.75、1、1.5、2、3、4、6、8、10、12 h 眼眶采血各0.3 mL,肝素钠抗凝,4 ℃下13 000 r/min 离心5 min,取上层血浆,置于-80 ℃冰箱中保存备用,其间每取血4 次,即皮下注射生理盐水1 mL 以保持循环血量稳定。
2.3.4 血浆样品处理 上述冷冻血浆室温下溶解,取100 μL 置于1.5 mL EP 管中,加内标溶液10 μL、甲醇1 mL,涡旋2 min 后4 ℃下15 000 r/min 离心10 min,取全部上清液转移至另一EP 管中,40 ℃下离心浓缩至完全干燥,加入100 μL 甲醇涡旋5 min复溶干燥沉淀物,4 ℃下15 000 r/min 离心10 min 后取上清2 μL,注入UPLC-MS/MS 系统进样分析。
2.3.5 统计学分析 数据以()表示。血药浓度-时间数据通过DAS 3.0 软件按非房室模型处理,计算药动学参数,再通过SPSS 22.0 软件进行处理。
2.4 方法学考察
2.4.1 专属性试验 取大鼠空白血浆、空白血浆+混标溶液+内标溶液、含药血浆+内标溶液,按“2.3.3”项下方法处理,在“2.1”项条件下进样测定,结果见图1,可知大鼠血浆内源性物质不干扰测定,专属性良好。
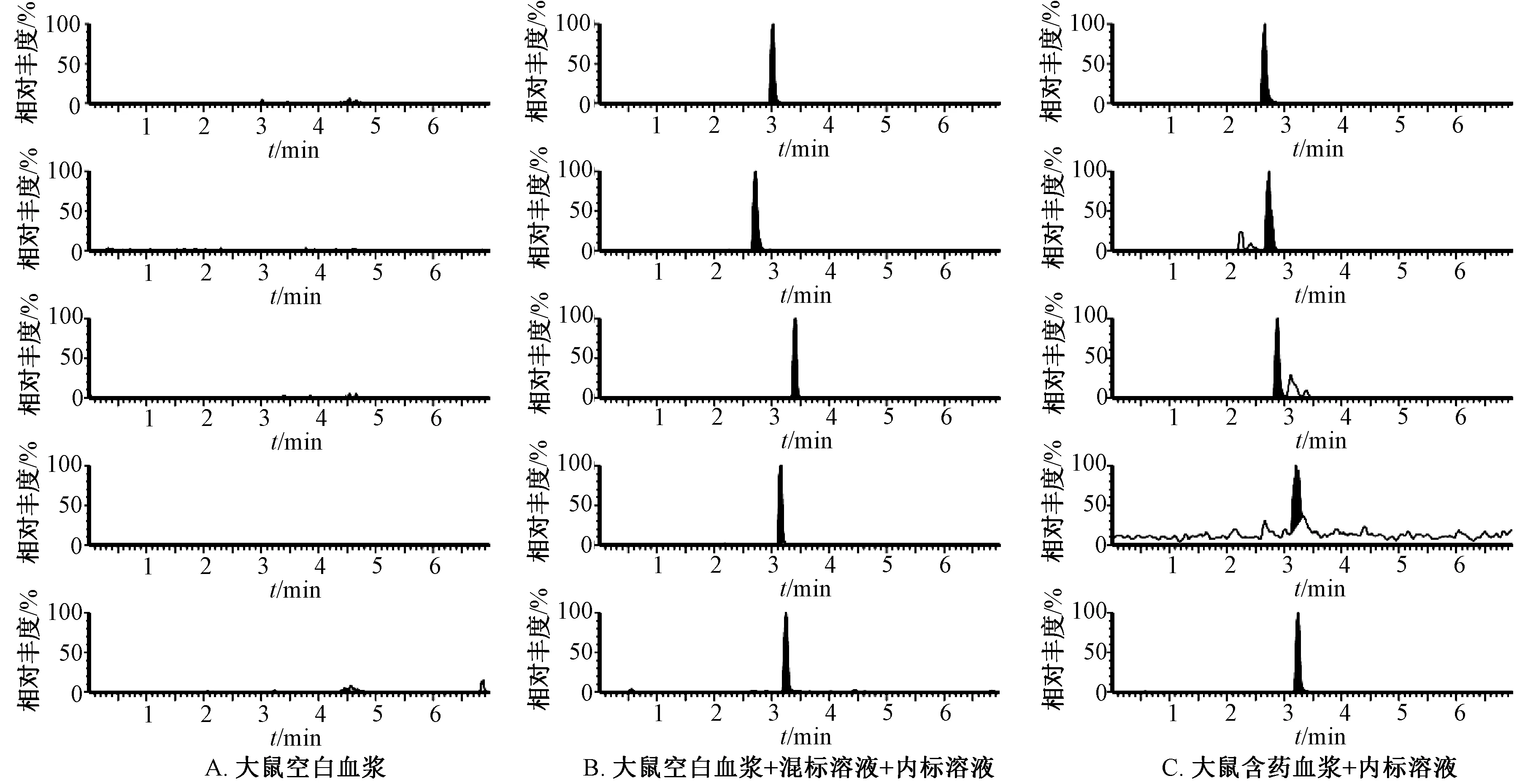
图1 专属性试验色谱图Fig.1 Specific test chromatograms
2.4.2 线性关系考察 取大鼠空白血浆80 μL,加入“2.2”项下不同质量浓度溶液各10 μL,涡旋混匀2 min,配制成含阿魏酸1.93~495.00 ng/mL、毛蕊异黄酮2.22~1 135.00 ng/mL、芒柄花黄素2.60~333.13 ng/mL、黄芪甲苷2.15~275.00 ng/mL 6 个不同质量浓度的血浆样品,按“2.3.4”项下方法处理后在“2.1”项条件下进样测定。以待测成分、内标峰面积比值(Y)对溶液质量浓度(X)进行回归,最低定量限以S/N≥10 计,结果见表2,可知各成分在各自范围内线性关系良好。
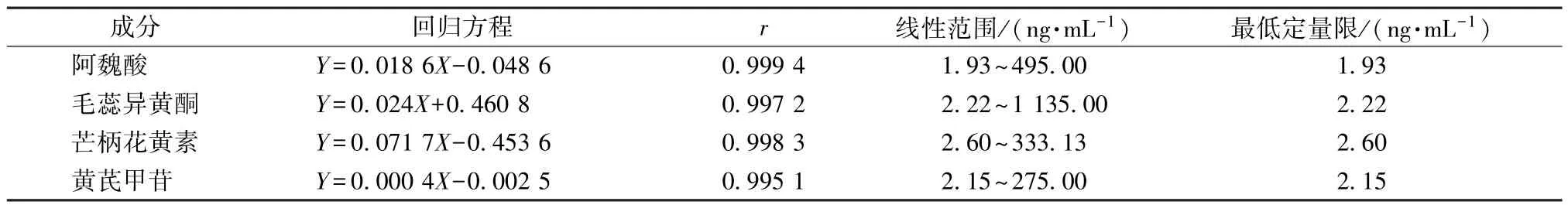
表2 各成分线性关系Tab.2 Linear relationships of various constituents
2.4.3 基质效应、提取回收率 在按“2.3.3”项下方法预处理后的空白血浆中加入“2.2”项下不同质量浓度溶液,在“2.1”项条件下进样测定,计算基质效应;配制不同质量浓度混合标准品,平行3 份,按“2.3.3”项下方法处理,在“2.1”项条件下进样测定,计算提取回收率,结果见表3。
2.4.4 精密度、准确度试验 配制“2.2”项下不同质量浓度混合标准品,平行3 份,按“2.3.3”项下方法处理,在“2.1”项条件下进样测定,同一天内于不同时间点各进行1 次,计算日内精密度;连续几天进行,每天1 次,计算日间精密度,将进样后所得峰面积与内标峰面积的比值代入回归方程,所得质量浓度与实际质量浓度的比值即为准确度。结果,不同质量浓度下各成分日内、日间精密度RSD 均小于11.79%,准确度在94.41%~110.46%之间,表明该方法精密度、准确度良好。
2.4.5 稳定性试验 配制“2.2”项下不同质量浓度混合标准品,平行3 份,分别考察室温下放置6 h、4 ℃下自动进样器内放置24 h、冷冻-解冻3个循环时的稳定性,结果见表4,可知该方法稳定性良好。
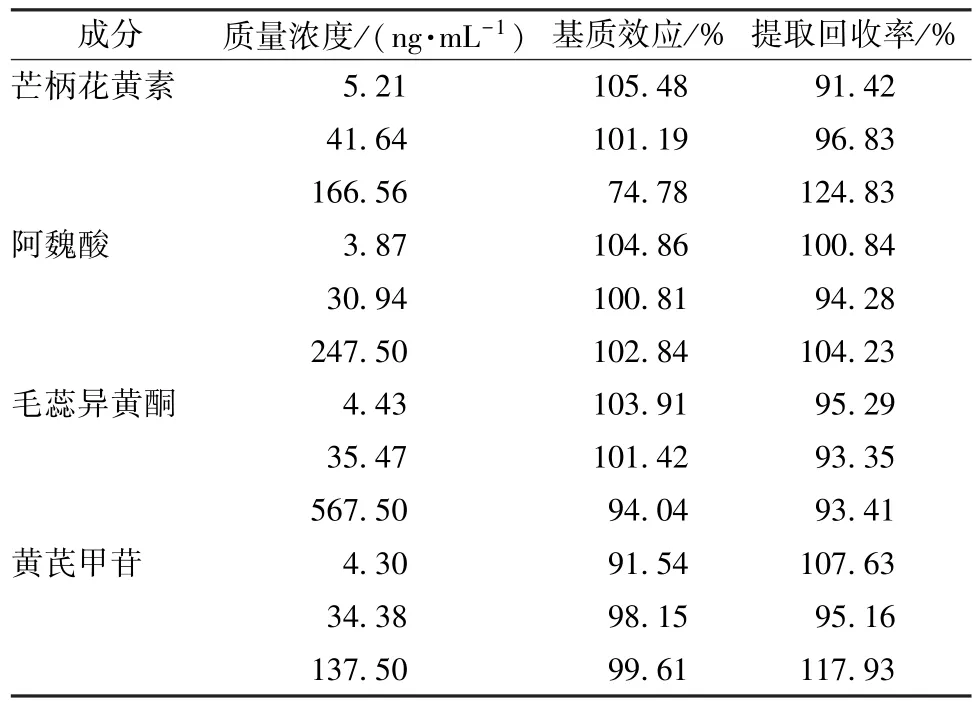
表3 各成分基质效应、提取回收率测定结果Tab.3 Results of matrix effect and extraction recovery determination of various constituents
2.5 药动学研究 图2 显示,芒柄花黄素吸收代谢相对较慢,60 min 才达到最大血药浓度;阿魏酸吸收基本呈单峰,20 min 左右血药浓度即达到最高;毛蕊异黄酮吸收也呈单峰;黄芪甲苷在体内有2 个吸收高峰,在60 min 时血药浓度达到最高峰,之后缓慢下降,但在240 min 左右又出现另1 个高峰。具体参数见表5。
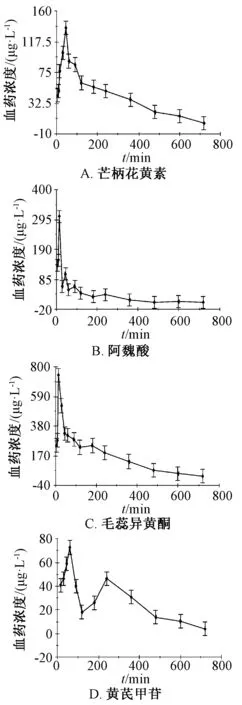
图2 各成分血药浓度-时间曲线Fig.2 Blood concentration-time curves for various constituents
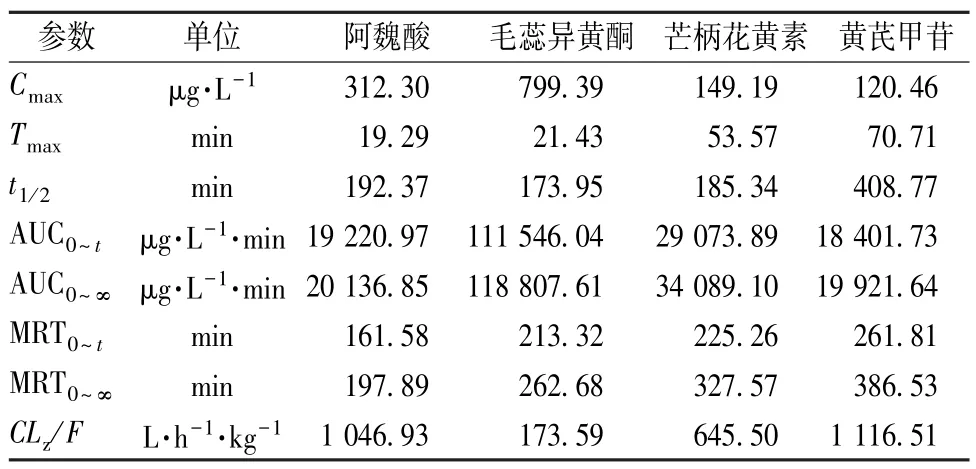
表5 各成分主要药动学参数(n=6)Tab.5 Main pharmacokinetic parameters for various constituents(n=6)
3 讨论
中药方剂体内吸收多种物质的药动学一直是中药方剂药效研究的重点和指导临床中药方剂使用的关键[8]。王文萍等[6]报道了当归补血汤不同药材配伍比例中阿魏酸、黄芪甲苷药动学差异,但考虑到中药方剂成分的复杂性,这仍不足以为临床用药提供一个较为可靠的用药模型。
阿魏酸具有抗炎、抗氧化、抗抑郁作用[9-10],本实验发现该成分含有量在大鼠灌胃给药20 min后即达到最高,同时MRT0~∞也相较于其他成分短,与文献[11]报道一致,表明其体内吸收代谢过程较快,可能与其较小的分子量、组织内广泛的分布、首过效应[12-13]有关。黄芪甲苷体内吸收慢,含有量、利用率低,但出现2 个吸收高峰,Yi等[14]发现肝肠循环和肠道微生物群是二次吸收高峰出现的主要原因。
黄酮类物质在中药化学成分中占据重要位置[15],本实验对黄芪中含有量较高的2 种代表性黄酮——毛蕊异黄酮、芒柄花黄素进行准确定量分析,从AUC0~∞来看,前者体内吸收量远大于后者,这与文献[14]报道一致。大量研究表明,除了毛蕊异黄酮外,黄芪中还含有大量毛蕊异黄酮葡萄糖苷[16-17],Ruan 等[18]认为它可在肠道菌群的作用下水解为苷元——毛蕊异黄酮,后者高渗性可促进其吸收,并在体内水解为游离毛蕊异黄酮[19],增加体内总量,可能是两者体内含有量差异的主要原因。
综上所述,本实验建立了UPLC-MS/MS 法来对大鼠灌胃当归补血汤后血浆中酚酸类、黄酮类、皂苷类成分进行快速、高效、准确的定量分析,并通过DAS 软件拟合出药时曲线,可为该方临床应用和质量监控提供参考。
