CRISPR/Cas9递送系统的研究现状及应用进展
2020-05-12潘秀华吴正红祁小乐
潘秀华,吴正红,祁小乐
(中国药科大学药学院药剂系,南京211198)
规律成簇的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats sequences,CRISPR)是能为细菌和古生菌提供对病毒和质粒的适应性免疫的 DNA重复序列[1]。CRISPR系统有Ⅰ型、Ⅱ型和Ⅲ型,其中CRISPR/Cas9作为Ⅱ型的标记基因研究最多,是继锌指核酸内切酶(zinc finger nuclease,ZFN)、类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALEN)之外出现的第3代基因编辑技术,其介导的基因编辑可用于生成转基因模型、调节转录、调控表观遗传等。
CRISPR/Cas9系统主要是由Cas9蛋白和单链导向 RNA(single guide RNA,sgRNA)组成,其中Cas9蛋白具有切割DNA双链功能,sgRNA起导向作用,在原型间隔区相邻的基序(protospaceradjacent motif,PAM)存在的情况下,Cas9蛋白可以在sgRNA导向作用下通过碱基互补配对到达不同的靶部位,切割靶基因实现DNA双链断裂(double strand break,DSB)。DSB修复有两种机制:(1)非同源末端连接(non-homologous end joining,NHEJ),NHEJ介导的修复可在DNA双链断裂位点产生不精确的可变长度的插入和/或删除突变;(2)同源重组修复(homology-directed repair,HDR),HDR介导的精确修复可以从单链或双链DNA供体模板引入精确的点突变或插入突变[2](图 1)。
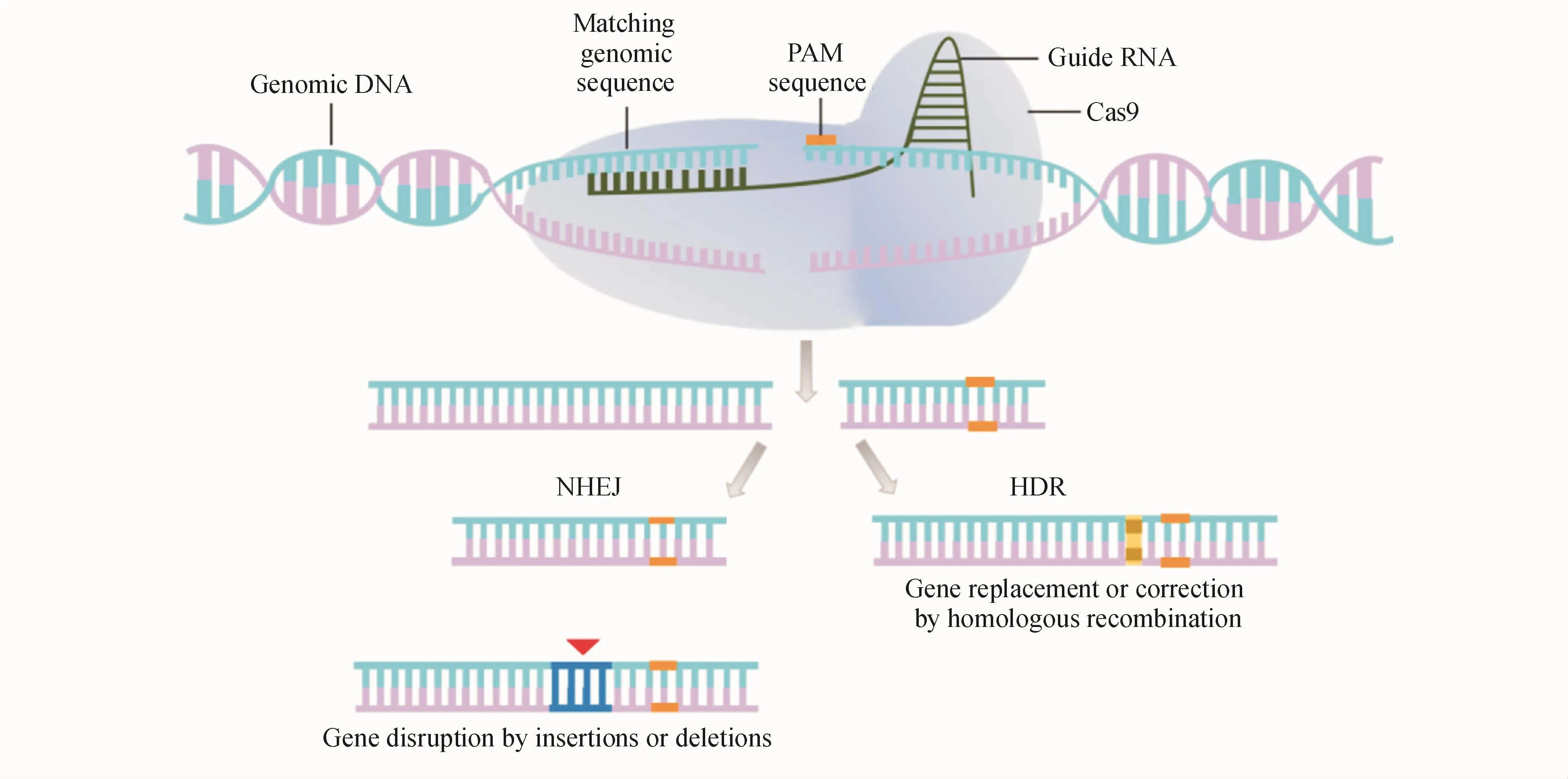
Figure 1 Schematic of CRISPR-Cas9-mediated genome editing[3]
目前,CRISPR/Cas9系统的递送可分为基于质粒、RNA和蛋白质这3种水平的递送。其中,递送编码Cas9蛋白和sgRNA的质粒无需多次转染,方便快捷,稳定性高;递送编码Cas9蛋白的mRNA相较于递送质粒有更低的脱靶率;直接递送Cas9蛋白相较于DNA或RNA的递送方式有一定的优势,其免疫原性低且不存在将CRISPR基因永久整合到宿主基因组中的潜在问题。CRISPR/Cas9系统的递送常用到的物理方法有电穿孔法[4]、显微注射法[5]和尾静脉高压注射法[6]等。CRISPR/Cas9系统的病毒载体有腺病毒(AAV)、慢病毒(LV)和噬菌体等。随着近几年纳米技术的发展,CRISPR/Cas9系统的非病毒载体在体内和体外都有效地实现了向细胞和组织的递送,纳米载体逐渐成为CRISPR/Cas9系统基因治疗的潜力工具,新兴的递送策略也使得CRISPR/Cas9系统的递送更加成熟。
由于CRISPR/Cas9系统的高效性、多功能性和简便性,该系统已成为生物医学领域治疗多种疾病的新策略,如治疗传染病、治疗肿瘤、建立人类疾病模型等。然而由于基因水平的修饰存在局限性,CRISPR/Cas9系统的发展仍需要进一步的探索研究以实现其更大的应用价值。
1 CRISPR/Cas9系统的递送形式
CRISPR/Cas9系统要实现Cas9蛋白和sgRNA两个元件的递送,其中Cas9蛋白的递送形式可以分为以下3种(图2):(1)递送表达Cas9蛋白的质粒;(2)递送编码 Cas9蛋白的 mRNA;(3)直接递送Cas9蛋白。3种递送形式的CRISPR/Cas9系统都能在sgRNA的导向作用下到达靶部位从而有效地实现基因组编辑[7]。
1.1 从DNA水平递送CRISPR/Cas9系统
由于稳定性高、操作简单、成本低等优点,从DNA水平递送编码Cas9蛋白和sgRNA的质粒是一种常用的递送形式。然而递送质粒会降低基因编辑效率,延长Cas9蛋白切割时间从而使脱靶率增加,另外还有基因整合风险等。
为了提高质粒转染的基因编辑效率,Shin等[8]将编码Cas9蛋白及sgRNA的质粒迭代转染到CHO细胞,与传统的单次转染方法相比,迭代转染将Cas9蛋白和sgRNA的表达水平提高了3倍。同时该研究还分别验证了将单个及多个sgRNA与Cas9蛋白共同编码进质粒,最终对单基因和多基因实现靶向基因编辑,通过迭代转染最终使单基因和多基因靶点的突变率平均都增加2倍。
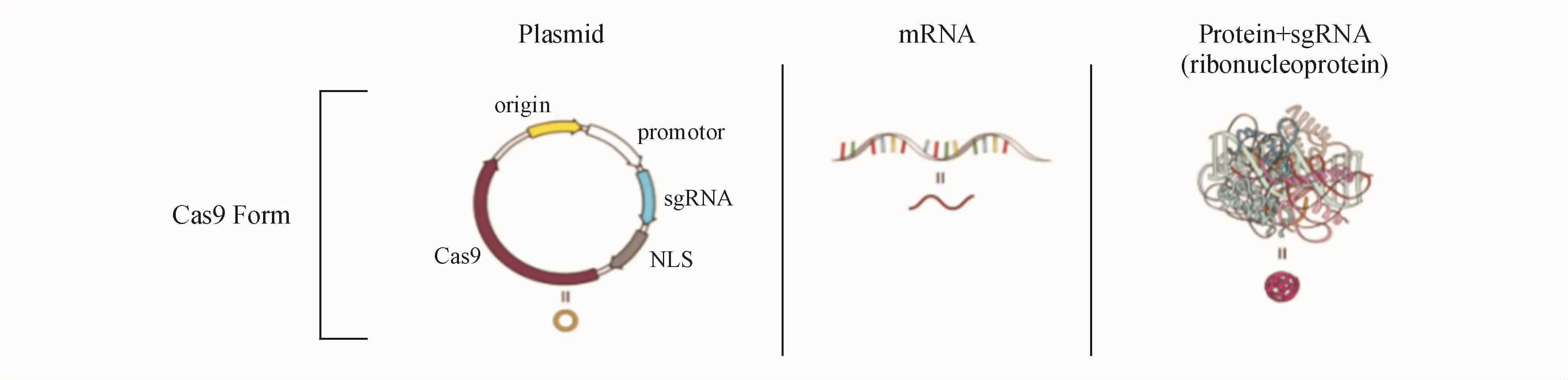
Figure 2 Schematic of CRISPR-Cas9-mediated genome editing[7]
Ghassemi等[9]构建编码Cas9蛋白和双sgRNA的质粒,旨在靶向断裂Hbb-bs基因的外显子2和3位点,将重组质粒通过显微注射法递送到供体受精卵,将受精卵植入受孕小鼠进行后代筛选和基因分型,最终建立了Hbb-bs基因敲除的β-地中海贫血小鼠模型。
1.2 从RNA水平递送CRISPR/Cas9系统
RNA水平的递送是递送编码Cas9蛋白的mRNA和sgRNA,mRNA只需递送到细胞质,在细胞质中核糖体的作用下翻译成Cas9蛋白。该递送方式的局限性在于mRNA本身稳定性差且在体内和体外都易受到RNA酶的降解,因此需要合适的递送方法来保护mRNA不被酶降解。
Miller等[10]制备了可以包封长序列RNA的两性离子氨基脂质(zwitterionic amino lipid,ZAL)非病毒载体,其由阳离子脂质和两性离子脂质结合而成,阳离子脂质含RNA结合域并有助于内体逃逸,两性离子脂质帮助RNA溶解。利用该载体首次实现编码Cas9蛋白的mRNA和sgRNA的体内外共递送,且与瞬态疗法 RNAi对比,ZAL递送编码Cas9蛋白的mRNA和sgRNA能永久实现基因编辑并持续下调95%的蛋白表达。
1.3 从蛋白水平递送CRISPR/Cas9系统
递送Cas9蛋白和sgRNA是最直接简便的方法,该形式无转录和翻译过程,基因编辑更快速高效,脱靶率低且毒性小。Cas9蛋白和sgRNA可形成核糖蛋白复合物(ribonucleoprotein complex,RNP),Cas9蛋白通常带有核定位信号(nuclear localization sequence,NLS)帮助RNP入核完成基因编辑,该形式递送的难点在于RNP尺寸较大不易包封,因此探索其合适的递送载体尤为重要,目前RNP常用载体有脂质体、金纳米颗粒、阳离子聚合物等,近几年新型载体的开发也能帮助RNP完成内体逃逸并入核,如DNA纳米花[11],锌和咪唑复合框架[12],ARRDC1介导的细胞微泡[13]等。
Zuris等[14]将带正电的Cas9蛋白与带负电的GFP蛋白融合,再与sgRNA形成复合物。体外结果显示,利用阳离子脂质体递送融合了GFP蛋白的RNP比直接递送质粒具有更高的基因编辑效率。体内研究结果表明,经阳离子脂质体体内递送RNP至小鼠内耳,最终基因编辑效率约为20%。
2 CRISPR/Cas9系统的病毒载体
近年来,CRISPR/Cas9系统的病毒载体因其高效的转染效率和稳定的转基因表达,在体内外均得到了广泛的应用。常用的病毒载体包括腺相关病毒(adenoviral vectors,AAV)、腺病毒(adeno-associated viruses,AdV)、慢病毒(lentiviral vectors,LV)和噬菌体(bacteriophages)。
2.1 腺相关病毒(AAV)
由于AAVs具有良好的安全性和治疗潜力,其已经被批准用于基因增强治疗的一些人类临床试验。相对于其他病毒载体,腺相关病毒载体表现出更低的免疫原性,因此AAVs是递送CRISPR/Cas9系统应用最广泛的病毒载体。AAVs载体的局限性在于其包封量仅4.7 kb,而来源于酿脓链球菌的Cas9蛋白(Streptococcus pyogenes Cas9,SpCas9)的的大粒径致使需要AAVs载体分别递送Cas9蛋白和sgRNA,针对包封尺寸的限制,更小的Cas9蛋白的变体被研究出来。Ran等[15]筛选出来自金黄色葡萄球菌的Cas9蛋白(Staphylococcus aureus Cas9,SaCas9),与SpCas9有类似的基因编辑能力,同时缩短了超过1 kb。
Bengtsson等[16]证实AAV可以递送靶向肌肉基因的CRISPR/Cas9系统,并在体内完成HDR介导的杜氏肌营养不良症(duchenne muscular dystro-phy,DMD)相关基因编辑。Yoon等[17]通过重组腺相关病毒(recombinant adeno-associated viruses,rAAVs)将CRISPR/Cas9系统转导到小鼠胚胎中,从而产生遗传改造的小鼠。由于rAAVs无需胚胎分离、显微注射、胚胎培养和转移到假孕雌性冗长的过程,该研究可以进一步促进小鼠及其他哺乳动物的基因编辑。
2.2 腺病毒(AdV)
AdV是一种无包膜的具有二十面体核衣壳结构的双链DNA病毒,它具有良好的生物学特性、遗传稳定性、高基因转导效率和大规模易用性。Ehrke-Schulz等[18]用高容量腺病毒(high-capacity adenoviral vectors,HCAdV)作为载体,该载体不表达任何降低免疫原性的病毒基因。该研究构建了人类乳突病毒(human papilloma virus,HPV)致癌基因E6,杜氏肌营养不良症(DMD)肌养蛋白相关基因,HIV共受体C-C趋化因子受体5(C-C chemokine receptor type 5,CCR5)2种基因靶向的 CRISPR/Cas9递送机制,最高的基因插入缺失可达93%,但HCAdV递送CRISPR/Cas9系统还未应用于体内。Jin等[19]以AdV为载体开发了基于CRISPR的基因敲除的简化方法,能进行基因敲除的表型分析,且无需克隆选择和扩增。
2.3 慢病毒(LV)
慢病毒的包封量在8 kb左右,是由单链RNA组成的球形结构,在递送CRISPR/Cas9系统中被广泛应用。LV同腺病毒相同,其删除所有基因从而不会激活免疫系统。LV作为对CRISPR/Cas9的递送载体,宿主基因组整合可能导致不必要的非靶点插入突变,存在安全性风险。目前大多数实验室不具备制备非基因组整合LV载体的能力,因此LV的使用频率低于AAV和AdV,其最常用于建立疾病模型。
Holmgaard等[20]开发了基于慢病毒的递送载体,其能够敲除血管内皮生长因子 A(vascular endothelial growth factor A,Vegfa)基因。结果显示,通过慢病毒载体递送的SpCas9蛋白和sgRNA可以实现小鼠视网膜中的Vegfa基因组编辑,该发现为开发治疗眼部疾病的提供了新策略。Tagliafierro等[21]利用慢病毒作为载体,将dCas9与DNA甲基转移酶 3A(DNMT3A)的催化域融合,以递送CRISPR/dCas9-DNA甲基化系统。从表观遗传学角度调控SNCA基因的表达水平,为从基因层面上治疗帕金森疾病提供了依据。
Lu等[22]开发了一种慢病毒生物纳米颗粒(lentivirus-like bionanoparticle,LVLP)载体,能包封多达100个表达SaCas9蛋白的mRNA。与用腺相关病毒或表达SaCas9的慢病毒转导的细胞相比,用含有SaCas9 mRNA的LVLP转导的细胞中发生较低的脱靶率。
2.4 噬菌体
噬菌体载体主要用于抗多药耐药菌,由于其狭窄的宿主选择性,其研究应用相对较少。Yosef等[23]利用裂解噬菌体递送CRISPR/Cas9系统择性地杀死多重耐药细菌。Qazi等[24]从噬菌体P22衍生出类病毒颗粒(virus-like particles,VLPs),将Cas9蛋白和sgRNA包封到P22 VLP中,结果表明包封了Cas9和sgRNA后的P22 VLP可以靶向断裂DNA双链从而有效地实现基因编辑,该研究证实了P22作为CRISPR/Cas9系统细胞特异性靶向载体的潜力。
3 CRISPR/Cas9系统的非病毒载体
尽管病毒载体通过细胞转导能够有效地递送CRISPR/Cas9系统,但仍可能在宿主体内引起不必要的免疫原性和突变风险,从而限制其临床转化。近年来非病毒载体尤其是纳米载体对CRISPR/Cas9系统递送的研究取得了一定进展。
3.1 脂质体
目前市面上有商业化的脂质体载体,如LipofectamineTM,TurboFectTM,和 StemfectTM等已经完成了对CRISPR/Cas9系统的递送,在此基础上新型脂质体载体的开发也取得了初步进展。
Li等[25]开发了含有二硫键的阳离子脂质体对Cas9蛋白和 sgRNA递送并实现基因编辑,载CRISPR/Cas9系统后的纳米颗粒有较高的靶向基因敲除能力并具有较低毒性,同时还研究了其体内分布情况,该研究为疾病造模和治疗方面提供了递送基因编辑工具的新途径。
Cho等[26]在设计了靶向二肽基肽酶-4基因(dipeptidyl peptidase-4 gene,DPP-4)的 sgRNA,与Cas9蛋白形成复合物并用卵磷脂阳离子脂质体进行包封,将纳米制剂静脉注射到二型糖尿病小鼠体内,能显著实现DPP-4基因破坏,同时还伴随着血糖水平正常化,胰岛素反应和肝肾损伤降低,该研究开发的卵磷脂阳离子脂质体作为改善人肝病基因组编辑疗法的载体具有巨大潜力。
3.2 聚合物
聚合物广泛用于基因药物的递送。带正电荷的聚合物可以通过静电吸引与带负电荷的核酸复合完成对基因药物的包封,有研究表明聚合物载体是通过与相同的网格蛋白介导的内吞作用机制进入细胞。
二硫键和咪唑基团能够帮助载体RNP有效地包封、细胞摄取、内体逃逸以及在细胞质内成功释放RNP。Wang等[27]制备了氧化还原响应型PBAP复合物和CLPBAP复合物(即非交联和交联),其含有二硫键和咪唑基团能够有效地包载带负电的RNP。将金刚烷(adamantane,AD)和 β-环糊精(β-cyclodextrin,β-CD)与基于 PBAP的聚合物缀合,通过β-CD和AD之间的主客体相互作用形成的交联PBAP复合物,在聚阴离子聚合物如血清白蛋白的存在下比非交联的PBAP复合物更稳定(图3-A)。类似地,Chen等[28]制备了含有阳离子嵌段共聚物的载体,其含有二硫键和咪唑基团,是谷胱甘肽(glutathione,GSH)响应型纳米载体,实现了对带负电的RNP的包载并完成内体逃逸,该载体具有相对较高的转染效率和较低的细胞毒性。
3.3 金纳米颗粒
金纳米颗粒作为无机纳米材料具有优异的化学稳定性、良好的生物相容性和较大的比表面积,可进行化学修饰用作基因递送的良好平台。Mout等[29]用精氨酸金纳米颗粒(ArgNPs)实现了对Cas9蛋白和sgRNA的共递送,ArgNPs将RNP有效地递送到细胞质,随后向细胞核转运,该方法实现了高达90%的递送效率和30%的基因编辑效率。
Lee等[30]证明由金纳米颗粒与DNA结合并与阳离子聚合物复合组成的递送载体CRISPR-Gold可以将RNP和供体DNA递送到多种细胞中,通过HDR编辑基因有效地纠正导致杜氏肌营养不良(DMD)小鼠的DNA突变。CRISPR-Gold为治疗点突变和缺失引起的DMD提供了一种新的治疗策略。
Wang等[31]制备金纳米簇(GNs)为核心以脂质为外壳的纳米载体,递送编码 Cas9蛋白和sgRNA的质粒,同时用转录肽的HIV-1反式激活因子修饰GNs,可将 CRISPR/Cas9系统递送到细胞核中。sgRNA设计为靶向肿瘤的Plk1基因来治疗黑素瘤,在体外导致A375细胞的Plk1蛋白表达下调超过70%(图3-B)。
3.4 其他新型非病毒载体
Sun等[11]通过滚环复制的方法制备了 DNA纳米花(DNA Nanoclews,DNA NC),纯化的 Cas9蛋白和sgRNA在体外形成RNP,RNP通过sgRNA和DNA纳米花之间的碱基互补配对原则与DNA纳米花相结合,成功包载后将带正电荷的PEI包被在DNA纳米花外以促进内体逃逸。该研究以U2OS.EGFP作为报告细胞系,证实了DNA纳米花载CRISPR/Cas9系统在sgRNA导向作用下能靶向破坏EGFP基因(图3-C)。
Alsaiari等[12]利用含有咪唑基和锌离子制备的结构型载体(zeolitic imidazole frameworks,ZIFs),有效地实现了大粒径Cas9蛋白和sgRNA的包封制成CC-ZIF纳米颗粒,入胞后载体中的咪唑基在pH条件下质子化促进了CC-ZIF内体逃逸并向细胞核转运,最终对EGFP蛋白的表达水平下调37%(图3-D)。
除了上述新型的纳米载体之外,还有抑制蛋白结构域蛋白1(ARRDC1)介导的微泡(ARRDC1-mediated microvesicles,ARMMs)[13],氧化石墨烯(graphene oxide,GO)纳米载体[32]等也实现了CRISPR/Cas9系统的递送。
4 CRISPR/Cas9系统递送的新策略
4.1 Cas9蛋白和sgRNA的修饰
为了更好地实现CRISPR/Cas9系统的递送,对Cas9蛋白和sgRNA修饰也被广泛研究,修饰后的Cas9蛋白和sgRNA可以降低脱靶率以及增加稳定性等。Ferdosi等[33]将T细胞受体接触残基疏水性与HLA结合,通过增强预测算法鉴定HLA-A*02:01的两种免疫显性SpCas9 T细胞表位,研究发现SpCas9蛋白进行修饰后能消除免疫显性表位,同时保留其功能和特异性。
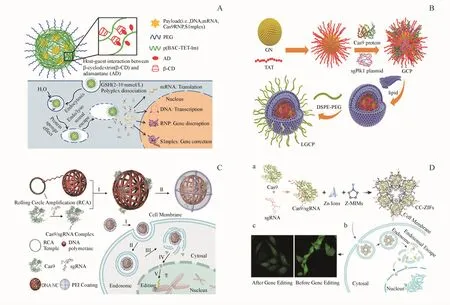
Figure 3 Nonviral vectors for CRISPR/Cas9 deliveryA:Illustration of a CLPBAP polyplex and the intracellular tracking pathway[27];B:Schematic diagram of the synthesis process of the LGCP[31];C:Preparation of Cas9/sgRNA/NC/PEI and delivery pathway to the nucleus[11];D:Schematic for the preparation of CC-ZIFs and endosomal escape[12]
除了对Cas9蛋白进行修饰外,还可将sgRNA由20个核苷酸缩短到17或18个以降低脱靶率。Hendel等[34]合成 100 nt全长 sgRNA后,在 5′端和3′端进行 2′-O-甲基(M),2′-O-甲基 3′-硫代磷酸酯(MS)或2′-O-甲基 3′硫代膦酰基乙酸酯(MSP)的3种不同化学修饰,结果表明,对sgRNA进行化学修饰后能增强人类原发性T细胞、CD34+造血干细胞和祖细胞的基因组编辑效率。
4.2 细胞穿透肽
细胞穿透肽(cell penetrating peptide,CPP),是一种具有跨细胞膜转运能力的短肽,已被用作实现高效Cas9蛋白和sgRNA递送的工具。Suresh等[35]利用 CPP的缀合实现了 CRISPR/Cas9系统的递送并实现基因破坏。Ramakrishna等[36]证实CPP介导的重组Cas9蛋白和sgRNA的递送实现了有效的基因破坏,并且与质粒转染相比脱靶突变率降低。
Lostalé-Seijo等[37]通过两亲性穿透肽与 Cas9蛋白融合实现RNP的递送,该两亲性穿透肽通过阳离子肽支架和疏水性醛尾之间的腙键形成。此类肽/蛋白质非共价纳米颗粒递送CRISPR/Cas9系统获得的最大基因编辑效率为30%~40%。
5 CRISPR/Cas9系统在医学领域的应用
5.1 建立肿瘤疾病模型
CRISPR/Cas9系统主要用于细胞水平和动物水平的疾病模型建立。在肿瘤研究中,体细胞的遗传缺陷与病因和病理表型密切相关,为从根本上寻求治疗肿瘤的方法,现已建立多种基于CRISPR/Cas9系统的细胞水平肿瘤模型,用于肿瘤基因、药物靶点和肿瘤耐药性的临床前验证。目前基于CRISPR/Cas9系统建立较多的肿瘤细胞模型有肺癌细胞系、乳腺癌细胞系和急性髓细胞性白血病细胞等。Annunziato等[38]建立了CRISPR介导的乳腺癌细胞株模型,揭示了一种新的HER2基因靶向抗肿瘤机制,该方法可以替代临床药物曲妥珠单抗。Yamauchi等[39]为了确定急性髓系白血病(acute myeloid leukemia,AML)治疗的新靶点,首先对AML细胞系进行基因组CRISPR-Cas9筛选,最后在体内进行二次筛选。
目前用CRISPR/Cas9系统建立动物水平的肿瘤疾病模型主要为小鼠。Wang等[40]利用CRISPR/Cas9建立 KRAS-突变体肺腺癌 (lung adenocarcinomas,LUAD)的小鼠模型,评估了 Nf1基因缺失对LUAD发展的影响。Ideno等[41]利用CRISPR/Cas9介导的体细胞重组构建了小鼠模型用于研究胰腺癌的治疗。除肿瘤模型的建立,基于CRISPR/Cas9系统的小鼠模型还应用于其他疾病模型应用[42],如帕金森病、阿尔茨海默病等。为了减小了和患者之间的差距且更适于进行药理研究,基于 CRISPR/Cas9系统的大鼠[43]、猪和猴等动物的多种疾病模型已被建立。
5.2 抗病毒研究
特异性破坏病毒基因是抗病毒策略的新途径,CRISPR/Cas9系统由于其相对的通用性、特异性、灵活性和易用性,已成为各种抗病毒应用的首选之一。目前基于CRISPR/Cas9系统已经有针对人类免疫缺陷病毒(human immunodeficiency virus,HIV)、乙型肝炎病毒(hepatitis B virus,HBV)、疱疹病毒、人类乳头瘤病毒(HPV)等病毒的研究。
获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)是由人类免疫缺陷病毒(HIV)感染引起的,并且仍然无法治愈,抗逆转录病毒疗法可以抑制HIV的生命周期并大幅减少病毒复制,然而这种方法不能完全清除病毒,基因疗法能破坏DNA来永久性抑制HIV基因组,是治疗AIDS的新策略。人类免疫缺陷病毒1型(HIV-1)在人体中引起持续感染并在感染细胞中诱导miR-146a表达,Teng等[44]利用慢病毒作为载体递送CRISPR/Cas9系统,在miR-146a基因组序列中引入突变,抑制miR-146a表达增强细胞因子和HIV-1限制因子的表达,使HIV-1难以复制且原病毒无法再激活,该研究表明CRISPR/Cas9系统在为AIDS基因治疗领域带来巨大潜力。
疱疹病毒的基因治疗也用到了CRISPR/Cas9系统的基因编辑能力。人巨细胞病毒(human cytomegalovirus,HCMV)是疱疹病毒中最大的病毒,因其感染细胞后细胞肿大且内涵体巨大而得名。Gergen等[45]通过多重 CRISPR/Cas9递送敲除了HCMV基因 UL122/123,导致 HCMV复制受损。Ynen等[46]针对 EB疱疹病毒(Epstein-Barr virus,EBV)的治疗设计了靶向EBV基因组的sgRNA,将CRISPR/Cas9系统转染到C666-1细胞中,转染细胞中EBV的DNA水平降低了约50%。
5.3 治疗单基因及多基因疾病
最近的临床试验表明,基因疗法在治疗遗传性疾病方面取得了成功。血友病是一种单基因连锁隐形遗传疾病,FIX基因突变会导致蛋白质功能下降和血液凝固异常。Stephens等[47]探索了腺病毒作为纠正CRISPR/Cas9介导的基因编辑的载体,以幼年HB小鼠作为模型,最终增强FIX基因表达活性及表型矫正。
通过CRISPR/Cas9系统对实现等位基因的选择性编辑有望在多种神经退行性疾病中得到更广泛的应用。亨廷顿舞蹈病(Huntington′s disease,HD)是一种来源于功能获得性胞嘧啶-腺嘌呤-鸟嘌呤(CAG)扩增突变的单基因显性遗传神经退行性疾病。Shin等[48]提出了一种策略,通过CRISPR/Cas9系统使突变等位基因失活,以选择性地切除转录起始位点和CAG扩增突变。该策略导致突变等位基因的完全失活而不影响正常的等位基因。Dunbar等[49]证实 CRISPR/Cas9系统可以在HD的体外模型中诱导插入缺失突变,可以降低线粒体生物标志物,然而还需要进一步证明该策略的安全性和有效性,以更快地向临床应用转化。
除治疗单基因遗传疾病外,CRISPR/Cas9系统的优势在于可通过设计多种sgRNA序列实现多种靶位点的基因编辑,该基因编辑系统已经实现了阿尔茨海默病、肿瘤等多种多基因疾病的治疗。
6 总结与展望
病毒载体具有较高的转染效率,但其具有很高的突变率和致癌风险,这使得病毒载体应用于临床面临巨大挑战。此外,病毒装载能力有限,难以实现CRISPR/Cas9系统的高效递送,因此开发新的非病毒递送载体对CRISPR/Cas9系统介导的治疗至关重要。非病毒载体面临载药难、稳定性差、脱靶率高、靶向递送、免疫原性高以及生产制备困难等的局限性,在纳米技术的发展中也取得了突破性的进展。
多学科的共同发展交互融合有利于新型纳米递送载体的开发,材料化学方面的创新将继续推动Cas9/sgRNA系统纳米载体的发展,近年来,生物材料因其可调性、生物相容性和药物传递效率的不断提高而成为CRISPR/Cas9系统载体材料的绝佳选择。随着新生物材料技术的发展,开发出递送CRISPR/Cas9系统的生物材料载体需具有高基因编辑效率、高组织/细胞特异性、低免疫原性等优点,生物材料载体的开发将加速CRISPR/Cas9系统的临床转化。
CRISPR/Cas9系统给基因治疗领域和各科学领域带来了曙光,尽管其面临着多方面的挑战,但新兴材料和新技术的发展为其向临床转化带来了希望,因此合理设计高效递送和靶向定位病灶组织的载体是现阶段的主要任务,相信随着研究的不断深入,CRISPR/Cas9系统将有望发挥其应有的临床应用价值。
