用于肿瘤免疫治疗的干扰素基因刺激因子激动剂的研究进展
2020-05-12吉力扬王国成谢唯佳
吉力扬,郝 婧,王国成,谢唯佳
(1中国药科大学药物化学教研室,南京210009;2天士力控股集团有限公司天士力研究院,天津300410)
肿瘤免疫疗法是继手术治疗、化疗、靶向疗法之后新的肿瘤治疗手段之一,被Science杂志推举为2013年度全球十大科学研究突破之首。近年来,以CTLA-4、PD-1通路为代表的免疫检查点抑制剂及嵌合抗原受体T细胞免疫疗法(CAR-T)的成功,更加印证了肿瘤免疫疗法独特的优势与广阔的应用前景。干扰素基因刺激因子(stimulator of interferon genes,STING)是DNA感受通路中的关键蛋白,对于固有免疫和适应性免疫启动具有重要作用[1]。STING作为信号转导接头蛋白能募集TANK结合激酶1(TANK binding kinase 1,TBK1)并激活干扰素调节因子3(interferon regulatory factor 3,IRF-3),进而诱导Ⅰ型干扰素(IFN-α、IFN-β)的产生并调控抗肿瘤固有免疫应答反应[2]。作为一种治疗方法,肿瘤内注射STING激动剂已经在多种小鼠肿瘤模型中显示出显著的治疗效果[3-5]。
1 STING通路的生物学机制
1.1 STING蛋白的结构与功能
STING蛋白是与固有免疫应答密切相关的一种信号转导分子,在多种内皮细胞、上皮细胞和造血干细胞中均有表达,主要定位于胞内内质网、线粒体及微粒体的外膜上[6]。人源STING(hSTING)蛋白由379个氨基酸组成,可分为3个结构功能域,包括N端的4次跨膜结构域(TM1~4)、二聚化结构域和C端面向胞质内的结构域。一般认为STING蛋白N端的4个TM使其能够锚定于内质网上,二聚化结构域高度保守,可能与其活化功能有关,而球状的C端结构域含有多种信号基序,其C尾端结构域对STING有着自我抑制作用,是招募TBK1的关键基序[7-8]。hSTINGH232(又称 hSTINGR232H,R232H表示组氨酸His替代原有的精氨酸Arg)与环二核苷酸 c[G(2′,5′)pA(3′,5′)p]结合诱导构形变化。自由状态下的STING二聚体结构比较松散,呈“开放”状态。当二聚体间的U型沟槽被2′,3′-cGAMP占据时,二聚体会形成一个紧密的“关闭”状态(图1-A),并由4个标准的β-折叠片覆盖在结合沟槽上面,使得二聚体完全包裹结合的配体[9]。然而,也有研究发现当氨基苯并咪唑类化合物(di-ABZI)激活STING时,始终使STING保持在“开放”的状态,如图1-B所示[10]。这一发现提高了STING的激活无需封闭构象的可能性。总之,还需要更多的研究以了解STING构象如何调控信号通路的激活。
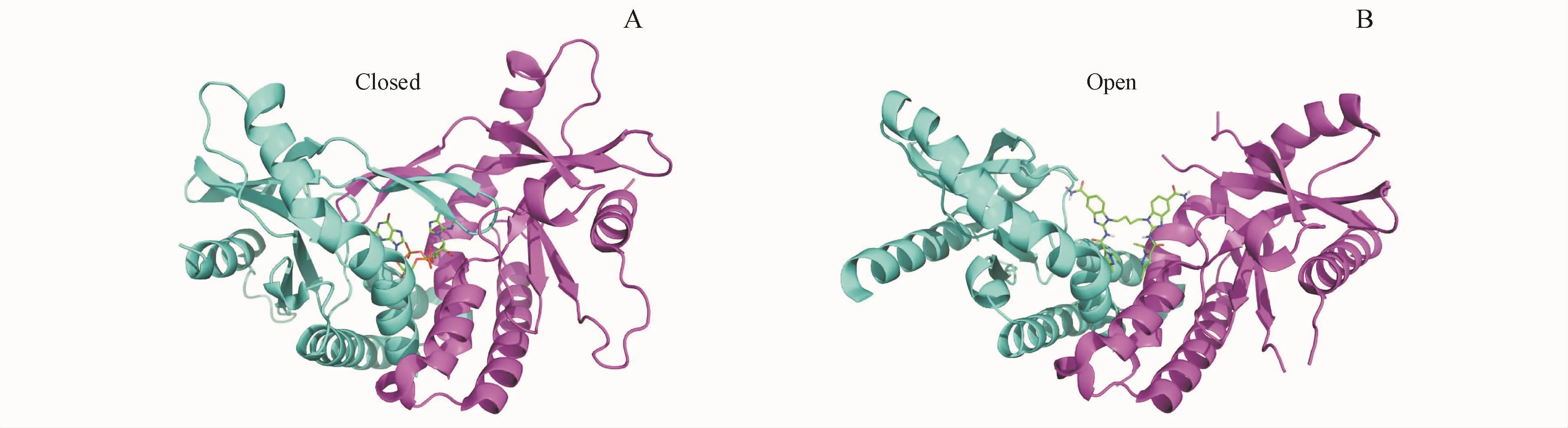
Figure 1 Crystal structure of cGAMP-STING(PDB ID:4 LOH)(A)and di-ABZI compound-STING(PDB ID:6 DXL)(B)
1.2 STING信号通路
由STING蛋白介导的cGAS-STING胞内DNA感受通路参与机体的固有免疫应答,在抗病毒感染、自身免疫疾病和肿瘤免疫治疗中发挥着重要作用,其信号传导机制如下:在识别胞质内的DNA后,环鸟苷酸-腺苷酸合成酶(cGAS)二聚化,催化GTP与ATP反应生成环二核苷酸cGAMP。cGAMP作为第二信使结合并激活STING蛋白,使其形成二聚体。二聚化后的STING蛋白从内质网转移至高尔基体再至核外周小体,招募细胞质中的TANK结合激酶1(TBK1),继而诱导干扰素调节因子 3(IRF3)磷酸化。然后,IRF3进入细胞核中引起干扰素β(IFN-β)和其他基因的转录,发挥生物学效应(图2)[11-14]。
1.3 STING通路在肿瘤免疫监控中的作用
STING通路在肿瘤免疫监控中具有重要作用。肿瘤细胞中存在持续的DNA损伤反应,这导致其细胞溶质中DNA的积累。Woo等[15]报道了宿主体内STING通路识别肿瘤细胞的主要机制:肿瘤来源的DNA被宿主的抗原提呈细胞(antigen presenting cell,APC)监测到并摄入其胞质中,随后激活STING通路,介导依赖STING的Ⅰ型IFN的产生。而多项实验研究表明,肿瘤特异性CD8+T细胞的激活及淋巴细胞的浸润与由Ⅰ型IFN诱导的基因表达密切相关[16-18]。Ⅰ型IFN信号通路缺陷,如干扰素-α/β受体α链或信号转导和转录激活因子1(STAT1)缺陷,将会抑制 IFN的刺激效应,导致针对肿瘤相关抗原的T细胞减少[19]。由此而知,STING通路能够通过介导Ⅰ型干扰素的产生发挥抗肿瘤适应性免疫效应。
2 抗肿瘤STING激动剂
STING介导的天然免疫信号转导是体内生成Ⅰ型干扰素的重要途径之一。采用一定策略激活宿主体内肿瘤微环境中的STING,一方面可以产生Ⅰ型干扰素,促进交叉呈递和抗肿瘤细胞毒T淋巴细胞反应;另一方面活化后的STING诱导趋化因子产生,有助于招募效应T细胞在肿瘤微环境中杀伤肿瘤细胞。此外,通过STING活化的免疫系统还可以提高对放疗的敏感性[20]。这些基本原理有助于STING直接激动剂的研究。
2.1 环二核苷酸类激动剂
微生物产生的 c-di-GMP(1),c-di-AMP(2),3′,3′-cGAMP(3)及人体内合成的 2′,3′-cGAMP(4)是STING的天然激动剂,结合STING后激活宿主的固有免疫应答[21-22]。然而,天然的环二核苷酸激动剂在候选药物特性方面存在明显的不足,例如其相对分子质量大于500,强极性使其难以透过细胞膜,且磷酸酯键易被水解,这些因素一定程度上限制了其临床应用[23]。
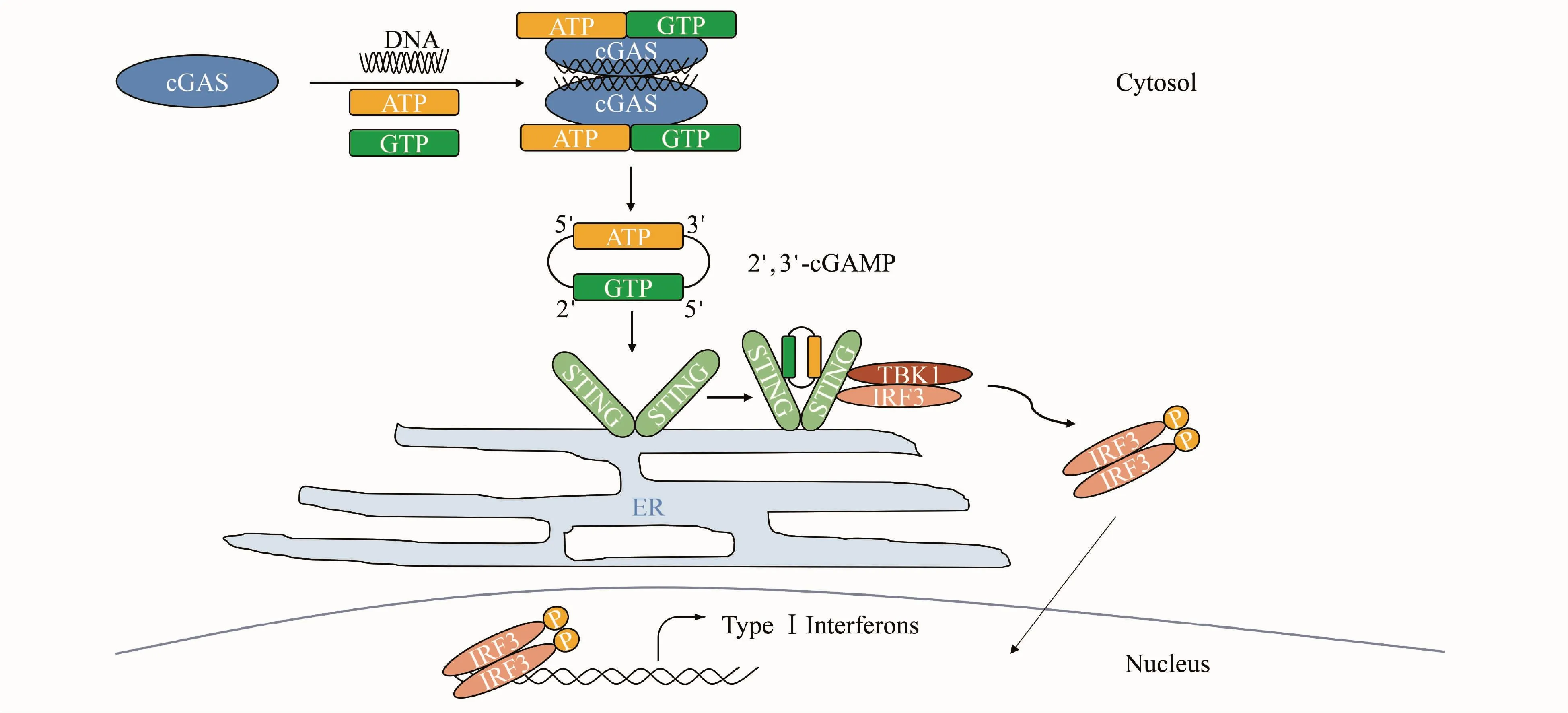
Figure 2 Model for cGAS-mediated cytosolic DNA sensing
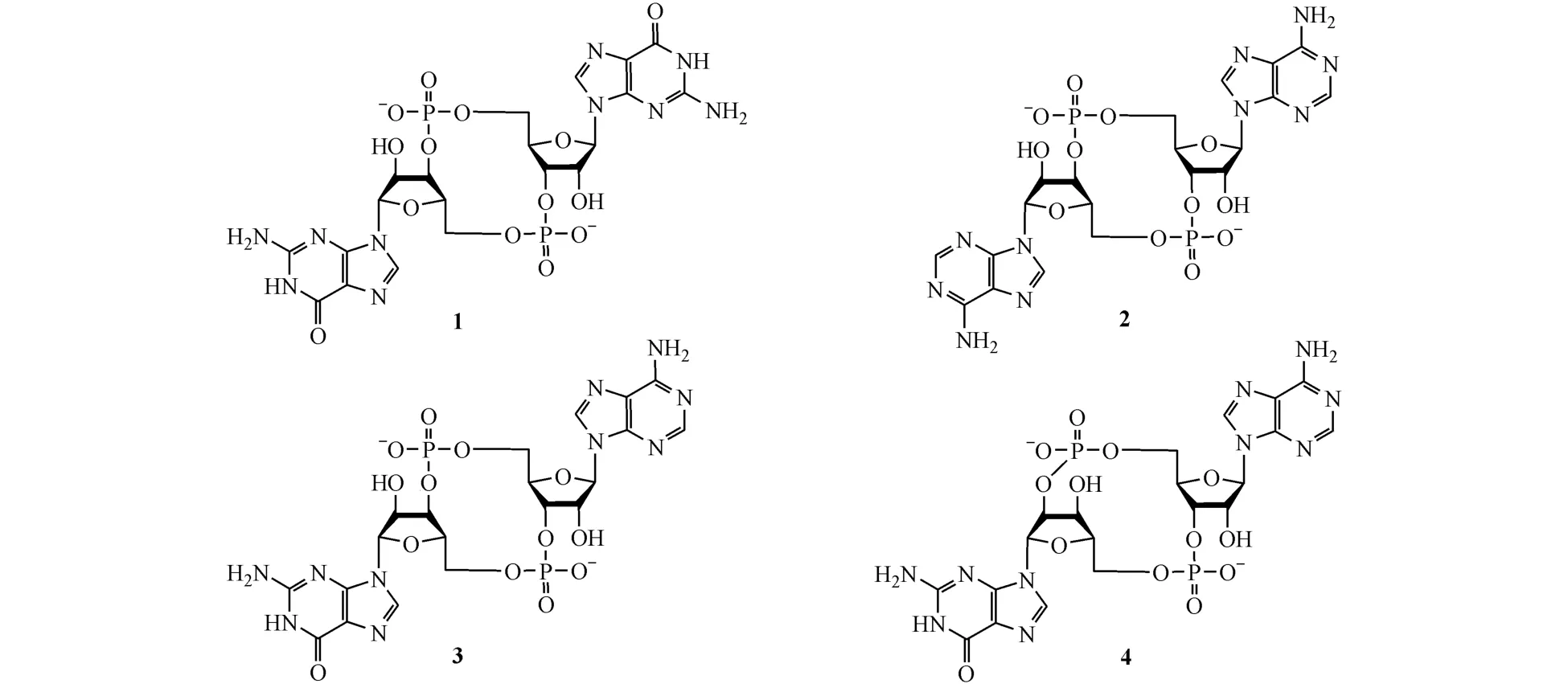
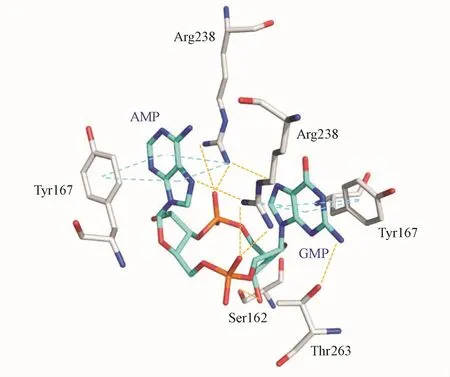
Figure 3 Close-up of the2′,3′-cGAMP-STINGcomplex depicting key interactions
通过对 STING蛋白和2′,3′-cGAMP复合体晶体结构及化合物2′,3′-cGAMP的结构进行分析(图3),结果显示两个嘌呤碱基是与STING蛋白结合的核心基团,其通过多个氢键和 π-π堆积与STING结合。因此,可以将磷酸核糖的环状结构作为这类化合物的分子骨架,两个嘌呤碱基作为药效团,这为设计新型的环二核苷酸类激动剂提供了理论依据。全消除,其中约50%的小鼠存活超过150 d,且免受肿瘤的二次攻击[25]。2015年,Fu等[26]设计出STINGVAX,一种结合合成类环二核苷酸的肿瘤疫苗。实验观察到当结合 ML-RR-S2 CDA时,STINGVAX与PD-1免疫检查点抑制剂联用可明显提高抑瘤效果。目前,针对ML-RR-S2 CDA(也称作MIW815或ADU-S100)的安全与有效性已开展人体临床Ⅰ期试验,用于治疗晚期转移性的实体肿瘤与淋巴瘤。
2014年,Li等[24]鉴别出一种外核苷酸磷酸二酯键水解酶,名为ENPP1。ENPP1能够水解天然环二核苷酸2′,3′-cGAMP。研究人员在这个基础上设计了一系列双硫代抗水解的衍生物,命名为2′,3′-cGsAsMP。体外实验显示这种经过修饰的激动剂结合 STING的能力与 2′,3′-cGAMP相当,但在人THP1细胞中诱导产生Ⅰ型干扰素的能力是后者的10倍。其中,代表化合物ML-RR-S2 CDA(5)拥有高稳定性和高的抗肿瘤效应,能够激活所有的hSTING变体。在小鼠的B16黑色素瘤肿瘤模型中,瘤内注射ML-RR-S2 CDA可显著抑制肿瘤生长。实验结果显示,大多数受治疗的小鼠肿瘤完

MK-1454是默沙东公司开发的一种STING激动剂,用于治疗晚期转移性实体瘤与淋巴瘤,目前也正处于Ⅰ期临床试验研究阶段。有结果显示MK-1454作为单一疗法无应答或部分应答,在与Keytruda的联合治疗中产生部分应答,相关的数据分析试验仍在进行中[27]。目前该公司尚未公开MK-1454的结构,涉及此类激动剂的化合物专利有3个。其中,代表化合物6和化合物7在体外THP-1细胞测定中显示诱导分泌Ⅰ型IFN的能力明显优于2′,3′-cGAMP,化合物 8的 EC50达到了 1 nmol/L[28-29]。
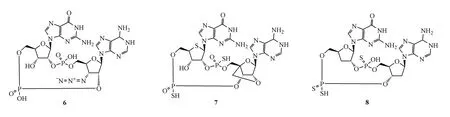
葛兰素史克(GSK)公司的研究人员对 2′,3′-cGAMP中核糖上的自由羟基进行取代修饰,引入F原子,得到化合物9。在对BALB/c小鼠乙肝表面抗原(HBsAg)模型的体内研究中,化合物9与参考激动剂 cGAMP均可调节HBsAg的免疫应答[30]。目前由该公司开发的STING激动剂GSK-532处于临床前研究阶段,虽然其结构尚未公开,但根据该公司申请的关于此类激动剂仅有的一项化合物专利,推测其结构由化合物9改造而来。体外配体实验显示GSK-532与hSTING结合的Kd为3.3μmol/L,体内实验中GSK-532对 CT26细胞移植瘤具有显著抑制作用[31]。
此外,处于临床前研究阶段的CDN类激动剂药物还包括 Spring Bank Pharmaceuticals公司的SB-11285和百时美施贵宝(BMS)与IFM Therapeutics公司联合开发的BMS-986301,二者的结构尚未公布。根据已有临床前研究结果,SB-11285在人单核细胞白血病细胞系中诱导依赖于STING的IFN和 NF-κB表达的 EC50为2和200 nmol/L,分别是2′,3′-cGAMP的 1 000倍与 200倍[32]。瘤内注射BMS-986301分别至CT-26和MC38小鼠肿瘤模型中,结果发现超过90%注射和非注射部位的肿瘤完全消退,而ADU-S100在相同的剂量下肿瘤消退率仅有13%。在CT-26模型中,BMS-986301与抗PD-1抗体的联合治疗引起80%注射与非注射部位肿瘤的完全消退,而单独使用抗PD-1抗体治疗时无效果[33]。
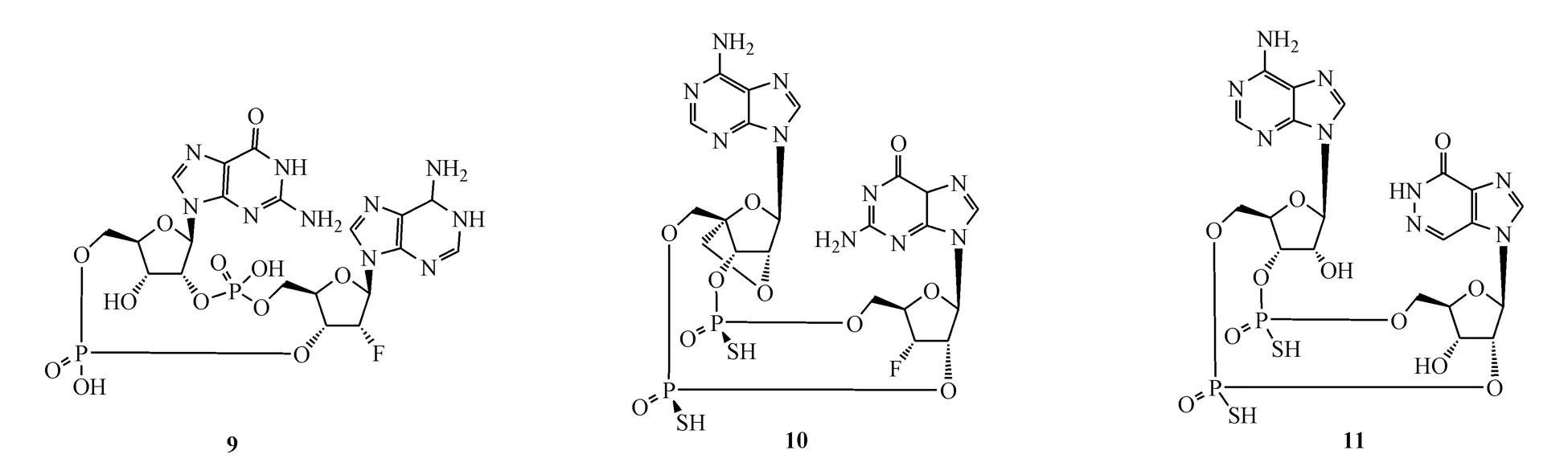
近期,几家公司又相继报道了一些新的CDN类STING激动剂化合物。Aduro公司与诺华公司报道了一类全新结构的环二核苷酸化合物作为STING激动剂,这类激动剂的结构特点是将化合物中核苷酸的2′位与4′位连接成闭环。其中代表化合物10在荧光测试中显示对野生型,HAQ型(STING突变型,存在R71H,G230A和R293Q 3个单点突变)和REF型(STING突变型,存在R232H单点突变)的STING均有较高亲和力。在荧光素酶报告基因检测中,化合物10在THP-1细胞中对HAQ型STING存在激活作用,EC50为 9.5μmol/L[34]。
Boehringer Ingelheim公司的研究人员报道了一类环二核苷酸类似物作为hSTING激动剂,在荧光测试中代表化合物11显示了对hSTING的高亲和力。在IRF诱导的分泌型胚胎碱性磷酸酶报告基因检测中,化合物11激活了人类急性单核细胞白血病THP-1 Blue ISG细胞的hSTING活性,其EC50为0.17μmol/L。对雄性 C57BL/6NRj小鼠静脉注射给予 10μmol/kg化合物 11,在 0.25、0.5、0.75、1和 2 h时血药浓度分别为 2 710、1 280、595、260和 111 nmol/L[35]。
Lioux等[36]设计了一系列新颖的环腺苷酸肌苷酸单磷酸类化合物,通过变化核糖上的取代基团,核苷酸间的连接位置和磷酸上的修饰筛选出了11个能激活STING信号通路的cAIMP类似物,并初步总结出这类化合物的构效关系(图4)。
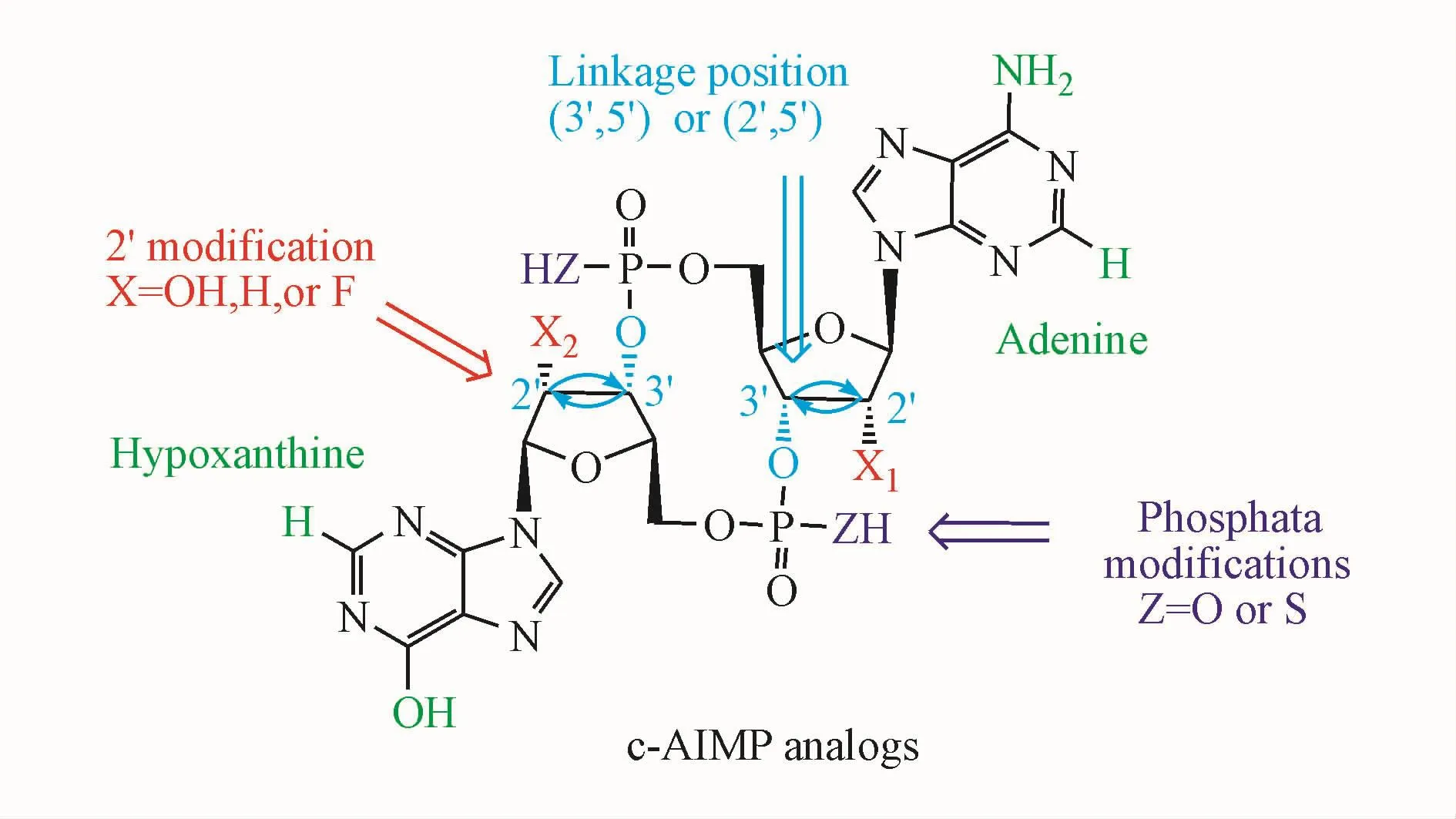
Figure 4 General structure of the cAIMP analogs
(1)核苷酸间的连接方式影响化合物的稳定性和产生Ⅰ型干扰素的活性。实验观测到2′,3′连接与3′,3′连接结合STING的能力相同,后者诱导产生Ⅰ型干扰素的活性更高。而cGAMP中2′,3′-cGAMP与 STING的结合力约为 3′,3′-cGAMP的300倍,这体现出cAIMP与cGAMP不同的构效关系。(2)五碳糖上2′位双脱氧取代能够提高或降低对酶的稳定性,取决于酶的特异性。2′位氟代导致产生Ⅰ型干扰素的活性明显提高,其中双氟代化合物的活性最强。(3)硫代磷酸酯修饰显著提高了这类CDNs的体外稳定性和活性,并在小鼠体内肿瘤模型中表现出优良的抗肿瘤免疫效能。与人源 STING激动剂 2′,3′-cGAMP相比,体外细胞试验表明这类激动剂中某些化合物诱导产生IFNs和NF-κB的能力更强,较之2′,3′-cGAMP对内切酶更加稳定。体内试验显示化合物 3′,3′-cAIMP的EC50为6.4μmol/L,其衍生物的 EC50为 0.4~4.7 μmol/L,较 2′,3′-cGAMP(EC50为 19.6μmol/L)显示出更好的活性。
综上所述,主要从3个方面来进行CDN类激动剂药物设计的考虑:第一,通过部分或全部取代2′,3′-cGAMP中不稳定的磷酸二酯键,增加化合物在人体内的稳定性,减少电荷对分子跨膜转运的影响;第二,用其他一些基团取代核糖上的自由羟基,避免化学合成中羟基的保护与脱保护、选择性差与难分离;第三,由于碱基是此类化合物与STING结合的重要作用位点,应考虑原有碱基能否被其他碱基或类似物替代等。
2.2 非CDN类小分子激动剂
虽然当前STING激动剂的开发聚焦于模拟内源性蛋白配体cGAMP上,但是对于新型结构的非CDN类STING小分子激动剂的探索研究也逐渐成为研究热点。基于STING蛋白结合环二核苷酸类化合物的高分辨率晶体结构的报道,采用合理药物设计,药物化学家们已经合成筛选出一些兼具体内外功效的新的分子实体。
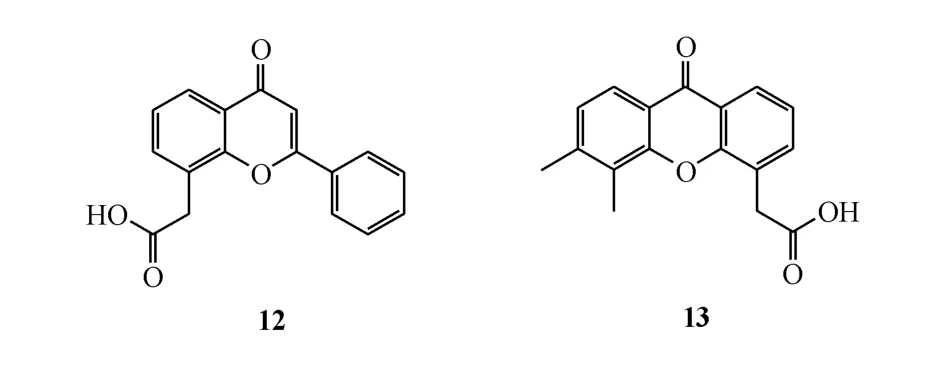
2.2.1 DMXAA 黄酮乙酸(FAA,化合物12)被证实通过破坏血管对小鼠结肠肿瘤有着显著的抑制活性。然而,随后的Ⅰ期临床试验的失败以及大鼠肿瘤模型中显示无活性,提示可能存在物种特异性[37]。为了获得可使肿瘤发生出血性坏死的类似药物,研究人员对FAA的分子结构进行进一步修饰,合成了一系列化合物,其中5,6-二甲基呫吨酮-4-乙酸(DMXAA,化合物13)的效果最好。DMXAA在不同的小鼠模型中显示抗肿瘤活性,同时也在大鼠的乳腺癌肿瘤模型中显示抗肿瘤活性[38]。然而,对其联合化疗用于治疗非小细胞肺癌的Ⅲ期临床试验宣告失败。对小鼠和人STING的结构-功能研究表明,DMXAA是鼠源 STING(mSTING)特异性激动剂,对人源STING并无激动效果,从而解释了用于人体治疗时的临床活性差异[39]。
2.2.2 氨基苯并咪唑类化合物 2018年11月,GSK公司的研究人员在Nature杂志上报道了一类新型结构的氨基苯并咪唑类激动剂(ABZIs)。研究人员运用高通量筛选方法得到一系列可以抑制3H-cGAMP与STING结合的小分子ABZIs类化合物。其中,代表化合物14在10μmol/L时的抑制率为(59±8)%,表观抑制常数 IC50约为(14±2)μmol/L。晶体结构分析表明,STING蛋白C端结构域(CTD)二聚体形成的口袋中结合了相邻的两个化合物14,每个小分子各自结合1个STING亚基。化合物14的N-1位上基团-CH(OH)-Ph虽落在结合口袋中,却与STING蛋白没有相互作用,因此研究人员将N-1位羟甲苯基替换成linker从而将2个ABZI连接成一个新的二聚分子,形成化合物15,其结合能力提升了近千倍。如图5所示,化合物15的1-乙基-3-甲基-1H-吡唑-5-甲酰胺部分结合在口袋的底部,吡唑氮部分与Ser162的羟基之间形成关键的氢键,羧酰胺部分与Thr263形成氢键,末端酰胺与Ser241形成2对H键网络,维持复合物的构象稳定。化合物16是在化合物15的基础上进一步优化而成,亲和力及细胞内效能进一步提高,EC50约为 130 nmol/L,是化合物 15的20多倍。小鼠实验中观察到化合物16激活了适应性免疫,产生持久的抗肿瘤效应并引起肿瘤消退[10]。
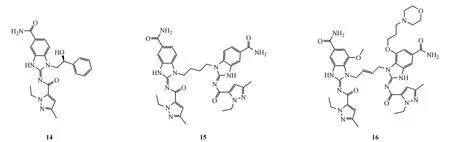
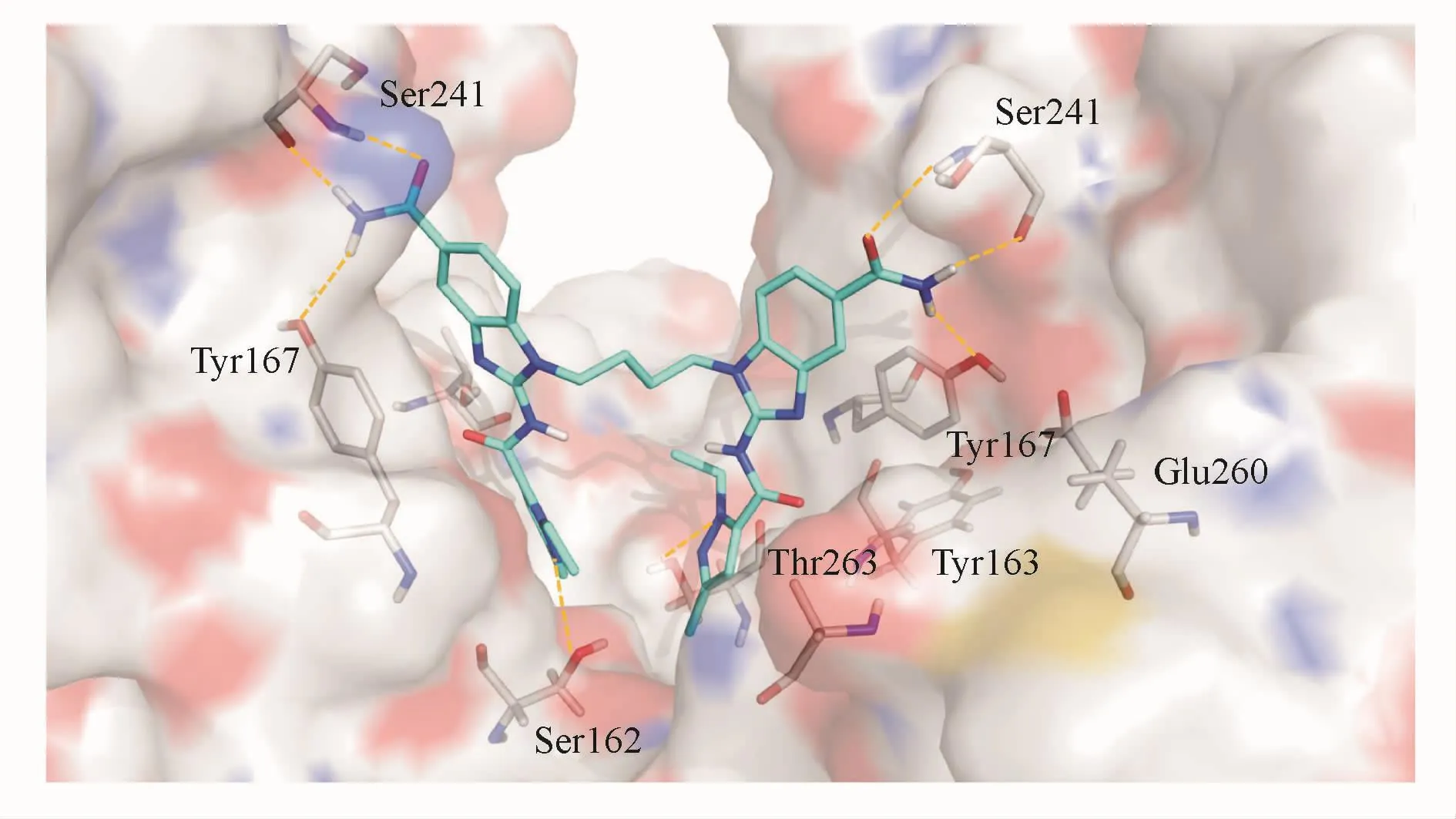
Figure 5 Close-up of diABZI compound 15 binding in the ligandbinding pocket of STING
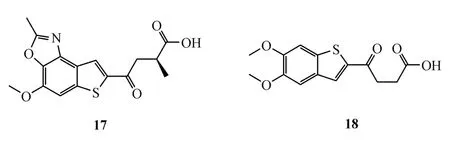
2.2.3 苯并噻吩类化合物 默沙东公司的研究人员报道了一类苯并噻吩结构型的STING激动剂,根据该公司公布的专利,体外测定显示在THP-1细胞中代表化合物 17的 EC50达到 531 nmol/L[40]。在MC-38细胞移植瘤雌性C57BL/6J小鼠体内实验中,化合物18与抗PD-1单克隆抗体mIgG1(鼠源免疫球蛋白G亚型1)联用时较单独使用mIgG1显著抑制肿瘤生长。该公司在专利中描述了将此类化合物与PD-1拮抗剂联用的策略,用于晚期转移性实体瘤和淋巴瘤患者治疗,目前已进行了Ⅰ期临床试验研究,但其结果尚未公布[41]。
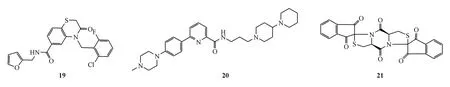
2.2.4 其他类化合物 此外,Sali等[42]利用高通量筛选鉴定出一种hSTING特异性激动剂G10(化合物19)。G10在人成纤维细胞中显示出诱导针对甲病毒的抗病毒反应,对基孔肯雅病毒(CHIKV)的抑制活性 IC90达到 8.01μmol/L,不过其体内生物活性和药理学性质有待确定。Kimura等[43]报道一个新的化合物SINCRO(化合物20),并发现该化合物除了激活STING外,还可以通过不依赖于STING的细胞毒作用发挥抗肿瘤效应,目前不确定SINCRO是否直接与STING蛋白作用。Liu等[44]使用高通量筛选的方法从16 000多个化合物中筛选出一个二螺二哌嗪结构的化合物(化合物21)。该化合物通过依赖于功能性人源STING的方式诱导细胞因子表达,对小鼠STING无激动效果。这一激动剂丰富了哌嗪类靶向STING在治疗病毒感染或肿瘤方面的应用。
3 总结及展望
与瓶颈,但是依然有可能成为免疫疗法的又一个新兴热点。
STING蛋白是目前较为新颖的药物靶点,在研药物及专利申请数目比较有限。虽然目前尚未完全了解STING的确切作用机制,但越来越多的证据表明,STING激动剂有望应用于肿瘤的免疫治疗。尽管如此,STING激动剂的研究仍存在着许多问题,例如:在肿瘤细胞死亡后宿主的APC细胞如何获得肿瘤来源的DNA尚不清楚;除了放射疗法外,激活STING通路在其他肿瘤疗法(如化疗)中,与激酶抑制剂联用中的功效作用仍有待确证。此外,关于STING通路的调控方面的研究还不够深入,已知负反馈机制的表征将有助于建立更准确的策略来调节STING信号通路用于治疗用途。总之,目前STING激动剂的研发虽然存在许多限制
