基于网络药理学的赤芍治疗动脉粥样硬化作用机制研究
2020-05-11王心意鞠建庆田园硕樊懿萱
王心意,鞠建庆,田园硕,樊懿萱,徐 浩
据《中国心血管报告2018》统计,以冠心病和脑卒中为代表的动脉硬化性心血管疾病(ASCVD)死亡人数占我国居民疾病死亡构成的40%以上,居各病因之首,以血管壁功能紊乱和粥样斑块为特征的动脉粥样硬化(atherosclerosis,AS)是ASCVD的病理基础[1]。中医药在防治AS中发挥着重要作用,其中清热活血中药赤芍(Paeoniae Rubra Radix)是具有抗AS作用的代表药物之一。赤芍为毛茛科植物芍药或川赤芍的干燥根。其味苦,性微寒,归肝经,《医学衷中参西录》记载:“化瘀血,赤者较优……为其能化毒热之瘀血不使溃脓也”[2]。现代研究表明,赤芍具有抗凝、抗血栓、抗氧化、抗炎、抗内毒素等多种药理学作用[3]。动物实验表明,赤芍对家兔实验性AS病灶具有明显的消退作用[4]。然而,其抗AS的药效物质基础和作用机制尚不清楚。网络药理学是新兴的药物研究模式,从整体角度探索药物与疾病之间的关联性,强调从“单靶标”向“网络靶标”研究模式转变[5]。本研究基于网络药理学,对赤芍治疗AS的活性成分和其信号通路进行预测分析,为进一步临床应用提供思路和依据。
1 资料与方法
1.1 赤芍活性化合物及靶标蛋白的筛选 利用中药系统药理学分析平台(TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)[6],以“chishao”为关键词检索赤芍中的化学成分,筛选出赤芍化合物中符合口服生物利用度 (OB)[7]≥30%和生物活性分子的类药性(DL)[8]≥0.18的化学成分作为活性成分。同样基于 TCMSP 平台,通过检索获得赤芍中活性成分所作用的靶标。
1.2 疾病靶点的筛选 通过GeneCards数据库(http://www.genecards.org/)、OMIM数据库 (http://www.ncbi.nlm.nih.gov/omim),以“atherosclerosis”为关键词检索已报道的与AS相关的基因,去除重复基因和假阳性基因。将获得的基因与赤芍有效成分作用的靶标进行比对取交集,得到赤芍治疗AS的作用靶点用于后续的研究。
1.3 蛋白相互作用网络构建与分析 为了进一步了解赤芍靶点和疾病靶点在蛋白水平上的作用机制,以STRING平台(https://string-db.org)构建蛋白互作网络(PPI)[9-10],获取蛋白互作关系。其中,物种设为“homo sapiens”(人类),最低相互作用阈值设为中等置信度0.4“medium confidence”,其余参数保持默认设置。以网络中的各靶基因的“节点连接度(Degree)”为指标,通过 Degree的测算筛选出网络中的核心蛋白质靶标。
1.4 作用靶点类型归属 DisGeNET数据库(http://www.disgenet.org/web/DisGeNET/menu)是包含与人类疾病相关的基因和变体最完整的数据库之一,可通过输入基因获得与该基因相关的疾病信息[11]。在该数据库中选择基因进行检索,依次输入赤芍治疗AS的作用靶点,获取作用靶点类型。
1.5 赤芍-活性成分-抗AS作用靶点网络构建 将筛选之后赤芍治疗AS的有效活性成分和作用靶点数据导入 Cytoscape 3.7.1 软件,构建赤芍-活性成分-抗AS作用靶点网络。Cytoscape的核心架构是网络,每个节点(node)是基因、蛋白质或分子,节点与节点之间的连接(edge)代表这些生物分子之间的相互作用,节点的度值(degree)代表网络中节点与节点相连的数目,度值越大,这个靶点越有可能成为化合物的关键作用靶点。
1.6 基因本体论(gene ontology,GO)和KEGG富集分析 将赤芍治疗AS的靶基因导入Metascape数据库(http://metascape.org)进行基因富集分析。Metascape是一种有效且高效的工具,旨在提供全面的基因列表注释和分析资源[12]。以P<0.01作为差异具有统计学意义的筛选条件,设置min overlap=3,Min Enrichment=1.5,对获取的靶点进行GO富集分析和KEGG通路富集分析。
2 结 果
2.1 赤芍活性成分筛选及候选化合物靶点预测 经过TCMSP平台检索,获得赤芍的化合物119个。设定OB≥30% 和 DL≥0.18,筛选出活性化合物29个,基本信息见表1。将这些活性化合物在TCMSP数据库平台逐一进行比对,得到了这些活性化合物作用的靶点共41个。
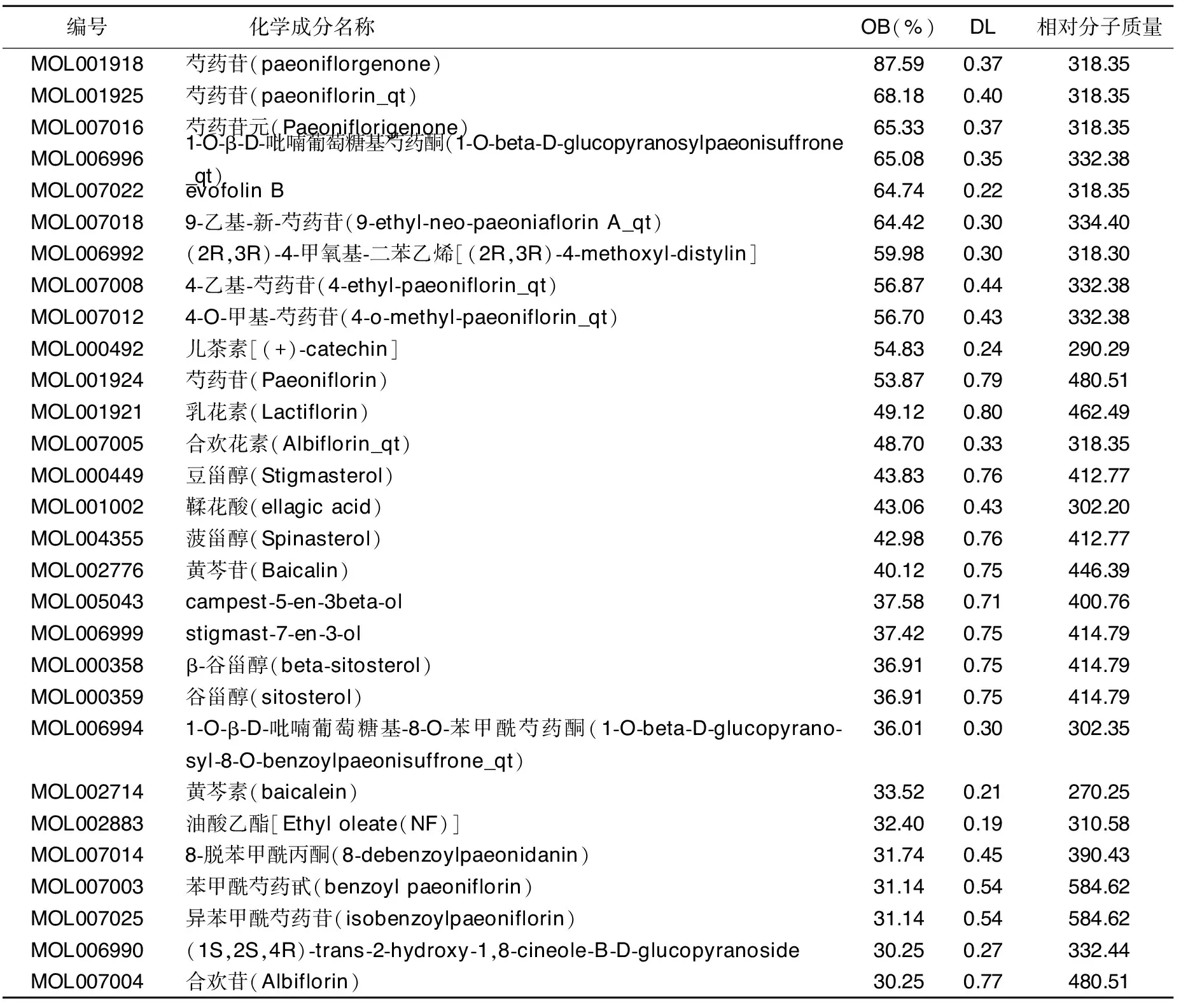
表1 赤芍中29个活性化合物的基本信息
2.2 AS疾病靶点收集 基于GeneCards与OMIM数据库共收集AS相关靶点基因,挖掘并删除重复靶点,共收集到AS疾病相关靶点3 812个。将上述筛选出来的中药中具有潜在作用的靶点基因和疾病靶点基因进行匹配映射并在线绘制韦恩图,获得共同靶点基因36个。详见图1。
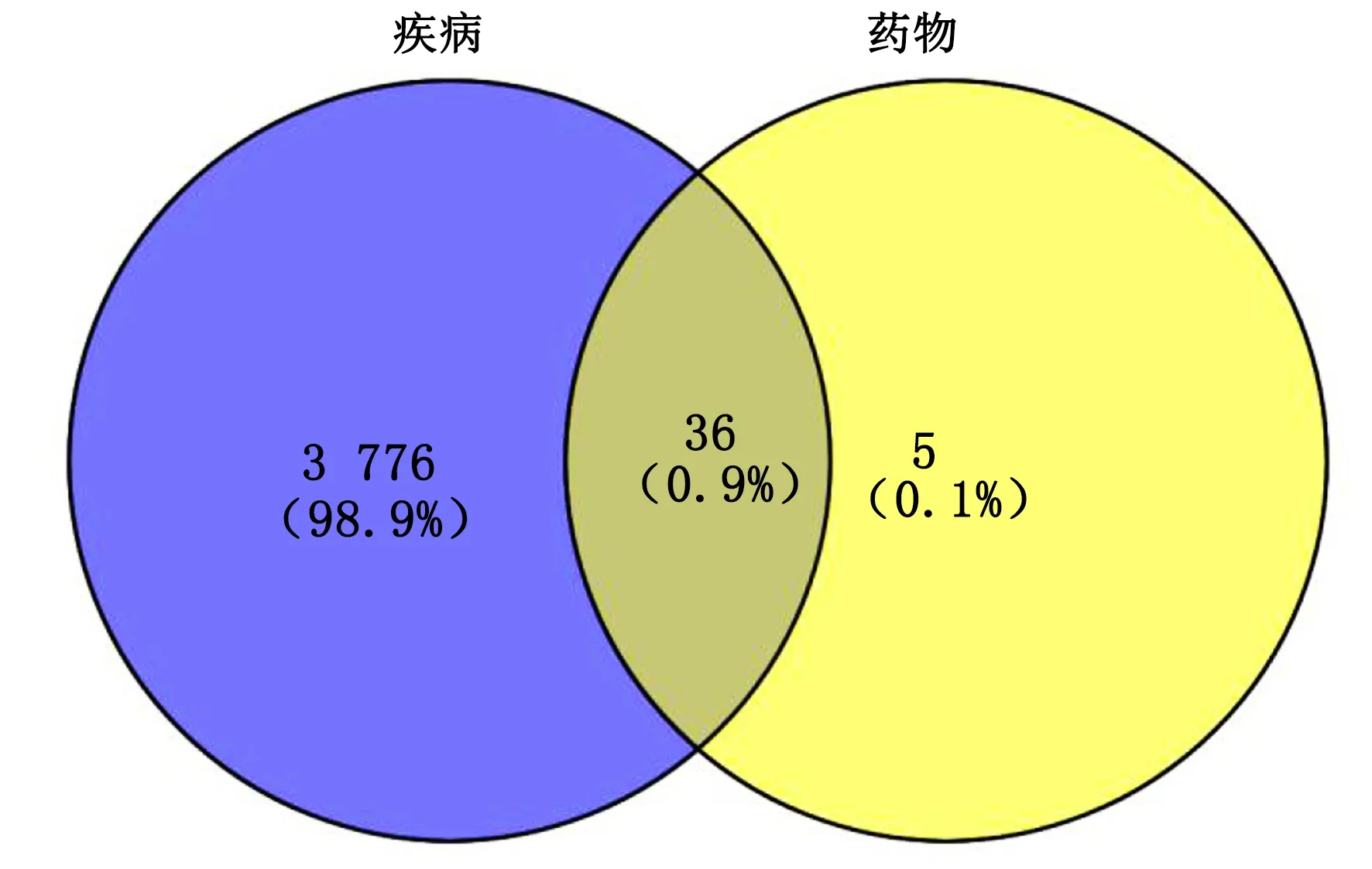
图1 赤芍活性成分-抗AS作用靶点韦恩图
2.3 赤芍靶点PPI网络的构建与分析 将属于赤芍的36个靶点在STRING平台构建PPI网络模型,见图2。并将得到的交集靶点信息进行基因名和Uniprot ID的标准化,具体信息见表2。图2包含36个节点(其中隐藏2个游离节点)、157条边,平均Degree为8.72。分别计算网络图中每个靶点的Degree,采用R包“ggplot2”绘制了Degree最大的前30个靶点的柱状图,见图3。得到14个重要的AS相关蛋白质靶点,分别为IL6、ESR1、VEGFA、FOS、CASP3、AR、RELA、CYCS、PGR、HIF1A、CASP8、CASP9、AHR、CCNB1等基因(Degree≥10)。
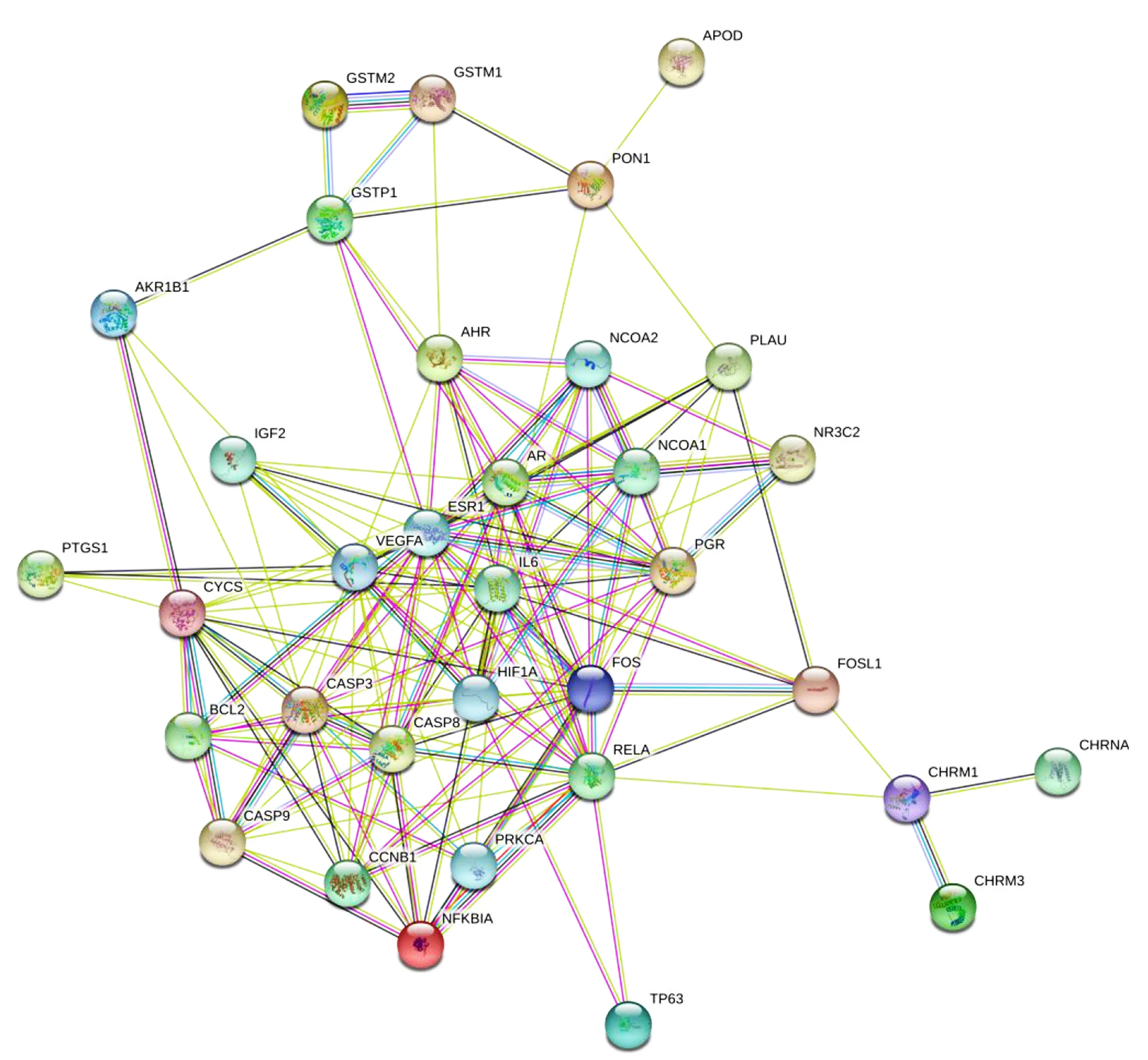
图2 AS与赤芍共有PPI网络
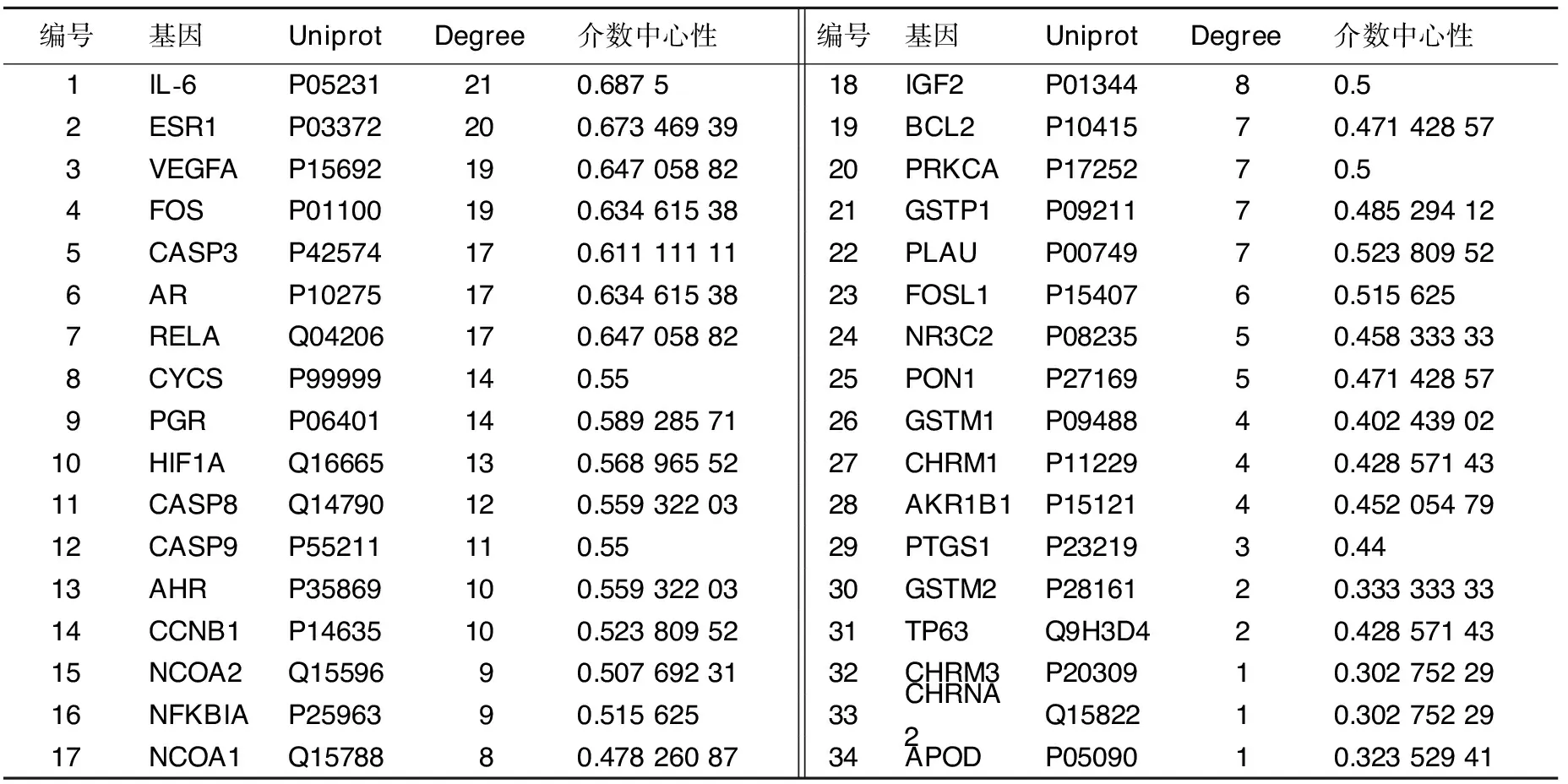
表2 赤芍抗AS作用靶点
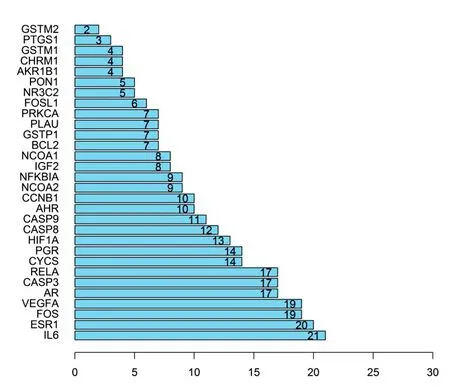
图3 PPI网络中的节点
2.4 作用靶点类型归属 将34个作用靶点依次导入DisGeNET数据库,获得相应的蛋白类型,见表3。结果表明,赤芍治疗AS过程中涉及信号分子、转录因子、酶(氧化还原酶、水解酶、蛋白酶、激酶、转移酶)、酶调节剂、受体等物质。
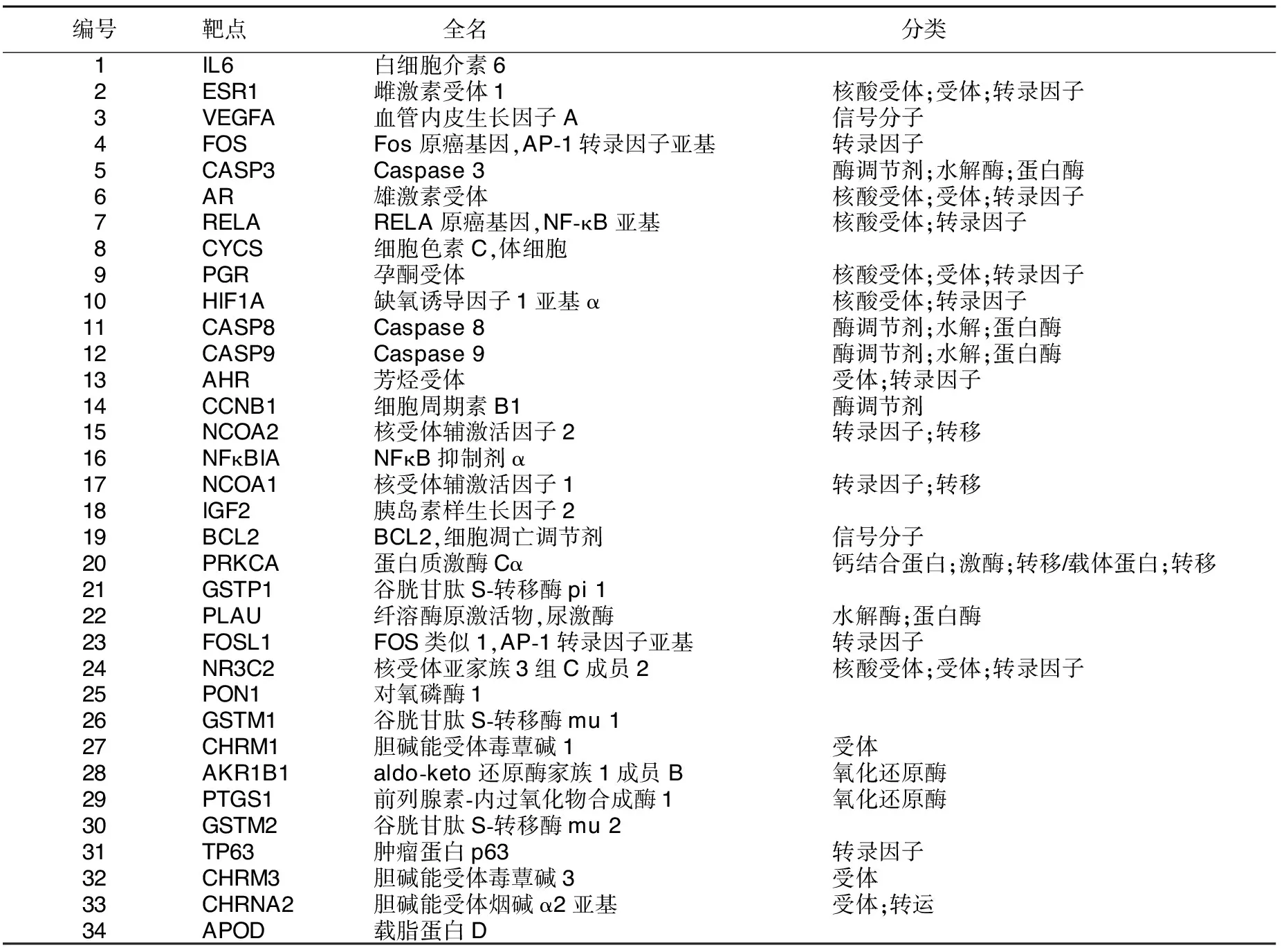
表3 赤芍活性成分治疗AS作用靶点分类
2.5 中药-活性成分-作用靶点网络的构建 通过Cytoscape 3.7.1软件建立赤芍-活性成分-抗AS靶点网络图,见图4。共有50个节点(1个疾病节点,1个药物节点,12个化合物节点、36个基因节点)和113条边,其中12个绿色节点代表了赤芍的活性成分,36个蓝色节点代表了抗AS靶点,113条边代表了化学成分与AS靶点的相互作用。该网络中,每个化合物平均与5.42个靶点相互作用,每个靶点平均与1.81个化合物相互作用,因此,赤芍的活性成分中存在1个化合物与多个靶点之间的相互作用,同时也存在不同化合物共同作用于同一个靶点的现象,这体现了中药多成分与多靶点之间共同作用的机制。结果表明,赤芍的29个潜在活性成分中,与作用靶点直接相连的成分有12个,为赤芍治疗AS的活性成分。包括黄芩素、β-谷甾醇、鞣花酸、豆甾醇、(+)-儿茶素、Spinasterol、谷甾醇、(2R,3R)-4-methoxyl-distylin、campest-5-en-3beta-ol、油酸乙酯、stigmast-7-en-3-ol、芍药苷。
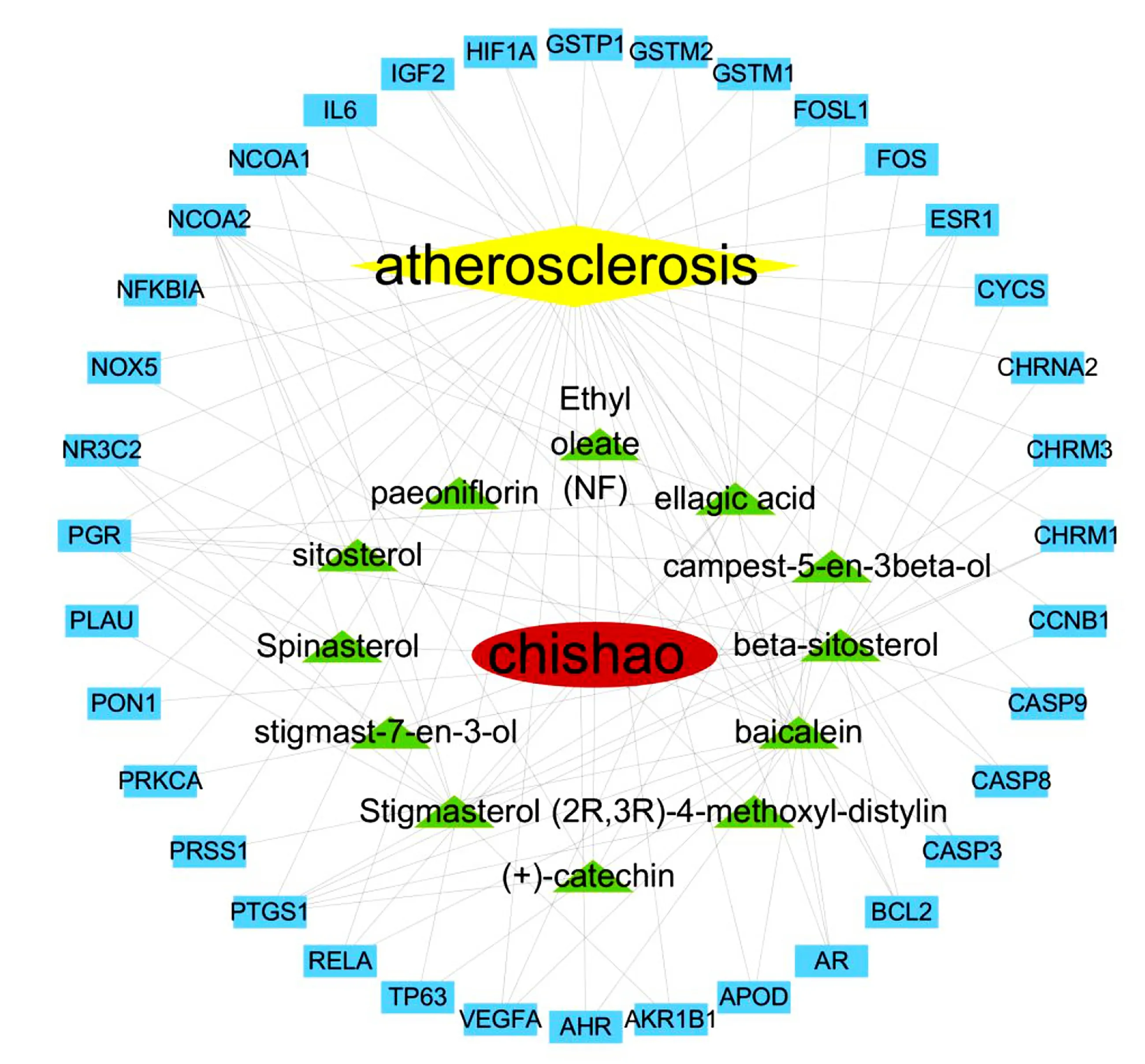
图4 赤芍-活性成分-抗AS靶点网络图
2.6 GO和KEGG富集分析 Metascape中GO功能富集分析得到 GO 条目146个(P<0.05),其中生物过程(biological process,BP)条目73个,分子功能(cellular component,CC)条目15个,细胞组成(molecular function,MF)相关的条目58个。详见图5。GO富集分析结果显示,生物过程主要包括对类固醇激素的反应、对有毒物质的反应、细胞对脂质的反应、细胞对有机环状化合物的反应、细胞对激素刺激的反应;细胞成分主要包括核染色质、核染色体部分、核染色体、染色质、质膜蛋白复合物、细胞溶质部分突触前膜、转录因子复合物等;分子功能主要包括转录因子结合、RNA聚合酶Ⅱ近端启动子序列特异性DNA结合、近端启动子序列特异性DNA结合、RNA聚合酶Ⅱ调节区DNA结合、DNA结合转录激活活性,RNA聚合酶Ⅱ特异性、参与凋亡信号通路的半胱氨酸型内肽酶活性等,涉及细胞信号转导等途径。KEGG信号通路富集中靶点数量前20的信号通路主要包括细胞凋亡、白介素-17(IL-17)信号通路、流体剪切应力(FSS)与AS、缺氧诱导因子-1(HIF-1)信号通路、Th17细胞分化、肿瘤坏死因子(TNF)信号通路、甲状腺激素信号通路、p53信号通路、Toll样受体(TLR4)信号通路、磷酸肌醇3-激酶(PI3K)-Akt信号通路等。详见图6。
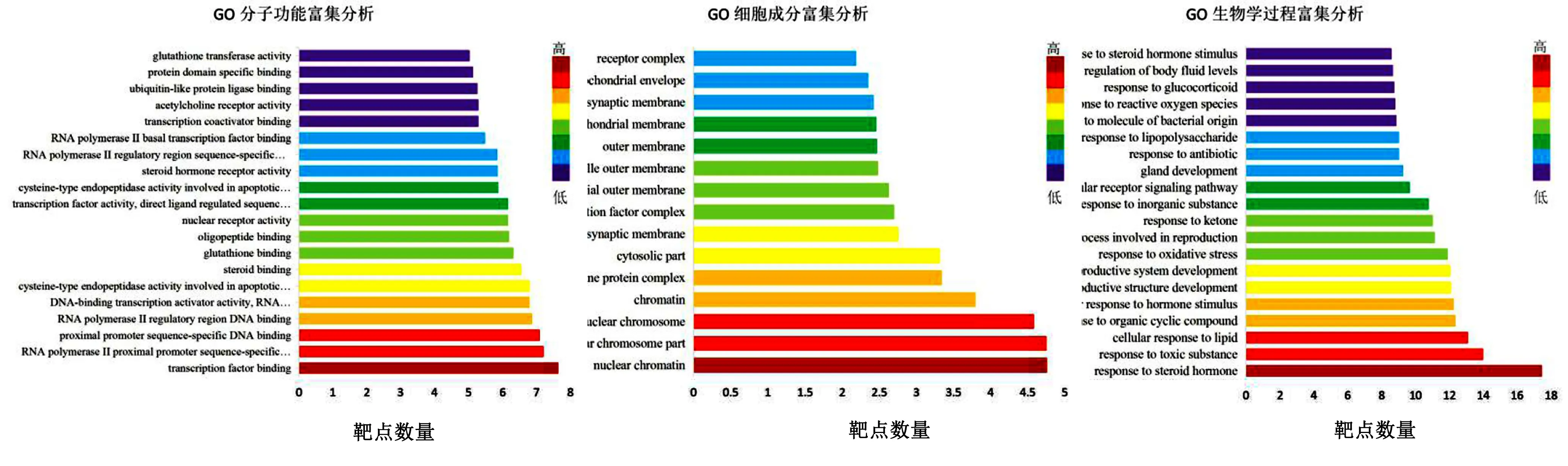
图5 赤芍抗AS靶点的GO分析
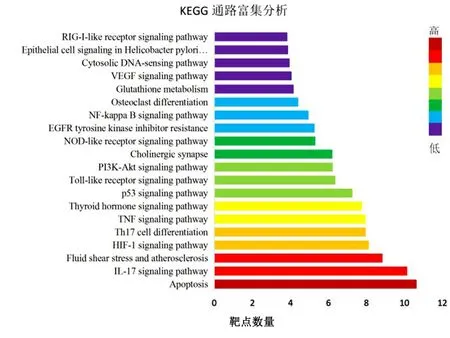
图6 赤芍靶点的KEGG通路富集分析
3 讨 论
根据专家共识,AS的主要证候包括痰瘀互结证、气阴两虚证、气虚血瘀证和气滞血瘀证[13]。赤芍具有清热凉血、散瘀镇痛之功效,是治疗AS有潜力的药物。通过网络药理学的研究,有助于系统全面阐释赤芍治疗AS的作用机制,为临床治疗AS提供新的思路。
本研究通过构建成分-靶点网络得到赤芍中12个活性成分,且部分成分的有效性已被证实。有研究表明,芍药苷抑制β抑制蛋白2抗体的表达,改善G蛋白偶联受体信号转导的过度脱敏,从而降低炎症因子水平[14]。黄芩素可以明显降低组织中丙二醛(MDA)的含量,提高超氧化物歧化酶(SOD)活性,从而降低高脂血症性脂肪肝大鼠血清总胆固醇(TC)、三酰甘油(TG)水平[15]。此外,黄芩素可以通过降低氧化应激、炎症反应对心肌细胞起到保护作用[16]。β-谷甾醇可降低高血脂大鼠血清TC、TG,抑制脂质过氧化,起到预防AS的作用[17]。鞣花酸通过对氧磷酸内酯酶防止低密度脂蛋白胆固醇(LDL-C)过氧化及抑制高脂饮食大鼠的摄食量,防止AS[18-19]。豆甾醇具有强大的抗氧化、降血脂、抗炎、抗肿瘤、降血糖及甲状腺抑制等作用[20]。儿茶素可以抗AS,与其降脂、抗氧化有关[21]。本研究通过匹配中药靶点与疾病靶点,获得赤芍治疗AS的36个靶点基因。蛋白质相互作用网络分析显示,Degree≥10的节点包括IL6、ESR1、VEGFA、FOS、CASP3、AR、RELA、CYCS、PGR、HIF1A、CASP8、CASP9、AHR、CCNB1。动物实验表明,IL6促进早期AS病变的发展[22]。ESR1是雌激素对脉管系统的AS具有保护作用的重要介质。一项回顾性研究提示,ESR1基因变异可能与AS风险增高有关[23]。有研究发现,小鼠AS斑块中血管VEGFA表达与新血管形成显著减少有关,提示VEGFA具有抗AS作用[24]。FOS基因被认为是AS进展和严重程度的因素之一,且新发现认为其是冠状动脉疾病中烟草发挥毒性的新途径[25]。Caspase 3、Caspase 8、Caspase 9是凋亡蛋白酶,在AS斑块中表达[26]。Liu等[27]发现AR在相对早期AS中占有重要地位,而减少AR的表达与更广泛的AS相关。Akhta等[28]发现内皮细胞缺氧诱导因子-1α(HIF-1α)通过触发miR-19a介导的CXCL1表达和单核细胞黏附促进AS,并提出抑制内皮HIF-1α/miR-19a途径可能是抗AS的治疗选择。Wu等[29]研究表明,AHR的激活可以诱导血管炎症并促进Apo-E小鼠AS形成。RELA、CYCS、PGR、CCNB1等与AS的相关性研究尚少。
富集分析和靶点归属分析结果表明,赤芍抗AS涉及细胞过程、代谢过程等多个生物过程,有信号分子、转录因子、受体、蛋白和酶、酶调节剂、受体等多种物质参与,过程较复杂。KEGG分析显示以上成分作用的靶标显著富集于细胞凋亡、IL-17信号通路、FSS与AS、HIF-1信号通路、Th17细胞分化、TNF信号通路、甲状腺激素信号通路、p53信号通路、TLR4信号通路、PI3K-Akt信号通路等多个通路。目前有较多证据表明,细胞凋亡,尤其是巨噬细胞凋亡,发生在AS的各个阶段[30]。有研究证实,选择性抑制PI3K-Akt信号通路能诱导巨噬细胞自噬,减少斑块巨噬细胞的浸润,抑制炎症反应从而稳定AS易损斑块[31]。而PI3K-Akt能直接或间接地影响p53等抑癌基因的表达从而调控细胞存活[32]。Th17由CD4T淋巴细胞分化而来,主要分泌IL-17。随着AS方面研究的深入,IL-17和Th17都被发现与AS的发生发展密切相关,但二者在疾病发展和斑块稳定性中作用的结果尚无一致定论[33-34]。既往认为白细胞介素-17A(IL-17A)会促AS形成[35]。但近年来有研究得出相反的结论,认为IL-17A表达缺陷可促进粥样斑块进展[36]。FSS由于其脉动的性质和血液流动,其数值并不稳定。有研究发现频率谐波的剧烈变化可促使AS的发生,表明内皮细胞能够感知和响应FSS的变化[37]。HIF-1是异二聚体蛋白,是低氧环境中细胞反应的主要调节因子之一,通过作用于内皮细胞、血管平滑肌细胞和巨噬细胞的细胞特异性反应在AS的发展中起关键作用。有研究提出通过HIF-1表达/活化的信号通路可以对治疗AS发挥巨大作用[38]。肿瘤坏死因子-α(TNF-α)是一种炎症标志物,由单核巨噬细胞分泌。有研究表明,TNF-α能通过刺激血管平滑肌细胞的迁移,促进内皮细胞表达黏附因子、炎症因子,促进AS的发生与发展[39-40]。马淑慧[41]通过分子机制研究,发现赤芍主要成分芍药苷对血管内皮细胞肿瘤坏死因子受体1(TNFR1)的介导信号的抑制作用是赤芍发挥活血化瘀、抗AS的重要作用机制之一,这个发现与本研究得出的结果也一致。目前甲状腺激素与AS相关性尚未明确,相关研究提示,促甲状腺激素可能是AS的独立危险因素[42]。Michelsen等[43]证实了TLR4的遗传缺陷与ApoE-/-小鼠的主动脉斑块面积减少有关,表明TLR4信号传导与AS有密切联系。
4 小 结
本研究基于网络药理学分析赤芍抗AS的作用机制,赤芍通过调控相应的细胞凋亡、IL-17信号通路、FSS与AS、HIF-1信号通路等发挥治疗作用。本研究相关通路的分析与文献报道基本一致,表明活性成分与靶点的可靠性。因此,赤芍中12个活性成分通过调控34个靶点,共同发挥抗AS的作用,体现了赤芍多成分、多靶点、多途径治疗的特点,采用网络药理学的方法也体现了中医药的整体观与系统性,为中医药治疗多因素导致的复杂疾病提供了新的途径。
