NVP-AUY922对肝癌细胞HepG2放射增敏的研究
2020-05-08张豪
张豪
(温州市中心医院,浙江 温州325000)
热休克蛋白90(HSP90)是一种分子伴侣,参与多种细胞功能和信号通路,并参与细胞的增殖、分化和凋亡[1]。有证据表明,HSP90的异常激活可促进癌症的发展,并与肿瘤的侵袭、远处转移和免疫逃逸等恶性发展过程有关[2]。据报道,抑制HSP90能增强抗癌药物诱导的侵袭性肿瘤细胞凋亡[3]。相关研究[4]为抑制HSP90作为肝细胞癌(HCC)的抗癌靶标提供了理论依据,但抑制HSP90与放射的联合作用尚不明确。NVP-AUY922(AUY922)属于间苯二酚异恶唑类似物,是HSP90有效的合成小分子抑制剂之一[4]。单一药物AUY922具有抗多种肿瘤(包括甲状腺癌、胃癌、胰腺癌、肺癌、乳腺癌和结肠癌等)的作用[5-6]。体外实验发现,AUY922具有放射增敏剂的作用[7],本研究探讨 HSP90抑制剂AUY922对肝癌细胞系HepG2的放射增敏作用及机制,报道如下。
1 材料与方法
1.1 材料与试剂 肝癌细胞系HepG2(中国科学院上海细胞库)、10%胎牛血清(FBS)和1%青霉素-链霉素的Dulbecco改良Eagle培养基(DMEM,美国 Gibco 公司)、AUY922(Novartis诺华公司)溶解于二甲基亚砜(DMSO,Sigma 公司)、Annexin VFITC、碘化丙啶(PI)细胞周期与细胞凋亡检测试剂盒(上海碧云天生物技术公司)、流式细胞仪(美国BECK-COULTER公司)、酶标仪(美国 BIO-RAD公司)。
1.2 方法
1.2.1 细胞培养与分组 肝癌细胞系HepG2于添加了10% FBS和1%青霉素-链霉素的 DMEM培养基37℃、5% CO2加湿的培养箱中孵育培养,以70%~80%的融合率传代培养,实验都在指数生长期的细胞中进行。细胞照射采用医科达直线加速器,射线能量为6MV,照射野面积20cm×20cm,源皮距100cm,剂量率为400cGy/min。将细胞分为对照组(DMSO 处理)、AUY922 组(IC20 浓度)、照射组(剂量照射6Gy)及AUY922+照射组(先用IC20浓度的AUY922处理24小时后用6Gy剂量照射)。
1.2.2 细胞毒性检测 文献[8]所述用细胞计数试剂盒(CCK-8)检测AUY922对HepG2的细胞毒性,计算IC20(20%药物抑制浓度)。HepG2细胞经胰蛋白酶消化后接种于96孔板中,设置 1、5、10、50和100nM浓度梯度处理AUY922细胞,以仅加入培养液进行对照。作用48小时后,每孔加入10μL含CCK-8工作液的无血清培养基,5% CO2、37℃孵育1小时,用酶标仪测450nm处的吸光度值。细胞增殖抑制率=(1-药物组吸光度值/对照组吸光度值)×100%,以IC20时的药物浓度作为后续实验的药物作用浓度。
1.2.3 放射增敏检测 计数处于指数生长期的HepG2细胞,并铺在10cm的培养皿中培养24小时细胞贴壁后添加AUY922继续培养24小时,以0、2、4、6、8Gy 的剂量对照射细胞,24 小时后通过新鲜添加生长培养基除去药物,随后每7天补充1次。14天后甲醇/乙酸(3:1)固定,结晶紫染色,在倒置相显微镜下对克隆计数,克隆定义为包含至少50个细胞。集落形成率(PE)%=克隆数/接种细胞;细胞存活分数(SF)%=各照射剂量PE/未照射PE×100%,采用SPSS统计软件的多靶单击模型(SF=1-(1-e-D/D0)N)拟合细胞存活曲线,得出平均致死剂量(D0)、准阈剂量(Dq),计算放射增敏比(SER)=单纯照射的Dq值/对照加药的Dq值。
1.2.4 细胞凋亡检测和细胞周期分析 HepG2细胞以每孔3×105个细胞的密度接种在6孔板中,贴壁生长24小时后将细胞按上述四组处理。(1)分离细胞,在PBS溶液中重悬,离心去除上清液,加入FITC Annexin V(5μL 储备液/100μL 缓冲液)4℃避光孵育15分钟加入PI(100ng/100μL缓冲液)轻轻混匀,4℃避光孵育5分钟,流式细胞仪检测细胞的凋亡。(2)细胞经PBS重悬、70%预冷的无水乙醇5mL混匀并置4℃环境中固定24小时,离心取细胞,经PBS洗涤并打散细胞团后用20μg/mL RNase-A溶液在37℃避光温浴30分钟,去除RNA,加入10μg/mL PI在37℃下处理2小时。采用流式细胞仪分析细胞周期。
1.2.5 标记物γ-H2AX的检测 接种细胞在聚-L-赖氨酸(13.3 mg/mL)包被的的载玻片上,并在37°C,5% CO2温育24小时,4%多聚甲醛的磷酸盐缓冲盐水(PBS)固定15分钟。用PBS洗涤后将细胞用0.5% Triton X-100透化10分钟。然后用含3%牛血清白蛋白(BSA)的PBS封闭30分钟,加入一抗 γ-H2AX(1∶250)4℃过夜,用 PBS 洗涤后与Alexa Flour 488 偶联的二抗(1:300,Molecular Probes)在室温下孵育1小时。将细胞在PBS中洗涤,盖玻片用 4′,6-二脒基-2-苯基吲哚(DAPI)染色。 使用荧光共聚焦显微镜捕获荧光图像。
1.3 统计学处理 使用SPSS 20.0统计学软件处理数据,计量资料以(±s)表示,采用单因素方差分析。
2 结果
2.1 细胞毒性作用 1、5、10、50、100nM 不同浓度AUY922作用于HepG2细胞48小时后的细胞抑制率分别为(5.61±1.45)%、(17.60±2.31)%、(27.36±3.56)%、(52.68±4.33)%、(69.00±4.23)%,提示抑制率呈药物浓度依赖性;IC50为 49.3nM,IC20为6.3nM,将6.3nM作为后续实验的药物浓度。
2.2 放射增敏作用 克隆存活曲线如图1所示,照射组和 AUY922+照射组 D0、Dq分别为 2.18、1.42和1.96、1.19,由Dq所得的SER为1.65。

图1 AUY922对肝癌细胞放射增敏结果
2.3 细胞凋亡和周期 与对照组相比,AUY922组和照射组细胞凋亡增加,而AUY922+照射组的凋亡细胞率较其他三组增加,差异均有统计学意义(P<0.05)。详见图 2、表 1。与对照组相比,AUY922+照射组HepG2细胞在G2/M期表现出相对阻滞,差异具有统计学意义(P<0.05)。详见图3、表1。
表1 各组肝癌细胞凋亡率和细胞周期比较(±s)

表1 各组肝癌细胞凋亡率和细胞周期比较(±s)
与对照组比较*P<0.05;与AUY922+照射组比较#P<0.05
细胞周期组别G 0/G 1 S G 2/M对照组 2.4 4±0.9 5 4 9.5 7±7.2 9 3 3.3 3±3.2 0 1 8.0 3±1.2 5 A U Y 9 2 2 组 1 5.4 1±2.2 1*#4 2.4 7±4.0 1 2 3.0 7±2.9 0 3 3.9 0±2.2 0*#照射组 1 1.9 2±2.3 6*#5 8.4 7±5.6 0 1 3.4 7±5.2 6 2 7.2 0±2.2 1*#A U Y 9 2 2+照射组 3 6.3 7±1.6 7*4 0.8 7±4.2 5 1 1.4 0±4.1 0 4 2.6 3±2.3 5*细胞凋亡率(%)

图2 各组肝癌细胞凋亡情况

图3 各组细胞周期
2.4 双链断裂修复DSB的标记物γ-H2AX 对照组和AUY922组的细胞显示出较低的DSB水平,与其他三组相比,AUY922+照射组细胞系在30分钟和24小时都显示出更高比例的γ-H2AX灶的细胞。详见图4。
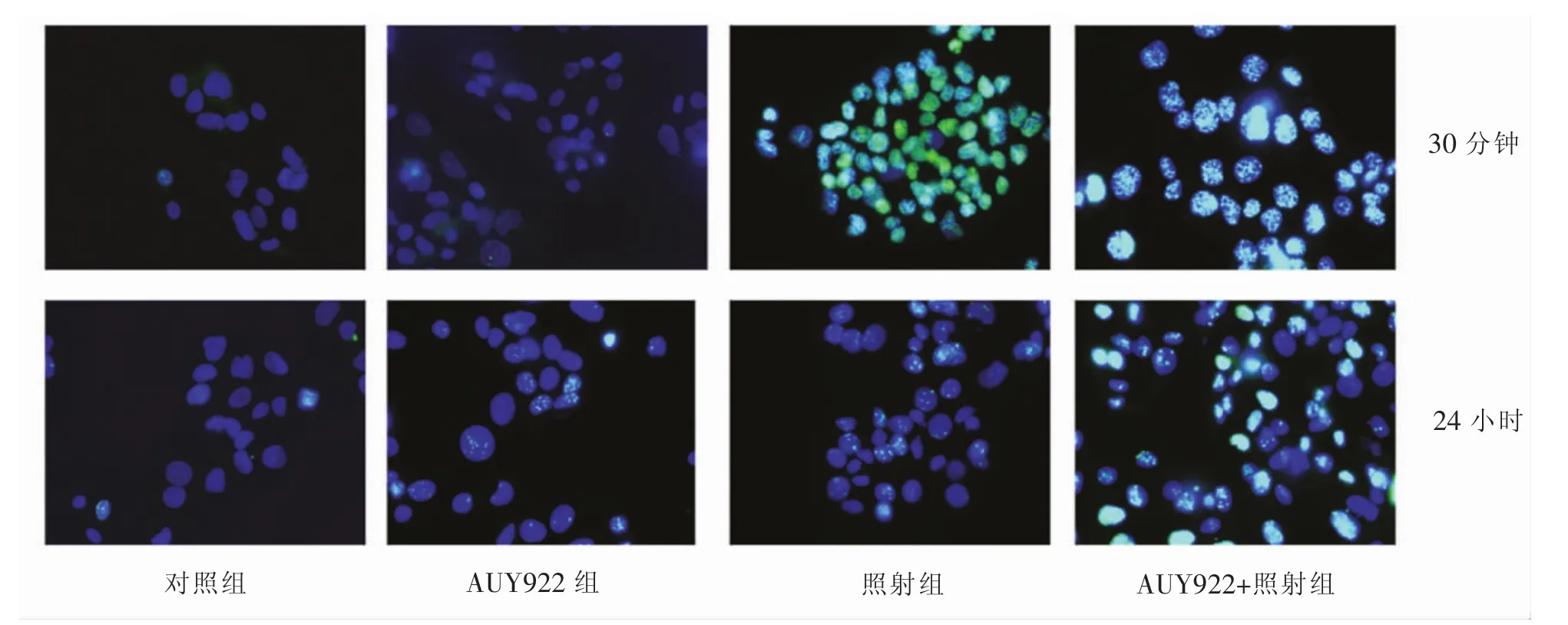
图4 各组不同时间免疫荧光下观察γ-H2AX的形成
3 讨论
肝癌组织中HSP90的表达明显高于周围组织,表明HSP90的高表达可能参与了肝癌的发生过程,抑制HSP90可能是治疗肝细胞癌的一种有效策略[9]。多项研究表明,AUY922是有效的第三代HSP90抑制剂,在多种人类癌细胞中具有抗肿瘤活性。根据先前的报道,AUY922可以抑制各种类型肿瘤细胞的增殖,对肿瘤细胞具有毒性[4-5,10],本研究显示,AUY922以浓度依赖的方式抑制HepG2细胞增殖。最近还证实了HSP90抑制剂对肺癌、胃癌和口咽鳞状细胞癌的放射增敏潜力[7,11]。本研究提示,使用HSP90抑制剂会降低HCC细胞系的克隆形成存活率,且对HCC细胞具有放射增敏作用。肝癌的一个重要特征是肿瘤可局部控制,如肝癌的放射治疗[12]。然而HCC对常规分次放射具有相对的抵抗性,且受到正常肝组织毒性的限制[13]。因此,选择性地增加肝癌细胞放射剂量是重要的研究领域。新一代HSP90抑制剂AUY922显示出较强的放射增敏活性。
细胞凋亡与消除潜在的恶性细胞、增生和肿瘤进展有密切联系。因此,促进细胞凋亡在抗癌作用中起着至关重要的作用。据报道,AUY922可诱导癌细胞凋亡[4],本研究中HSP90抑制剂的治疗使细胞凋亡增加。为了进一步探讨AUY922诱导的放射致敏作用机制,本文观察其对细胞周期的治疗作用,结果表明,G2/M期细胞比例增加,与其他类型的癌症研究一致[11],这些研究表明,仅用AUY922治疗即可导致癌细胞停滞在G2/M期,可能解释了本研究出现放射增敏作用的原因与AUY922诱导肝癌细胞进入放射更敏感的G2/M期阶段有关[11],推测这些细胞可以表现出更高水平的辐射,诱发DNA损伤。DNA是放射治疗杀伤肿瘤细胞的主要靶标,放射治疗通过断裂DNA双链(DSB)发挥其抗癌作用,是最具毒性的DNA损伤之一,γ-H2AX是其主要的生物学标志物。本文采用免疫荧光观察γ-H2AX灶形成指示DSB,结果提示,HSP90抑制剂诱导的放射增敏作用机制可能包括抑制DSB。同样,Zaidi等[14]研究发现,HSP90抑制剂通过抑制DNA修复发挥放射增敏作用。
本研究证实HSP90抑制剂使肝癌细胞进入放射敏感性周期G/2M期并抑制其DNA修复,从而导致肝癌细胞系的强放射增敏作用,提示当HSP90抑制剂与放射治疗策略性结合时,可以为肝癌的治疗提供新的思路。
