长链非编码RNA UCA1对CCND2的调控作用和对胃癌细胞增殖能力的研究
2020-05-08钟定福胡丽瑜陈丹聂颖张红英
钟定福,胡丽瑜,陈丹,聂颖,张红英
(金华市人民医院,浙江 金华321000)
近年来,研究发现长链非编码RNA UCA1在多种肿瘤中表达异常,可作为肿瘤标记物或干预靶点[1]。UCA1在胃癌中异常表达且是临床预后的独立预测因子[2-3],但具体机制尚不明确。有研究发现,UCA1可作为miR-204海绵吸附分子,通过竞争抑制miR-204重激活其靶基因,促进肿瘤细胞恶性增殖、转移等[4-6]。本文拟对UCA1调控miR-204在胃癌细胞增殖中的作用进行研究,报道如下。
1 材料与方法
1.1 材料 (1)胃癌组织。选择本院2016年6月-2019年6月经手术及病理确诊的10例胃癌组织标本及癌旁组织,患者术前均未行化疗或放疗。(2)胃癌细胞株。MNK-45及SGC-7901购于美国标准细胞培养库ATCC。细胞株贴壁培养于含10%胎牛血清(美国 GIBCO 公司, 货号:G10099141)、100U/mL 青霉素及 100μg/mL链霉素(美国 Hyclone公司,货号:SV30010)的DMEM培养液(美国Hyclone公司,货号:SH30022.01B)。 (3)脂质体转染试剂Lipofectamine 3000(美国Invitrogen公司,货号:L3000015)。 (4)CCK-8 细胞增殖试剂盒(上海翊圣生物科技有限公司,货号:40203ES76)。 (5)采用Trizol试剂(Invitrogen 公司,货号:15596-026)提取细胞总RNA,RNA逆转录cDNA及实时荧光定量PCR。(6)采用 TB Green®Premix TaqTMII(TliRNaseHPlus)(大连宝生物,货号:RR820A)进行基因表达测定。 (7)miR-204在细胞内的表达含量采用逆转录试剂盒TaqManTMMicroRNA Reverse Transcription Kit(Applied Biosystems LifeTechnologies公司,货号:4366596),TaqManTMUniversalMasterMixII, withUNG (货号:4440044)及miR-204 探针(Assay ID:000508)和 U6 Taqman 探针(AssayID:000425)。 (8)一抗购自美国 CST 公司:Ki-67(货号:9449)、PCNA(货号:13110)、CyclinD1(货号:2978)、CyclinD2(货号:3741)、β-actin(货号:3700)。 (9)Luciferase荧光素报告系统采用双荧光素试剂盒(Promega公司,货号:E6110)。 (10)RIP 检测试剂盒(广州 BersinBio公司,货号:Bes5101)。
1.2 方法
1.2.1 分组 设立两个转染组分析UCA1的生物学活性,分别为siRNA对照组和siUCA1敲减组,即转染UCA1干扰siRNA,选择敲减效率较高者进行后续敲减实验。设立4组转染组观察UCA1对miR-204活性的影响:(1)对照组:阴性miRNA模拟物对照+空载 pcDNA3.1 载体;(2)miR-204 过表达组:miR-204模拟物 (mimics)+空载 pcDNA3.1 载体;(3)UCA1 过表达组:UCA1过表达载体+阴性miRNA模拟物对照;(4)联合组:miR-204mimics+UCA1 过表达载体。
1.2.2 miRNA 模拟物(mimics)、siRNA、过表达载体构建及转染 miR-204 mimics及对照mimics、UCA1 siRNA(siUCA1-1,siUCA1-2 及对照 siRNA)均由上海吉玛基因有限公司提供,其中UCA1的2条 siRNA靶序列分别为:siUCA1-1:GCCATATGAAGACACCCTA 和 siUCA1-2:TTAATCCAGGAGACAAAGA。UCA1及CCND2的cDNA合成及克隆至pcDNA3.1(+)中,将野生型及突变型CCND2的3’UTR克隆至psiCHECK-2荧光素报告质粒中,均由上海吉玛基因有限公司提供。脂质体转染按厂商说明书进行。
1.2.3 CCK-8细胞增殖试验 按1.2.1中siUCA1敲减组和siRNA对照组两组胃癌细胞,miR-204过表达组、UCA1过表达组、联合组以及对照组4组细胞进行CCK-8细胞增殖活性比较。胃癌细胞经胰蛋白酶消化后以1×104细胞接种96孔板,加入CCK-8溶液(10μL/孔)继续培养4小时。通过酶标仪测量该样品在450nm处的吸光光度值。
1.2.4 RNA提取、逆转录及实时荧光定量 PCR采用Trizol试剂提取胃癌组织及1.2.1中分组细胞总RNA,对于UCA1及CCND2基因表达,RNA逆转录cDNA及实时荧光定量PCR采用TB GreenTMPremix Ex TaqTMII(TliRNaseH Plus)进行。 UCA1 上游引物为 5′-TTACCTGGGGAACCCCGACC-3′,下游引物为 5′-TGGTGAAGGATGAGGGCTCGT-3′。CCND2上游引物为 5′-GTG CTGGGGAAGTTGAAGTG-3′, 下游引物为 5′-GGC AAACTTAAAGTCGGTGG-3′。内参基因GAPDH上游引物为5’-GGGAGCCAAAAGGGTCAT-3’, 下游引物为 5’-GAGTCCTTCCACGATACCAA-3’。扩增反应条件均为 95℃,5 分钟;95℃,30 秒,60℃,34 秒,35 个循环;72℃,5分钟;反应总体积20μL,其中cDNA 2μL,2×反应液 10μL,上游引物(10μM)1μL,下游引物(10μM)1μL。 miR-204在细胞内的表达含量采用TaqManTMMicroRNA Reverse Transcription Kit,TaqManTMUniversal Master Mix II,with UNG 及miR-204探针和内参基因U6 Taqman探针,操作步骤按说明进行。相对表达量采用2-△△Ct公式计算,其中△△Ct=(Ct目的基因-Ct内参基因)胃癌组织或处理组细胞-(Ct目的基因-Ct内参基因)癌旁组织或对照细胞。
1.2.5 Western blotting试验 收集1.2.1中各分组细胞,抽提总蛋白,利用BCA法测定总蛋白浓度,以每个泳道20μg的蛋白样品上样,经10%变性SDS PAGE电泳后利用电转化法将蛋白转移至PVDF膜上,置于5%脱脂奶粉室温封闭2小时,加入一抗(Ki-67、PCNA、CyclinD1、CyclinD2、β-actin),4℃孵育过夜;次日二抗37℃孵育1小时;TBS-T洗膜3次,每次10分钟,ECL发光试剂显影。以GAPDH为内参进行比较。
1.2.6 Luciferase荧光素报告系统 胃癌细胞以每孔1×105细胞接种于6孔板中,次日转染野生型或突变型CCND2-3′UTR的psiCHECK-2报告载体以及miR-204 mimics。培养48小时后通过双荧光素试剂盒检测荧光素活性。以对照组为100%计算各处理组的相对荧光素强度。
1.2.7 RNA免疫沉淀(RIP)实验 采用RIP检测试剂盒分析UCA1、miR-204与Ago2蛋白的结合情况。鉴于RIP实验过程中存在非特异性吸附的干扰背景,利用IgG为阴性对照抗体,并将Ago2富集的UCA1及miR-204信号与IgG富集信号进行比较。Input RNA为未用抗体沉淀的细胞总RNA量。实验步骤按试剂盒说明书进行,利用上述1.2.4方法检测UCA1及miR-204相对表达量。
1.3 观察指标 荧光定量PCR检测胃癌组织及癌旁健康组织中UCA1及miR-204相对表达。Western blotting试验检测siUCA1敲减组及siRNA对照组细胞增殖标记物Ki-67、PCNA、CyclinD1及CyclinD2的相对表达情况。Luciferase荧光素报告系统检测野生型或突变型CCND2-3′UTR报告系统荧光素活性。
1.4 统计学处理 采用SPSS 10.0统计软件对数据进行统计学分析。细胞实验结果为正态分布的计量资料用(±s)描述,采用 t检验。
2 结果
2.1 UCA1的表达 设癌旁正常组织中UCA1的表达倍数为1,荧光定量PCR检测UCA1在胃癌组织及癌旁健康对照组织中的表达,UCA1在胃癌组织中相对癌旁对照组织的表达倍数为(2.779±2.218)(t=2.537,P<0.05)。
2.2 UCA1对胃癌细胞的增殖作用 在UCA1的2条siRNA筛选中,siUCA1-1敲减效率高于siUCA1-2,差异有统计学意义(P<0.05),详见表 1、图1,选择siUCA1-1作为后续敲减实验。CCK-8增殖实验发现,UCA1敲减后MNK-45及SGC-7901细胞增殖活性与对照组细胞相比减低,差异有统计学意义(P<0.01),详见表 2、图 1。 Western blotting检测发现细胞增殖标记物Ki-67、PCNA及Cyclin D1表达在各处理组细胞中均显著下调(图1)。
表1 UCA1 敲减率(±s)

表1 UCA1 敲减率(±s)
与siUCA-1-2组比较*P<0.05
组别 MNK-45(%) SGC-7901(%)siUCA-1-1 69.67±5.51* 58.67±3.51*siUCA-1-2 23.33±9.61 10.00±5.00
表2 UCA1敲减后MNK-45及SGC-7901细胞增殖活性变化(OD450nm吸光度)(±s)

表2 UCA1敲减后MNK-45及SGC-7901细胞增殖活性变化(OD450nm吸光度)(±s)
与siRNA对照组比较**P<0.01
S G C-7 9 0 1第1天 第2天 第3天 第4天 第1天 第2天 第3天 第4天s i R N A 对照组 0.2 0 6 7±0.0 2 9 8 0.3 6 8 0±0.0 1 6 6 0.7 4 9 5±0.0 4 6 3 1.2 4 5 0±0.1 2 0 8 0.2 1 1 8±0.0 2 2 7 0.4 0 0 3±0.0 3 4 5 0.8 1 7 5±0.0 9 3 3 1.4 6 5 0±0.1 0 3 0 U C A 1 敲减组 0.2 1 8 2±0.0 2 7 7 3 0.3 2 0 4±0.0 1 9 9**0.5 3 4 5±0.0 6 5 1**0.7 4 7 7±0.0 8 2 7**0.2 0 4 4±0.0 1 7 5 0.3 2 1 7±0.0 7 2 2**0.5 5 8 5±0.0 8 7 9**0.9 0 7 2±0.1 3 8 1**M N K-4 5组别

图1 减低UCA1表达对胃癌细胞增殖活性的影响。1A:siUCA1-1 vs siUCA1-2,**P<0.01敲减效率;1B:CCK-8检测UCA1 敲减组与对照组(NC)细胞增殖活性(siUCA1-1vs NC,**P<0.01,n=6);1C:Western blotting 检测细胞增殖标记物Ki-67、PCNA及Cyclin D1的表达情况。
2.3 UCA1对miR-204的作用 在MNK-45及SGC-7901细胞中转染siUCA1后,miR-204较对照细胞相对表达倍数分别为(4.60±0.45)(t=13.61,P<0.01)、(4.57±0.25)(t=24.55,P<0.01)。CCK-8 增殖试验表明,miR-204过表达组增殖活性弱于对照组(P<0.01);而UCA1过表达组细胞增殖活性强于对照组(P<0.01);差异均有统计学意义。当miR-204与UCA1联合共转染时,联合组细胞增殖活性强于单纯miR-204过表达组,差异有统计学意义(P<0.01)。 详见表 3。
表3 UCA1及miR-204表达改变后细胞增殖活性变化(OD450nm 吸光度)(±s)
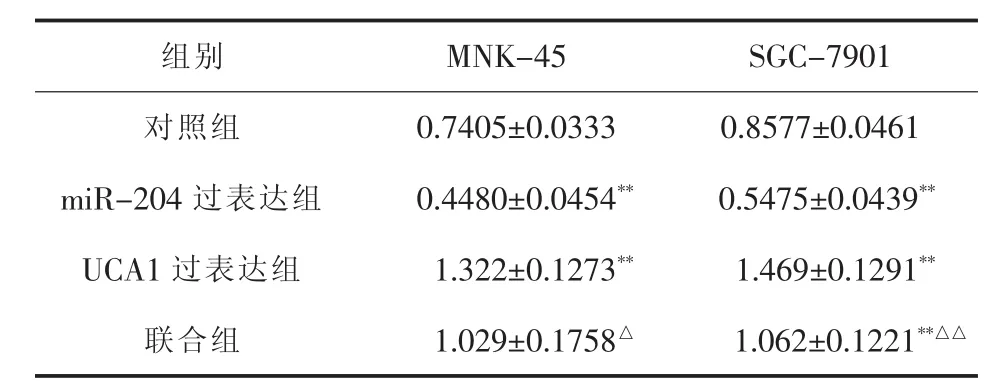
表3 UCA1及miR-204表达改变后细胞增殖活性变化(OD450nm 吸光度)(±s)
与对照组比较**P<0.01;与miR-204过表达组比较△△P<0.01
组别 MNK-45 SGC-7901对照组 0.7405±0.0333 0.8577±0.0461 miR-204 过表达组 0.4480±0.0454** 0.5475±0.0439**UCA1 过表达组 1.322±0.1273** 1.469±0.1291**联合组 1.029±0.1758△ 1.062±0.1221**△△
2.4 RIP试验 Ago2在胃癌细胞MNK-45和SGC-7901细胞中结合UCA1和miR-204相对含量高于IgG免疫沉淀组,差异均有统计学意义(P<0.01)。 详见表 4。
表4 细胞株MNK-45和SGC-7901中Ago2结合UCA1及miR-204的相对富集含量(±s)

表4 细胞株MNK-45和SGC-7901中Ago2结合UCA1及miR-204的相对富集含量(±s)
与IgG免疫沉淀组比较**P<0.01
组别M N K-4 5 S G C-7 9 0 1 U C A 1 m i R-2 0 4 U C A 1 m i R-2 0 4 I g G 免疫沉淀组 1.5 3 3±0.2 5 1 7 2.4 0 0±0.4 5 8 3 1.1 6 7±0.3 5 1 2 2.7 3 3±0.3 2 1 5 A g o 2 免疫沉淀组 8.4 3 3±0.9 5 0 4** 6.9 3 3±0.5 1 3 2** 8.3 3 3±1.0 6 9** 7.6 3 3±0.4 1 6 3**
2.5 miR-204抑癌作用的路径 利用Targetscan软件发现,CCND2的3’UTR存在miR-204潜在结合位点(图3A)。miR-204过表达组细胞CCND2的mRNA转录水平(图3B)和蛋白水平显著下调(图3C)。将含有野生型及突变型miR-204结合位点的CCND2-3’UTR克隆至psiCHECK2荧光素报告载体中,并转染入胃癌细胞中。结果发现,miR-204过表达组细胞野生型CCND2-3’UTR荧光素活性低于对照组细胞,差异有统计学意义(P<0.01),而miR-204过表达组细胞中突变型荧光素活性与对照组差异无统计学意义(P>0.05)(图3D),表明miR-204可以体外结合并抑制CCND2的转录表达。

图2 Ago2结合UCA1及miR-204的相对富集含量

图3 miR-204在胃癌细胞中靶向调控CCND2。3A:野生型或突变型CCND2-3’UTR结合序列示意图;3B:CCND2的mRNA 表达变化(miR-204 过表达组 vs对照组,**P<0.01,n=3);3C:CCND2 的蛋白表达变化;3D:野生型或突变型荧光素报告载体的荧光强度变化(转染组细胞vs对照细胞,**P<0.01,n=3)。
2.6 UCA1过表达对miR-204调控CCND2的影响miR-204过表达组CCND2表达显著低于对照组(t=10.92,P<0.01),为对照组的(0.5267±0.0751)倍。UCA1过表达组CCND2表达显著高于对照组(t=7.894,P<0.01),为对照组(2.253±0.2750)倍。 UCA1 和 miR-204 mimics联合处理细胞后,CCND2的表达变化为对照组的(1.220±0.2352)倍(t=1.620,P>0.05)。
3 讨论
尽管长链非编码RNA最初被认为是 “转录噪音”,越来越多的证据表明,lncRNA在染色质重塑、细胞增殖与凋亡、细胞分化等细胞生物学过程中起到了重要作用[7-8]。近年来发现,长链非编码RNA UCA1在胃癌的发生、发展中起重要作用。UCA1不仅在胃癌组织中异常表达,其表达水平与预后呈正相关,且UCA1对胃癌细胞增殖凋亡、转移和侵袭等生物学行为也起到了促进作用[9-12]。本研究发现,UCA1在胃癌中可以通过抑制miR-204活性、上调miR-204靶基因CCND2来促进胃癌细胞增殖,为UCA1介导的致病机制提供了新的实验室证据。
Cyclin D蛋白属于细胞周期素(Cyclin D),在G1中晚期表达最高,而在S期表达最低,提示其表达增高与细胞增殖有着密切关系。Cyclin D蛋白有3 种亚型:Cyclin D1(CCND1),Cyclin D2(CCND2),Cyclin D3(CCND3),分布在不同染色体中,但具有独特的Cyclin box和PEST序列[13]。CCND1为目前报道最为广泛的细胞周期素。研究发现,Cyclin D1在多种肿瘤中有DNA扩增现象,已作为肿瘤增殖标记物或干预靶点[14-15]。CCND2在肿瘤中也存在表达上调,但与CCND1不同,CCND2并未发现其过表达与DNA扩增有关,提示其表达可能与其他调控机制有关[16-17]。本研究发现,在胃癌中UCA1可通过抑制miR-204对CCND2表达进行调控,从转录水平上揭示CCND2表达调控异常的一种分子机制。CCND2在胃癌中表达上调,高水平CCND2与胃癌患者总体生存率呈负相关[18]。本研究同时发现,在胃癌MNK-45中过表达CCND2可显著增加细胞增殖活性水平,同时也提示UCA1促胃癌增殖功能可能一部分是通过调控CCND2实现的。
长链非编码RNA作为miRNA的竞争RNA(ceRNA)被广泛报道。本研究发现,UCA1可以作为miR-204的海绵吸附竞争分子,重激活CCND2表达。在胃癌细胞中敲减UCA1后,miR-204表达升高;提高miR-204水平后,显著抑制胃癌细胞MNK-45及SGC-7901的生物学活性,而同时过表达UCA1,细胞增殖活性与对照组无显著差异,表明miR-204的抑制活性被中和,UCA1对miR-204活性有抑制作用。分子水平上,胃癌细胞中敲减UCA1后miR-204表达升高。同时,RIP实验发现,Ago2蛋白可显著富集UCA1及miR-204。Ago2为长链非编码RNA海绵吸附miRNA,并调控其活性的主要蛋白。上述结果提示,UCA1可能与miR-204直接结合Ago2蛋白,并通过Ago2蛋白抑制miR-204活性。CCND2荧光素报告系统发现,CCND2为miR-204调控靶基因,而在胃癌细胞中过表达UCA1可以上调CCND2表达水平。结合UCA1对miR-204抑制作用的数据推测,UCA1极有可能通过海绵吸附作用来抑制miR-204,而活化CCND2表达。
综上所述,UCA1具有促胃癌细胞增殖的功能,其促进作用与抑制miR-204并上调其靶基因CCND2表达有关。本研究丰富了长链非编码RNA UCA1在胃癌发生、发展中的作用机制,为胃癌精准干预提供了潜在靶点。
