MARCH8在宫颈癌组织中的表达及其沉默后对人宫颈癌细胞增殖、凋亡的影响
2020-05-06税成愈
税成愈,向 灿
(1.恩施州中心医院西医部 妇产科,湖北 恩施 445000;2.华中科技大学同济医学院附属同济医院 妇产科,湖北 武汉 430000)
宫颈癌是常见的妇科恶性肿瘤之一,其发病率位居妇科恶性肿瘤第2位[1],全球每年约26万女性死于宫颈癌,研究表明宫颈癌的致病因素众多,目前对于宫颈癌的发病具体分子机制尚不完全清楚[2]。膜相关RINpCH(Membrane-associated RING-CH,MARCH)家族是属于E3泛素连接酶的环指结构域的一类家族,MARCH家族有11名成员。MARCH8(Membrane-associated RING-CH8)是第一个于哺乳动物发现的MARCH蛋白,有研究显示MARCH8过表达会下调免疫调节蛋白表达,包括MHC II、B7-2、TfR、CD166、CD88以及CD44等[3-5]。已有研究表明MARCH8介导的TNF相关细胞凋亡的下调(包括诱导TRAIL-R1)已被证实可以阻止乳腺癌细胞凋亡,这提示着MARCH8可能成为基因沉默或敲除研究的潜在靶点,为癌症患者治疗提供参考[6]。但是MARCH8对宫颈癌细胞增殖、凋亡相关的报道较少,因此本文通过本院收集的宫颈癌组织以及体外细胞MARCH8沉默试验来探索MARCH8对宫颈癌的影响,并对其可能存在的机制进行研究,为治疗宫颈癌寻找新的分子靶点提供实验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 样本材料 选取我院宫颈癌手术切除标本20份作为研究对象,同时选取20例正常宫颈组织人群作为对照。所有患者及其家属均自愿参与并签署知情同意书,并经过本院伦理委员会通过,所有组织均于-80℃保存。人宫颈癌细胞系Hela由上海通蔚实业有限公司提供。
1.1.2 试剂及仪器 MARCH8、血清中Bcl-2、Bax、p53、GAPDH、Ki67、Caspase-3抗体以及抗小鼠/兔IgG(Cell Signaling Technology),ECL Kit(Thermo Fisher),二氨基联苯胺(DAB),DNR BioImaging System(DNR,Israel),10%胎牛血清(Sigma-Aldrich),青霉素(MerckKGaA),链霉素(Darmstadt),Dulbecco's改良Eagle’s培养基(Thermo Fisher),Lipofectamine2000(Thermo Fisher),TRIzolKit(Thermo Fisher),Revertaid First Strand cDNA Kit(Thermo Fisher),SYBR-Green PCR(TAKARA),高速冷冻离心机(Beckman Coulter),正置荧光显微镜(Thermo),实时荧光定量PCR仪(罗氏)。 FACSCalibur流式细胞仪,美国BD公司。
1.1.3 细胞培养 人宫颈癌Hela细胞系培养于含10%胎牛血清、100U/mL青霉素或链霉素的完全Dulbecco's改良Eagle’s培养基中常规培养,并在37℃、5%CO2的加湿培养箱中培养至对数期,0.25%胰蛋白酶消化液处理制成细胞悬液。
1.1.4 细胞转染试验 调整Hela细胞密度为1×105个/孔,接种于不含抗生素的培养基6孔板中,培养24 h,采用Lipofectamine2000将siRNA-MARCH8、阴性对照物(siRNA-NC)转染Hela细胞,分别记为MARCH8-RNAi与Ctrl,并采用Western blot以及RT-PCR检测MARCH8-RNAi与Ctrl Hela细胞中MARCH8基因与蛋白表达量,实验操作严格按照试剂操作说明进行。
1.2 MTT法检测细胞增殖率 取对数生长期3种细胞,将MARCH8-RNAi与Ctrl Hela细胞悬液密度调整为3×104个/mL,接种于96孔板、100 μL/孔,培养48 h后弃培养液,每孔加入100 μL 0.5 mg/mL的MTT溶液,重复2次,培养4h、弃MTT,200 μL DMSO作用30 min,全自动酶标仪570 nm波长下检测各孔吸光度A值,以正常Hela细胞的A值用作调零,计算细胞增殖率。
1.3 细胞周期检测 将MARCH8-RNAi与Ctrl Hela细胞悬液密度调整为2.5×104个/mL,接种于6孔板中、400 μL/孔、培养48 h后收集各组细胞,1 000 rpm离心5 min,PBS洗涤2次,加入1 mL 75%乙醇、-20℃固定24 h,加入0.4 μL PI(30 mg/mL)混合,避光孵育30 min,流式细胞仪检测细胞周期,ModFit LT分析并拟合计算各时期细胞百分比。
1.4 细胞凋亡检测 将MARCH8-RNAi与Ctrl Hela细胞悬液密度调整为4×104个/mL,接种于6孔板中、400 μL/孔、培养48 h后收集各组细胞,1 000 rpm离心5 min,PBS洗涤2遍,弃上清液,加入试剂盒中的缓冲液,混匀,再加入5 μL Annex-inV/FITC、10μL PI混合,室温避光孵育15 min,用于流式细胞仪上样检测,CellQuest软件分析计算细胞凋亡率。
1.5 Hoechst 33342体外观察凋亡小体试验 将无菌的盖玻片置于6孔板,将MARCH8-RNAi与Ctrl Hela细胞悬液密度调整为2.5×105个/mL,并接种于盖玻片上,培养48 h收集各组细胞,已预冷的PBS洗涤2次,加入0.2 μL的1 μg/mL Hoechst33342染液,室温避光15 min,封片,荧光显微镜下观察凋亡小体,图像收集,采用ImageJ进行凋亡小体数量统计。
1.6 Western blot检测方法 提取培养48 h后MARCH8-RNAi与Ctrl Hela细胞总蛋白,采用Bradford调整各组蛋白浓度一致,经SDS-PAGE凝胶电泳、电转PVDF膜,密封2 h,加入兔抗人Bcl-2、Bax、p53、MARCH8、GAPDH一抗(1∶500)4℃孵育过夜,TBST漂洗40 min,加入HRP标记的二抗(1∶500)孵育1 h,TBST漂洗40 min,ECL试剂盒与DNR BioImaging System观察膜上蛋白条带,收集图像,采用凝胶图像处理系统软件分析各组条带灰度值,依据相对灰度值进行统计学分析。
1.7 免疫组织化学试验 将组织进行常规石蜡切片(4 μm),牛血清室温孵育2 h,加入Ki67、Caspase-3、MARCH8一抗人血清4℃孵育过夜,再加入与生物素结合的二抗室温孵育3 h,采用二氨基联苯胺检测反应信号。
1.8 RT-PCR检测 用TRIzol试剂分别宫颈癌组织、癌旁正常组织和MARCH8-RNAi组、Ctrl组Hela细胞的总RNA,Revertaid First Strand cDNA合成试剂盒将RNA反转录合成cDNA,SYBR-Green PCR Mix 检测mRNA的表达水平。PCR参数设置:95℃ 5 s,60℃ 34 s、40个循环。相关基因引物序列(见表1)。
表1 RT-PCR基因引物序列

引物名称引物序列(5′~3′)引物位置(bp)GAPDH5′-AGAAGGCTGGGGCTCATTTG-3′ 5′-AGGGGCCATCCACAGTCTTC-3′471~811MARCH85′-TGCATCAGATCTCTGCCATT-3′5′-TGGACGTCATCTGCAACTTC-3′5′-GTCTACGGCCATACCACCCTG-3′5′-AAAGCCTACAGCACCCGGTAT-3′2026~20401PCNA5′-GGGCGTCAACCTAAACAGCA-3′5′-TCCACAA CGAGAG GAACCTCTG-3′10165~10306CDK25′-GCTTTCTGCCATTCTCATCG-3′5′-GTC CCC AGA GTCCGAAA GAT-3′10313~10341CyclinD15′-GCGTTGCTCTGATGGTGA-3′5′-CAG CGT GATGATGGTAGG-3′751~820
2 结果
2.1 宫颈癌组织MARCH8表达水平 免疫组化结果显示MARCH8在宫颈癌组织中阳性表达率显著高于正常宫颈组织(P<0.01,见图1)。

A:MARCH8在正常宫颈组织与宫颈癌组织中免疫组化检测结果(×200);B:A图MARCH8阳性表达率数据统计结果,与正常宫颈组织对比,**:P=0.004。图1 宫颈癌组织MARCH8表达水平
2.2 宫颈癌Hela细胞MARCH8-RNAi验证 Western blot检测结果显示MARCH8-RNAi Hela细胞中MARCH8蛋白水平显著低于其阴性对照(Ctrl)(P=0.0006,见图2A、B),RT-PCR检测结果也显示MARCH8在MARCH8-RNAi Hela细胞表达下调(P=0.0004,见图2C)。
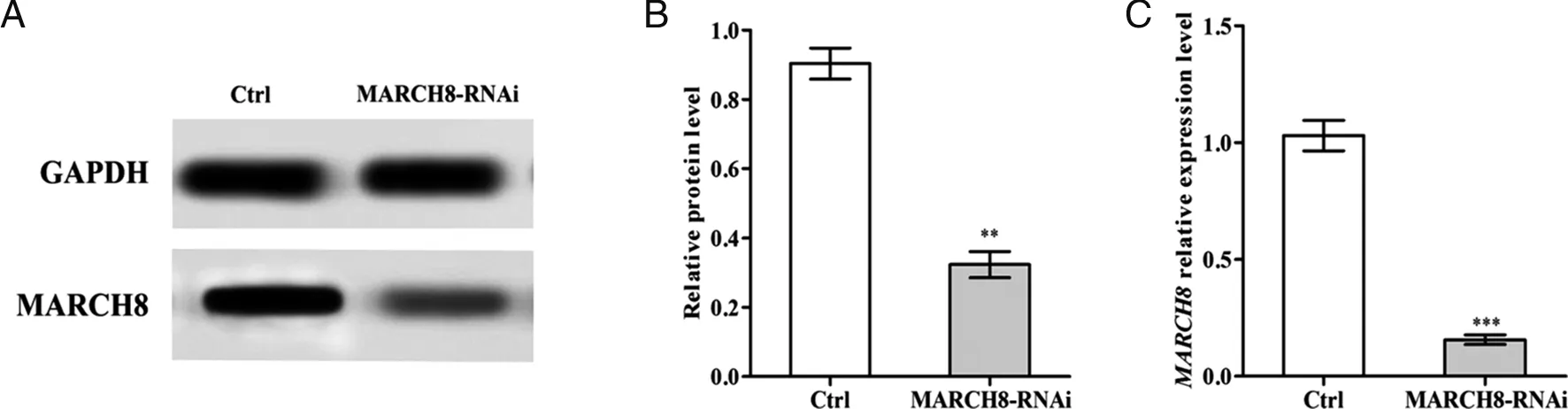
A:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)MARCH8的Western blotting凝胶成像结果;B:A图MARCH8蛋白表达量数据统计结果;C:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)MARCH8的RT-PCR检测结果,与Ctrl对比,**:P=0.003,***:P=0.001。图2 宫颈癌Hela细胞MARCH8-RNAi验证
2.3 MARCH8-RNAi抑制宫颈癌Hela细胞增殖 MTT检测结果显示MARCH8-RNAi Hela细胞增殖率下降至55%,明显低于Ctrl(P=0.006,见图2A);流式细胞仪检测结果显示MARCH8-RNAi Hela细胞处于G0/G1期细胞比例明显增加,且高于Ctrl(P=0.005),而S期及G2、M期的细胞比例均低于Ctrl(P=0.005,见图2B);采用RT-qPCR检测Ctrl Hela细胞及MARCH8-RNAi Hela细胞中PCNA、CDK2、CyclinD1表达水平,结果显示MARCH8-RNAi Hela细胞中的PCNA、CDK2、CyclinD1表达水平均低于Ctrl(P=0.001,见图3C)。
2.4 MARCH8-RNAi促进宫颈癌Hela细胞凋亡 Hoechst 33342检测结果显示MARCH8-RNAi Hela细胞中的凋亡小体数目显著高于Ctrl(P=0.001,见图4);免疫组化结果显示MARCH8-RNAi Hela细胞中Ki67阳性表达率明显低于Ctrl,而Caspase-3的阳性表达率显著高于Ctrl(P=0.007,见图5);流失细胞仪结果显示MARCH8-RNAi Hela细胞凋亡率升高,而存活率降低,与Ctrl差异均有统计学意义(P=0.008,见图6A);Western blotting检测结果显示MARCH8-RNAi Hela细胞中Bax、p53蛋白水平明显高于Ctrl(P=0.001),而Bcl-2蛋白水平低于Ctrl(P=0.005,见图6B、C)。

A: MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)细胞增殖率数据统计结果;B:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)中处G0/G1、S、G2/M期的Hela细胞数目数据统计结果;C:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)Hela细胞中PCNA、CDK2、CyclinD1RT-PCR检测结果,与Ctrl对比,*:P=0.005,**:P=0.001。图3 宫颈癌Hela细胞MARCH8-RNAi验证

A: MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)凋亡小体镜检结果(×200);B:A图的凋亡小体数据统计结果;与Ctrl对比,***:P=0.001。图4 MARCH8-RNAi促进凋亡小体形成

A:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)细胞中Ki67、Caspase-3免疫组化检测结果(×200);B:A图的Ki67、Caspase-3阳性表达率数据统计结果;与Ctrl对比,**:P=0.001。图5 MARCH8-RNAi对Ki67、Caspase-3的影响

A:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)细胞存活率及凋亡率数据统计结果;B:MARCH8-RNAi Hela细胞及其阴性对照组(Ctrl)细胞中Bcl-2、Bax、p53的Western blotting检测凝胶成像结果;C:B图的数据统计结果,与Ctrl对比,**:P=0.001。图6 MARCH8-RNAi对凋亡相关蛋白的影响
3 讨论
现有文献主要报道了MARCH8在免疫调节方面的作用,而关于MARCH8与癌症的相关性的还未完全阐明,有研究显示MARCH8高表达与食道肿瘤有关[7],本文将我院收集到的宫颈癌组织与正常宫颈组织进行免疫组化检测MARCH8蛋白水平,结果显示宫颈癌组织中MARCH8蛋白水平显著高于正常宫颈组织,提示MARCH8可能也参与宫颈癌组织的形成。本研究通过脂质体介导将MARCH8-RNAi转染人宫颈癌Hela细胞,蛋白免疫印迹及RT-PCR结果显示MARCH8-RNAi Hela细胞中MARCH8基因及蛋白水平显著低于其阴性对照组,表明对人宫颈癌Hela细胞的MARCH8沉默成功。
沈妮等[8]研究显示乳腺癌MCF-7细胞RNAi敲减MARCH6基因后,MCF-7细胞增殖受到抑制,细胞周期G1期受阻滞,提示MARCH6可通过影响细胞周期进展来促进乳腺癌细胞增殖。有研究显示MARCH6、MARCH8的重要同源基因均是MARCH2[9-10],提示着MARCH8是否也能通过影响细胞周期来参与癌症细胞增殖。CDK2主要作用于G1期与S期,对DNA修复、促进有丝分裂具有重要意义,其高表达有利于细胞增殖[11],PNCA是一种促进DNA延伸的核蛋白[12],细胞周期素1(CyclinD1)的表达水平直接影响细胞增殖,其高表达会使细胞G1期时间缩短而快速进入S期,导致细胞增殖出现异常[13],有研究表明CyclinD1能与多种癌基因协同促使细胞癌变[14]。Ki-67是一种增殖细胞核抗原,其表达与细胞分裂具有密切关系,因此Ki-67是反映细胞增殖情况的理想标记物[15]。本文结果显示MARCH8-RNAi Hela细胞增殖率降低、处于G0/G1期细胞数目增加,并且CDK2、PNCA及CyclinD1表达量降低,且Ki67蛋白水平降低,说明MARCH8-R NAi可以通过下调CDK2、PNCA、Ki67及CyclinD1水平,使Hela细胞G0/G1期阻滞,延长Hela细胞周期进程,从而抑制Hela细胞增殖。
Bcl-2可通过线粒体途径来调控细胞凋亡[16],Bax是重要的促凋亡基因,Bax、Bcl-2的比例决定细胞的凋亡状态[17],Bax、Bcl-2在调控细胞凋亡过程中起拮抗作用[18]。Caspases-3为诱导细胞凋亡的核心蛋白,其表达与活性直接决定肿瘤细胞的凋亡状态[19]。P53为抑癌基因,对肿瘤生长具有抑制作用[20]。已有研究显示MARCH可以调控凋亡相关蛋白水平[21-22],本文研究结果显示MARCH8-RNAi Hela细胞的凋亡小体与细胞凋亡率均增加,Bcl-2蛋白水平降低,而Caspase-3、Bax、p53蛋白水平升高,表明MARCH8-R NAi可以通过降低Bcl-2蛋白被表达、增加Bax、Caspases-3以及P53蛋白水平,促进细胞凋亡小体形成,从而导致细胞凋亡,可能原因是Bax与p53蛋白在线粒体膜上结合增加,导致线粒体膜孔道形成增多,使线粒体稳态发生改变,从而加快细胞凋亡。
综上所述,MARCH8在宫颈癌组织中表达上调,MARCH8RNAi一方面可以通过降低CDK2、PNCA、CyclinD1、Ki67表达水平,阻碍人宫颈癌Hela细胞周期进程,从而抑制细胞增殖;另一方面MARCH8RNAi还可以通过增加Bax、Caspases-3、P53蛋白水平,抑制Bcl-2蛋白表达,促进Hela细胞凋亡。然而,关于MARCH8是怎样调控细胞周期相关因子表达的机制还不清楚,需要进一步研究。
