响应面法优化超声辅助提取蔓菁多糖工艺及其体外抗氧化性研究
2020-05-05刘利娥何志东赵宵帝
赵 滢,刘利娥,韩 萍,何志东,赵宵帝
(郑州大学公共卫生学院营养与食品卫生学教研室,河南郑州 450001)
多糖是构成生命活动和维持生物功能的四大基本物质之一[1],具有抗肿瘤、抗氧化、提高免疫力、降血糖等生物学作用[2-5]。蔓菁(BrassicarapaL.)又名芜菁、恰玛古,是十字花科芸薹属两年生具有药食两用价值的草本植物[6],其肉质块根中多糖含量丰富,是天然植物多糖的理想来源[7-8]。
目前蔓菁多糖的提取工艺主要为水浴提取[9-10],此方法耗时、耗能、提取产物活性低[11],所以需要对现有方法进行优化。新型超声辅助提取法通过超声波机械振动产生空化作用促进有效物质与溶剂充分混合,提高传质速率,减少多糖的降解[12]。响应面法可通过建立数学模型准确找出提取工艺中各影响因素的最佳组合方式,并对多糖得率的最优值进行预测[13]。蔡啸镝等[14]使用超声辅助法提取新疆恰玛古多糖,与普通水浴提取法相比[15],提取时间缩短了1.41 h,液料比减少了44.33%,省时节能。但此研究并未把超声温度这一重要影响因素纳入到优化条件当中,所以超声辅助提取蔓菁多糖工艺还需进一步深入研究。
因此,本文利用响应面优化试验建立多元回归方程,以拟合超声辅助提取过程中各因素与多糖得率之间的相关关系,得到最佳提取条件,多糖含量的测定采用改进的苯酚硫酸法,并对所提取蔓菁多糖的抗氧化性进行研究,旨在为蔓菁多糖进一步开发利用奠定理论基础。
1 材料与方法
1.1 材料与仪器
蔓菁 购于新乡市凤泉区,由郑州大学潘成学副教授鉴定为蔓菁块根;正己烷、无水乙醇 分析纯,天津市永大化学试剂有限公司;硫酸亚铁 天津市化学试剂供销公司;无水葡萄糖(分析标准品,≥98%) 北京索莱宝科技有限公司;30%过氧化氢洛阳昊华化学试剂有限公司;水杨酸 分析纯,天津市恒兴化学试剂制造有限公司;抗坏血酸 分析纯,天津市永大化学试剂有限公司。
KQ-300DE型数控超声波清洗器 昆山市超声仪器有限公司;RE-2000型旋转蒸发器 上海亚荣生化仪器厂;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;L420型台式低速离心机 湖南湘仪实验室仪器开发有限公司;LGJ-18B型冷冻干燥机 北京四环科学仪器厂有限公司;UV-1601紫外分光光度计 日本岛津公司;Spectra Max M2e型多功能微孔板读数仪 上海美谷分子仪器有限公司。
1.2 实验方法
1.2.1 蔓菁多糖的提取与精制 将蔓菁块根洗净、去皮、切成1 mm薄片、50 ℃烘干、粉碎后过60目筛,于正己烷中回流脱脂,滤渣在通风橱中干燥过夜。称取适量脱脂后的蔓菁粉末,按一定液料比加入蒸馏水,在一定超声功率、一定温度下提取一定时间,且提取2次,合并滤液后旋转蒸发浓缩至原体积的1/3,用Sevage法脱蛋白[16],所得上清液每100 mL加入2 g活性炭脱色,60 ℃水浴30 min后抽滤,滤液中加入95%乙醇至醇浓度达80%,4 ℃静置过夜后离心,沉淀依次用无水乙醇、丙酮、乙醚反复清洗,真空冷冻干燥后即得蔓菁多糖。
1.2.2 单因素试验
1.2.2.1 液料比对蔓菁多糖得率的影响 称取5份蔓菁粉末各0.5 g,按液料比20∶1、30∶1、40∶1、50∶1、60∶1 mL/g加入蒸馏水,置于60 ℃水浴中超声辅助提取50 min,功率为210 W,考察液料比对蔓菁多糖得率的影响。
1.2.2.2 提取温度对蔓菁多糖得率的影响 称取5份蔓菁粉末各0.5 g,按液料比40∶1加入蒸馏水,分别置于40、50、60、70、80 ℃水浴中超声辅助提取50 min,功率为210 W,考察提取温度对蔓菁多糖得率的影响。
1.2.2.3 提取时间对蔓菁多糖得率的影响 称取5份蔓菁粉末各0.5 g,按液料比40∶1加入蒸馏水,置于60 ℃水浴中分别超声辅助提取10、30、50、70、90 min,功率为210 W,考察提取时间对蔓菁多糖得率的影响。
1.2.2.4 超声功率对蔓菁多糖得率的影响 称取5份蔓菁粉末各0.5 g,按液料比40∶1加入蒸馏水,置于60 ℃水浴中超声辅助提取50 min,功率分别为150、180、210、240、270 W,考察超声功率对蔓菁多糖得率的影响。
1.2.3 响应面优化试验设计 根据单因素试验结果,以液料比、提取温度、提取时间、超声功率为试验因素,以蔓菁多糖得率为响应值,运用Design-Expert 8.0.6软件中Box-Behnken中心组合法则进行4因素3水平的响应面优化试验,以确定蔓菁多糖的最佳提取条件,试验4因素3水平编码见表1。
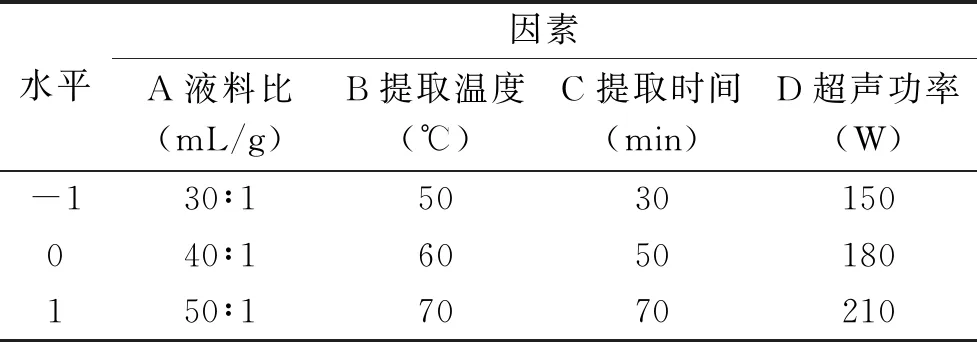
表1 响应面试验因素与水平Table 1 Factors and levels of response surface methodology
1.2.4 蔓菁多糖得率的测定
1.2.4.1 葡萄糖标准曲线的绘制 精密量取葡萄糖标准液(0.1 mg/L)0、0.2、0.4、0.6、0.8、1.0、1.2、1.6、2.0 mL至25 mL具塞试管中,蒸馏水定容至2.0 mL,分别加入1 mL 5%苯酚溶液和5 mL浓硫酸,混合均匀后静置10 min,沸水浴加热15 min,冷却至室温,以2.0 mL蒸馏水为空白,于490 nm处测吸光度,以葡萄糖浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线。所得标准曲线的回归方程为y=15.5698x-0.0184,R2=0.9988。
1.2.4.2 换算因子的测定 参照吴拥军等[17]试验方法,并稍作修改。准确称取干燥至恒重的蔓菁多糖10 mg,加水定容至100 mL,吸取1 mL,用蒸馏水定容至2 mL,按照1.2.4.1中的步骤显色并测其吸光度,根据标准曲线所得的回归方程计算多糖溶液中葡萄糖的浓度,计算换算因子f=m/(c×d×v),式中m为多糖质量(mg),c为多糖溶液中葡萄糖浓度(mg/mL),d为多糖溶液的稀释倍数,v为体积(mL)。计算得到f=1.4281。
1.2.4.3 样品中蔓菁多糖得率测定 精密称取蔓菁粉末0.5 g,按一定液料比、提取温度、提取时间、功率超声提取两次,抽滤、合并滤液,定容于100 mL容量瓶中,取1 mL置于50 mL容量瓶中定容,取2 mL滤液置于具塞试管中,按照“1.2.4.1”中的步骤显色并测其吸光度,由标准曲线和换算因子计算多糖得率。
多糖得率(%)=(c×d×v×f)/m
式中,c为待测溶液中葡萄糖浓度,mg/mL;d为稀释倍数;v为待测溶液体积,mL;f为换算因子;m为蔓菁粉末质量,mg。
1.2.5 蔓菁多糖对·OH清除力测定 参照Yu等[18]方法。吸取100 μL 2.00 mg/L的蔓菁多糖溶液于96孔板中,进行2倍梯度稀释,配成浓度为2.00、1.00、0.50、0.25、0.13 mg/L的溶液。每孔依次加入50 μL 8.98 mmol/L的硫酸亚铁溶液、50 μL 8.93 mmol/L的水杨酸乙醇溶液、50 μL 9.00 mmol/L的过氧化氢溶液,置37 ℃恒温箱中30 min。相同浓度冷冻干燥后的蔓菁多糖样品做3组平行试验,在波长510 nm处测吸光度Ai,用等量去离子水分别替换过氧化氢溶液和样品多糖溶液,测定Aj和Ac。以抗坏血酸作为阳性对照,浓度等梯度稀释为6.00、3.00、1.50、0.75、0.38、0.19、0.09 mg/mL。·OH清除率由以下公式计算获得,IC50值表示·OH清除率达50%时所需的样品质量浓度,常用IC50值的大小表示样品抗氧化性的高低。
式中:Ai为样品组吸光度;Aj为去离子水代替过氧化氢溶液测得对照组的吸光度;Ac为空白组吸光度。
1.3 数据处理
每组试验平行测定三次,所得结果以均数±标准差表示,用Microsoft Excel 2016软件、Origin软件和Design-Expert 8.0.6软件进行数据统计分析及绘图制作。
2 结果与分析
2.1 单因素实验结果
2.1.1 液料比对蔓菁多糖得率的影响 由图1可知,当液料比从20∶1 (mL/g)增至40∶1 (mL/g),蔓菁多糖得率逐渐升高,其原因可能是液料比较低时溶液的粘稠度大,超声波对细胞的空化作用较弱,加之细胞内外溶质的浓度差较小,不利于多糖溶出,随着蒸馏水量的增加,溶液粘稠度降低,细胞内外多糖的浓度差增大,有利于多糖向溶剂中扩散[19-20]。当液料比增至为40∶1 (mL/g)时,多糖得率达到最大值为64.87%,之后随着液料比继续增加,超声波所产生的能量大多被溶剂吸收,并且杂质溶出较多,多糖得率反而下降[20]。因此,液料比为40∶1 (mL/g)最合适。

图1 液料比对多糖得率的影响Fig.1 Effect of liquid-to-solid ratio on yield of polysaccharides
2.1.2 提取温度对蔓菁多糖得率的影响由图2可知,随着温度从40 ℃升高到60 ℃,多糖得率显著提高,60 ℃达到最大值65.19%,一方面可能是因为在适当范围内升高温度可降低溶液的粘稠度,增加多糖在溶液中的溶解度和扩散性,从而提高了多糖得率。另一方面,适当升温可增加超声所产生的空化作用,加大细胞损伤,促使细胞内多糖向外界溶出,从而使多糖得率升高[21]。当温度达到60 ℃时继续升温,高温不仅会造成多糖的分解还会使溶液中的大量水分蒸发,从而使多糖得率降低[22]。因此,适宜的提取温度为60 ℃。

图2 提取温度对多糖得率的影响Fig.2 Effect of extraction temperature on yield of polysaccharides
2.1.3 提取时间对蔓菁多糖得率的影响 由图3可知,随着提取时间的增加,蔓菁多糖的得率逐渐升高,在50 min时达到最大值64.78%,继续延长提取时间,多糖得率反而下降。这种现象可以解释为,在提取的早期,超声波产生的空化作用使蔓菁细胞逐渐破裂,增加了提取液与细胞内物质的接触面积,促进了多糖的溶出,从而得率升高。但随着提取时间的延长,提取液蒸发减少,蔓菁多糖溶出趋于饱和,并且会造成多糖的降解[23]。因此,从节约时间和提取效果的角度考虑,适宜的提取时间为50 min。

图3 提取时间对多糖得率的影响Fig.3 Effect of extraction time on yield of polysaccharides
2.1.4 超声功率对蔓菁多糖得率的影响由 图4可知,超声功率在150~270 W之间时,蔓菁多糖的得率随功率的增加先升高后降低。随着功率的增大,超声波对细胞的作用越强,使细胞膜和细胞壁的通透性增加,从而增加多糖传质速率,使多糖产量增加[21]。当功率超过180 W,过大的超声功率会破坏多糖结构,从而使得率降低[14]。因此,超声功率为180 W较合适。

图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on yield of polysaccharides
2.2 响应面试验结果
2.2.1 试验设计结果 以单因素试验结果为依据,选取液料比(mL/g)、提取温度(℃)、提取时间(min)和超声功率(W)为自变量,蔓菁多糖得率为响应值,通过Design-Expert 8.0.6软件进行4因素3水平的响应面分析,所得试验组合和结果如表2所示。

表2 Box-Behnken试验设计及响应值Table 2 Design and response value of Box-Behnken experiment
2.2.2 模型的建立与统计分析 利用Design-Expert 8.0.6软件对表2中的数据进行多元回归拟合,得到蔓菁多糖得率Y(%)对编码自变量液料比A(mL/g)、提取温度B(℃)、提取时间C(min)和超声功率D(W)的四元二次回归方程:Y=65.39+0.4A-0.044B+0.21C-0.032D-0.18AB-0.05AC+0.42AD-0.42BC-0.065BD+0.015CD-0.6A2-0.48B2-0.48C2-0.74D2。

表3 回归模型方差分析表Table 3 Variance analysis of regression model
2.2.3 响应面交互作用分析 通过Design-Expert 8.0.6软件绘制响应面图和等高线图可以直观反映研究因素及其交互作用对蔓菁多糖得率的影响,响应面图中曲线越弯曲说明研究因素对多糖得率影响越大,等高线呈椭圆形说明研究因素之间的交互作用显著[24]。如图5所示,液料比与提取温度之间存在显著交互作用,固定液料比,多糖得率随温度的升高先缓慢增加后有降低趋势,在同一温度下,多糖得率随液料比的增加先升高后降低。图6显示,液料比与超声功率之间的交互作用极显著,在一定液料比下,多糖得率随超声功率的增加先升高后降低,对于同一超声功率,多糖得率随液料比的增加先升高后趋于平稳,由响应面图两侧弯曲程度可以看出液料比对多糖得率的影响大于超声功率。由图7可知,温度与时间之间的交互作用极显著,当温度固定时,多糖得率随时间增加先升高后降低,当时间固定时,多糖得率的变化趋势随温度的升高也呈现出相同的变化。

图5 液料比和提取温度的交互作用对多糖得率影响的响应面图和等高线图Fig.5 Response surface and contour plots of the interaction effect between liquid-solid ratio and extraction temperature on yield of polysaccharides
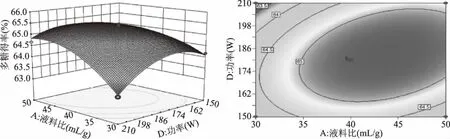
图6 液料比和超声功率的交互作用对多糖得率影响的响应面图和等高线图Fig.6 Response surface and contour plots of the interaction effect between liquid-solid ratio and ultrasonic power on yield of polysaccharides
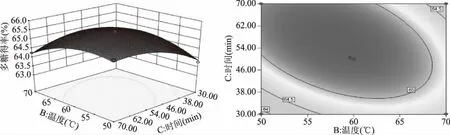
图7 提取温度和时间的交互作用对多糖得率影响的响应面图和等高线图Fig.7 Response surface and contour plots of the interaction effect between extraction temperature and time on yield of polysaccharides
2.2.4 验证实验 通过响应面优化分析结果显示,超声辅助提取蔓菁多糖的最佳提取工艺为液料比44.04∶1 (mL/g),提取温度57.28 ℃,提取时间56.43 min,超声功率183.27 W。根据仪器的实际操作范围将此条件稍作修改,最佳提取参数设定为液料比44∶1 (mL/g),提取温度57 ℃,提取时间56 min,超声功率为180 W,在此条件下蔓菁多糖得率的预测值为65.51%,进行三次平行试验得到实际值为65.43%,两者的相对误差为0.12%,说明该拟合模型具有可靠性。
2.3 对·OH的清除作用
通过Fenton体系产生·OH与水杨酸混合后的产物在510 nm处有特殊吸收。加入自由基清除剂后,·OH数量减少,与水杨酸的反应产物减少,吸光度值降低[25]。因此,可以根据吸光度值降低的程度判断蔓菁多糖对·OH的清除情况。如图8所示,随着蔓菁多糖的浓度增加,·OH的清除率随之增加,说明蔓菁多糖对·OH的清除能力具有浓度依赖性,当蔓菁多糖浓度为2 mg/mL时,对·OH清除率达到最大为95.78%。蔓菁多糖对·OH清除率的回归方程为y=23.212lnx+70.412,其R2=0.9078。根据回归方程可知蔓菁多糖IC50=0.415 mg/mL,而抗坏血酸IC50=0.883 mg/mL,一般认为IC50值小于10 mg/mL,该物质具有较好的抗氧化性[26]。可见蔓菁多糖对于·OH的清除能力大于抗坏血酸对·OH的清除能力,蔓菁多糖具有较强的抗氧化性。

图8 蔓菁多糖对·OH的清除作用Fig.8 ·OH scavenging activity of polysaccharides from turnip
3 结论与讨论
本研究采用超声法辅助提取蔓菁中天然多糖成分,并对提取工艺进行响应面优化。得到最佳提取工艺:液料比44∶1 (mL/g),提取温度57 ℃,提取时间56 min,超声功率180 W。经验证,蔓菁多糖得率的实际值为65.43%,与模型预测值偏差较小,说明此优化工艺参数具有实际参考价值。王伟等用响应面法优化新疆芜菁多糖的提取工艺,确定了提取工艺的最优条件:液料比75∶1 (mL/g),提取温度93 ℃,提取时间4.3 h,提取次数3次,多糖得率为23.72%[10]。对比可知,本研究采用超声辅助提取法在很大程度上减少了液料比、降低了提取温度、使提取时间缩短3.4 h、多糖得率大幅度提高。蔡啸镝等[14]用超声辅助法提取恰玛古多糖,对液料比、提取时间、乙醇体积分数、超声功率进行优化,多糖得率为6.86%。与该研究结果相差较大,原因可能有三个方面:一是提取工艺的优化参数不同,有研究表明提取温度对多糖得率的影响大于乙醇体积分数[27],而本实验将提取温度纳入到提取工艺的优化条件当中,显示提取温度对多糖得率有重要影响;二是与测定方法有关,本试验采用改进的苯酚硫酸法测定溶液中蔓菁多糖的含量,以葡萄糖为标准品,用精制蔓菁多糖计算换算因子,减少了单纯用葡萄糖浓度来推算蔓菁多糖含量所引起的系统误差,此外,直接测定提取液中蔓菁多糖含量并计算多糖得率,比从提取液中通过脱蛋白、脱色素、冷冻干燥后计算多糖与蔓菁原材料的质量之比的方式更为精确,减少了纯化过程中造成的多糖损失;三是不同产地的蔓菁多糖含量差别较大[28]。
·OH是体内活性最强、毒性最大、半衰期最短的强氧化剂,几乎可以和体内所有分子发生反应[25],因此研究蔓菁多糖对·OH的清除作用对研究其抗氧化性具有指导意义。体外抗氧化试验表明,本研究所采用的新乡蔓菁提取的多糖对·OH的清除能力较强,IC50=0.415 mg/mL。数据结果优于张谦筱等所研究的新疆蔓菁多糖对·OH的清除作用,IC50=0.7 mg/mL[29]。因此,新乡蔓菁多糖具有较好的抗氧化活性,进一步增加了其开发利用的经济价值。
综上所述,本研究通过响应面法优化超声辅助提取蔓菁多糖工艺,所得最优提取参数有效可行,有益于蔓菁多糖作为天然抗氧化剂在食品、药品、化妆品、保健品等领域中的推广应用。
