基于CdTe/CdS量子点荧光淬灭方法检测自来水和果汁中汞离子
2020-05-04胡亚云
崔 璐,姜 莉,田 雨,刘 程,胡亚云
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
近年来,随着农业经济结构调整和农业标准化体系建设,农产品质量得到了较大提高,但有毒有害物质尤其是重金属污染对人类的饮食安全构成极大威胁[1]。汞元素是一种可以被人体富集的重金属元素,短时间内大量摄入汞元素或者长时间持续摄入微量汞都会严重损害人体生理机能,使泌尿、呼吸、消化甚至中枢神经系统严重受损[2]。汞在自然界中广泛存在,所以日常居民饮用的自来水中汞含量的检测需要严格把关。我国生活饮用水标准汞限值为0.001 mg/L[3],食品中的总汞限量值为0.003 mg/kg[4]。果汁作为常见的饮料制品,其汞含量也需要严格控制。我国作为浓缩苹果汁出口第一大国,苹果汁品质保证对我国果汁行业经济的长远发展具有重要意义[5],其重金属汞离子的检测显得尤为重要。
目前对重金属汞的检测方法有原子吸收法[6-7]、原子荧光光谱法[8-10]、电感耦合等离子质谱法[11]等。原子吸收光谱法检测速度快、灵敏度高、受干扰程度小[12];原子荧光光谱法能够同时分析多种元素[13];电感耦合等离子体质谱法操作简便、准确度高、重复性好[14-16]。此外,台希等[17]和方红等[18]用固相萃取富集高效液相色谱法成功对汞元素进行了测定,检出限为3 μg/L;用酶抑制法也可以测定重金属离子的含量,对某些特定的有机汞化合物的检测限甚至达到了0.03 μg/L[19]。这些检测方法在检测汞离子时各有优势,但其不足之处在于样品的预处理时间长,检测过程复杂,成本耗费高,因而需要建立一种更为快速、便捷、低成本、高灵敏度的检测体系。近年来,基于荧光材料的荧光分光光度法是重金属检测方法中比较高效的方法之一,逐渐应用于食品安全领域[20-21]。这种方法具有不足之处,往往会造成一定程度检测误差[22-24]。
量子点(quantum dots,QDs)作为一种纳米级半导体材料,因其优异的光学特性与独特的光学性质而备受关注[25]。Chen等[26]合成了水溶性发光CdS量子点,并表明CdS量子点对一些金属离子的发光响应有重要影响。Banerjee等[27]利用量子点选择性检测了Cd2+;Wu等[28]建立了一种以荧光猝灭为基础测定Pb2+的方法;Xia等[29]提出了一种以dBS包覆的CdTe量子点为探针检测汞(Ⅱ)的荧光方法。而核壳型CdTe/CdS量子点具有更高的稳定性只有研究用来检测Cd2+[30],却还未有用于Hg2+的检测研究。
因此,本文以实验室建立的核壳型CdTe/CdS量子点制备方法为基础,以巯基乙酸作为修饰剂,在水相中合成核壳型CdTe/CdS量子点材料,优化建立基于量子点的果汁样品中Hg2+的检测方法,为食品中快速方便检测重金属污染提供有效的思路和方法。
1 材料与方法
1.1 材料和仪器
碲粉(Te)、氯化镉(CdCl2)、硼氢化钠(NaBH4)、氯化钠(NaCl)、氯金酸(HAuCl4)等常用试剂 上海国药集团化学试剂有限公司;铝(Al3+)、铅(Pb2+)、镉(Cd2+)、钙(Ca2+)、砷(As2+)、银(Ag+)、锌(Zn2+)、镁(Mg2+)、铁(Fe3+)、镍(Ni2+)、锰(Mn2+)、汞(Hg2+)、铬(Cr2+)等重金属标准溶液 均为分析纯,上海源叶生物科技有限公司;浓缩苹果汁样品 陕西海升果业发展股份有限公司。
UV-8000型紫外-可见分光光度计 上海精密仪器仪表有限公司;PHS-3C pH计 上海雷磁仪器厂;LS-55型荧光分光光度计 美国PE公司。
1.2 实验方法
1.2.1 量子点制备及光谱表征 以实验室建立的方法制备获得CdTe/CdS量子点材料,具体操作为:称取114.2 mg(0.5 mmol)的CdCl2·2.5H2O和242 μL(3.5 mmol)的巯基乙酸(TGA)混合于90 mL超纯水中,在磁力搅拌的同时滴加1 mol/L NaOH溶液,直至使溶液的pH调至10。将此溶液转移至三颈烧瓶中,80 ℃下密闭通N2回流,30 min后将5 mL NaHTe溶液快速注入上述准备好的混合溶液中,在80 ℃下密闭通N2回流40 min(成核回流时间)得到水溶性CdTe核量子点。将228.3 mg(3.0 mmol)硫脲溶解于20 mL超纯水中,加入到CdTe量子点溶液中,在80 ℃下密闭通N2回流40 min(包壳回流时间)得到水溶性CdTe/CdS量子点。将得到的量子点材料样品装在石英比色皿中,分别利用荧光光谱仪和紫外-可见吸收光谱仪进行荧光和紫外测试,其中荧光光谱激发波长为380 nm。
1.2.2 量子点稳定性评价
1.2.2.1 量子点溶液与缓冲液体积比对量子点荧光强度的影响 将1.2.1中制备好的量子点溶液和浓度为0.05 mol/L的Tris-HCl缓冲溶液(pH8.0),分别以体积比1∶0.1、1∶0.5、1∶1、1∶2、1∶3的比例混合,于室温在最大发射波长(530 nm)下测定混合溶液的荧光强度,确定量子点溶液与Tris-HCl缓冲溶液体积比对荧光强度的影响。
1.2.2.2 pH对量子点荧光强度的影响 配制pH为6.0、7.0、8.0、9.0和10.0且浓度为0.05 mol/L的Tris-HCl缓冲体系,将量子点与不同pH的Tris-HCl缓冲溶液等体积混合,于室温在最大发射波长(530 nm)下测定混合溶液的荧光强度,确定最佳反应pH。
1.2.3 汞离子检测条件优化
1.2.3.1 缓冲液pH对汞离子检测的影响 分别配制pH为6.0、7.0、8.0、9.0和10.0,浓度为0.05 mol/L的Tris-HCl缓冲溶液。以不同pH的Tris-HCl缓冲体系配制浓度为4×10-5mol/L的Hg2+溶液,并将其与量子点溶液等体积混合反应15 min,在室温下测定荧光强度,确定最佳的缓冲液pH。
1.2.3.2 反应时间对汞离子检测的影响 将量子点溶液与Tris-HCl缓冲体系(pH8.0)配制浓度4×10-5mol/L的Hg2+溶液等体积混合,分别设置反应时间为3、6、9、12、15、18、21、30、50、60 min,在室温下测定荧光强度,确定最佳反应时间。
1.2.3.3 不同浓度Hg2+对量子点荧光强度的影响 用浓度为0.05 mol/L的Tris-HCl缓冲液(pH8.0)配制浓度为10-8、10-7、10-6、2×10-6、6×10-6、8×10-6、2×10-5、4×10-5、6×10-5、8×10-5、×10-4mol/L的Hg2+溶液。将量子点与不同浓度的Hg2+溶液等体积混合反应15 min,空白试剂加入等体积的Tris-HCl缓冲液。在室温下测定其荧光强度,评价不同浓度Hg2+对量子点猝灭效果。
1.2.3.4 其他金属离子对汞离子检测的干扰 以Ca2+、Al3+、Ni2+、Fe2+、Fe3+、Mn2+、Cr2+、Mg2+、Zn2+、Cd2+、Na+、As3+和Ag+为材料,用浓度为0.05 mol/L的Tris-HCl缓冲液(pH8.0)配制浓度为10-4mol/L的各金属离子溶液,同时配制浓度为4×10-5mol/L的Hg2+溶液。将配制好的Hg2+溶液、不同金属离子溶液和量子点溶液以体积比1∶1∶2混合反应15 min,在常温下测定其荧光强度变化。空白试剂加入与Hg2+溶液等体积浓度为0.05 mol/L的Tris-HCl缓冲液(pH8.0)。
计算公式如下:
式中:W表示金属离子对量子点检测Hg2+的干扰程度,%;F表示测定的样品荧光强度,Fblank表示空白试剂的荧光强度。对照试剂记为F0。
1.2.4 自来水和果汁样品中Hg2+的加标实验 以建立的方法进行自来水(简单体系)和商业苹果汁稀释样品(复杂体系)中Hg2+的检测。以自来水或者浓缩果汁稀释之后的样品(12 °Brix)为基础,调整pH在7.0~8.0之间。采用加标法,选择浓度分别为2×10-5、4×10-5和6×10-5mol/L的Hg2+标准溶液,将Hg2+标准溶液、自来水或者果汁样品(Hg2+本底值为0)、量子点溶液以体积比为1∶1∶2的比例混合,设置激发波长450 nm,入射狭缝10 nm,出射狭缝10 nm,在室温下测定样品的荧光强度,分析测试结果。另外,空白试剂、对照试剂分别加入与Hg2+标准溶液和自来水等体积浓度为0.05 mol/L的Tris-HCl缓冲液(pH8.0),在室温下测定荧光强度。通过测定其Hg2+含量,以对应相对标准偏差(RSD)和回收率验证方法的准确度和稳定性。
1.3 数据统计分析
所有样品检测平行三次,利用OriginLab 8.0、Excel 2010等软件对检测结果进行处理分析。
2 结果与讨论
2.1 光谱表征
CdTe/CdS量子点的荧光光谱如图1所示。
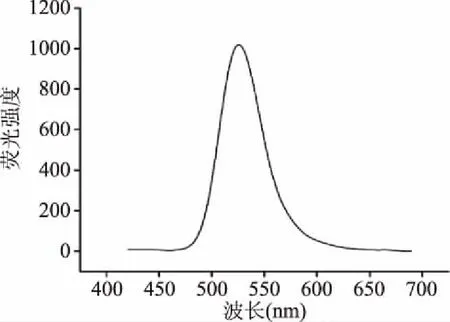
图1 CdTe/CdS量子点的荧光发射光谱Fig.1 Fluorescence emission spectra of CdTe/CdS QDs
由图1可知,制备的CdTe/CdS量子点荧光发射光谱吸收峰为530 nm,半峰宽为61 nm,荧光谱带较为光滑,荧光强度高且较为稳定;荧光谱图中单一的发射峰表明CdS纳米晶没有单独成核。后续检测中,以530 nm对应的荧光发射光谱强度进行目标物的检测。
2.2 量子点稳定性评价
2.2.1 CdTe/CdS量子点溶液与缓冲液体积比对荧光强度的影响 从图2可以看出,缓冲溶液与量子点溶液以1∶1混合后得到的溶液荧光强度最大,而量子点体积比较大或者较小都会影响其荧光强度,尤其是量子点溶液与缓冲溶液以1∶0.1混合反应后,溶液荧光强度明显降低,这是因为量子点在体系中占比较大,导致浓度过高,自身发生了猝灭,从而影响结果,不利于荧光强度的检测。因此,选择量子点溶液和Tris-HCl缓冲溶液等体积(1∶1)混合进行后续试验。
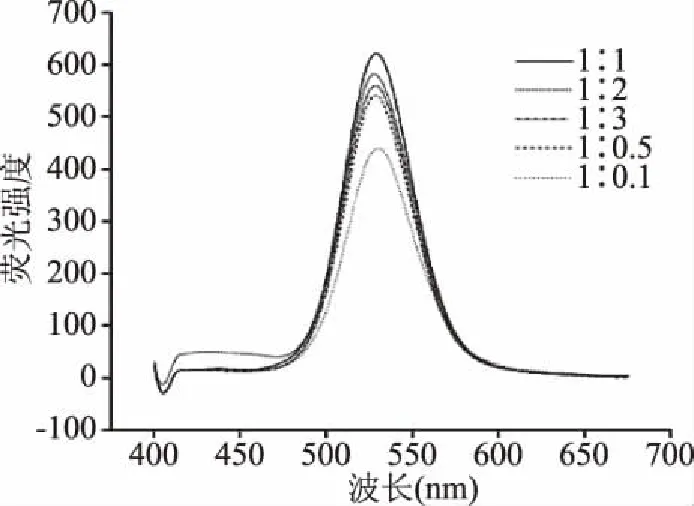
图2 浓度变化对CdTe/CdS量子点溶液荧光强度的影响Fig.2 Effect of concentration on fluorescence intensity of CdTe/CdS QDs solution
2.2.2 缓冲溶液pH对荧光强度的影响 从图3可知:在酸性条件下,量子点溶液的荧光强度较低。推断原因可能是在酸性环境中,H+大量游离,这些游离的H+会和CdTe/CdS量子点表面的巯基乙酸结合,导致已经固着在量子点表面的巯基乙酸脱落,最终降低荧光强度。当pH逐渐增加,量子点的荧光强度会逐渐增强,并在pH为8时,量子点荧光强度为805.69,这种变化主要是因为在中性环境中,量子点表面的无辐射结合和表面缺陷减少,故荧光强度增加。而当pH超过8,在碱性环境中,量子点的荧光强度又降低,由于碱性环境中较多的羟基会附着在量子点表面,阻碍发光基团作用,从而降低荧光强度[31]。因此为了避免溶液环境酸碱度对Hg2+检测产生的误差,选择pH8.0的溶液环境进行后续试验。
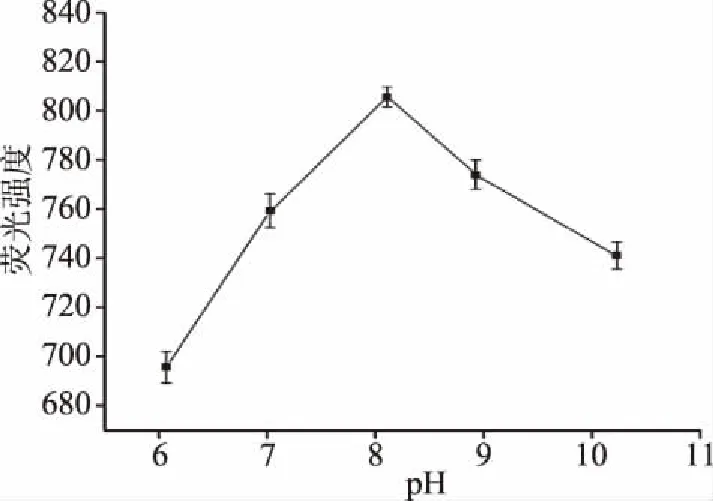
图3 pH对CdTe/CdS量子点溶液荧光强度的影响Fig.3 Effect of pH on fluorescence intensity of CdTe/CdS QDs solution
2.3 Hg2+检测方法的构建
2.3.1 缓冲液pH对Hg2+检测的影响 从图4可以看出,随着pH的变化,荧光强度也呈现出先增大后减小的趋势。结合图3缓冲溶液pH对量子点荧光强度的影响,可以看出图3和图4中pH变化对量子点荧光强度影响趋势相同,但由于Hg2+的猝灭效果,图4所示pH为8时的荧光强度远小于同等条件下图3所示的荧光强度。同时,由于金属离子在碱性环境下容易形成沉淀会对检测结果有一定的影响,因此选择在pH8.0的环境下进行Hg2+的检测。

图4 pH对Hg2+检测的影响Fig.4 The effect of pH on the detection of Hg2+
2.3.2 反应时间对Hg2+检测的影响 从图5可以看出,量子点荧光强度在加入Hg2+溶液后的10 min内迅速降低,即迅速发生荧光猝灭。并在15 min后其荧光强度趋于稳定,也就是Hg2+与量子点基本反应完全,故选择反应时间为15 min进行后续检测。

图5 反应时间对Hg2+检测的影响Fig.5 The effect of reaction time on the detection of Hg2+
2.3.3 不同浓度Hg2+对量子点荧光强度的影响 研究结果表明,随着Hg2+溶液浓度的增加,体系对量子点的荧光猝灭效果逐渐增强。在Hg2+溶液浓度为2×10-5mol/L时,量子点体系荧光强度降低到原量子点溶液荧光强度的1/10,达到96.69,荧光发射峰趋于不对称,此后溶液浓度再增加,荧光强度继续降低且无荧光发射峰。计算F0/F,并得到F0/F与Hg2+溶液浓度的线性关系(如图7),结果表明Hg2+溶液浓度在10-6~10-4mol/L范围内与F0/F呈良好的线性关系,R2=0.99588,定量限为1×10-6mol/L,理论检测限为2.667×10-9mol/L,即2.667 nmol/L。

图6 不同浓度的Hg2+对量子点的荧光猝灭效果Fig.6 Fluorescence quenching of QDs with different concentrations of Hg2+

图7 量子点荧光强度之比与溶液浓度的线性关系Fig.7 The linear relationship between the ratio of the fluorescence intensity of the QDs and the concentration of Hg2+
2.3.4 其他金属离子的干扰实验 在最大激发波长下,测试各待测溶液的荧光强度,并由F/F0得到不同重金属离子对量子点的荧光猝灭效果,如图8所示。
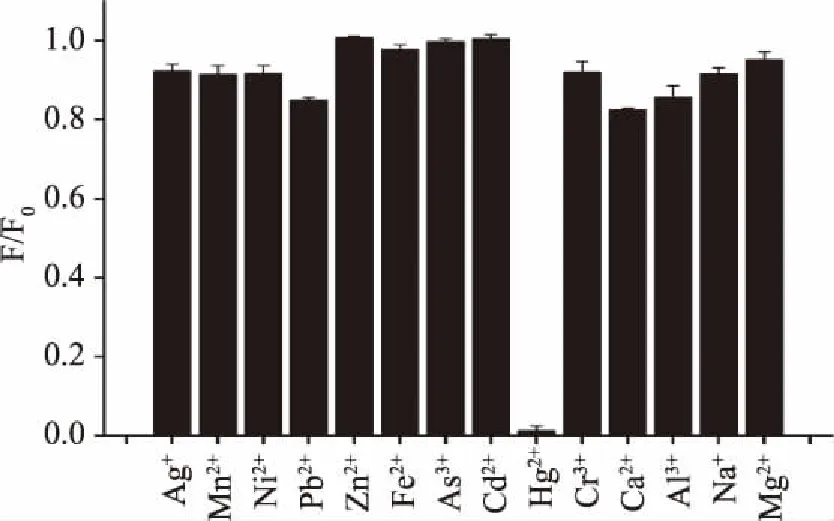
图8 CdTe/CdS量子点对不同重金属离子的响应Fig.8 Response of CdTe/CdS QDs to metal ions
从选择性实验结果(如图8)可以得到:在常见的14种金属离子中,只有Hg2+对CdTe/CdS量子点有明显的荧光猝灭效果,猝灭率达到了98%,其他金属离子则无明显的猝灭效果,这为本研究中基于量子点检测Hg2+奠定了理论基础,可实现该量子点对Hg2+的灵敏性检测。图9结果表明,大部分的金属离子在一定范围内对Hg2+的检测基本无干扰,故该量子点检测Hg2+效果良好。

图9 不同重金属离子对量子点检测Hg2+的干扰测试Fig.9 Interference test of common metal ions on detection of Hg2+ by CdTe/CdS QDs
2.4 样品体系中Hg2+的分析
在自来水和果汁样品中加入不同浓度的Hg2+,每个浓度梯度平行六个样品,测定其含量,对应相对标准偏差(RSD)和回收率如表1所示。表1测定结果表明,未加标自来水中并未发现Hg2+存在,而采用加标法进行检测时,不同浓度的回收率为97.18%~100.39%,水样中的成分对检测没有干扰;同时,未加标果汁样品中没有发现Hg2+的存在,不同浓度的回收率为81.55%~102.50%;且随着加标浓度增加,回收率呈现增大趋势。加标回收率和RSD表明建立的方法可以用于果汁样品中Hg2+的检测,加入浓度为2.0×10-5mol/L的Hg2+标准溶液时,检测浓度与理论浓度接近,且相对标准偏差(RSD)达到了1.72%,说明检测结果较为理想。在一定的线性范围内,该方法的检测限可以达到2.0×10-5mol/L。
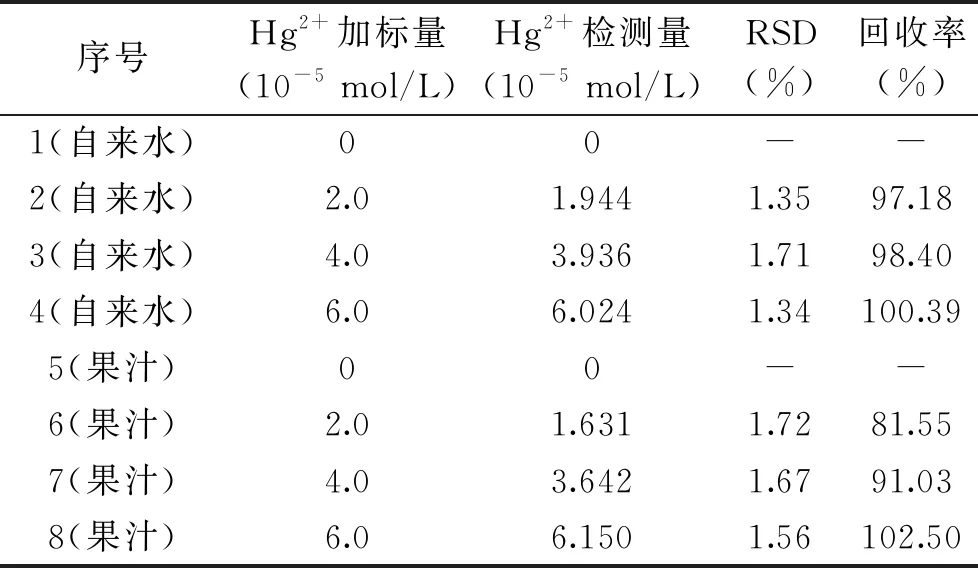
表1 不同样品中Hg2+的检测Table 1 The detection of Hg2+ in different samples
3 结论与讨论
本研究基于巯基乙酸修饰的核壳型CdTe/CdS量子点实现了重金属Hg2+的检测。在Tris-HCl缓冲溶液浓度为0.05 mol/L,pH为8.0,室温反应15 min的条件下,不同浓度Hg2+(10-6~10-4mol/L)对量子点具有较好的荧光猝灭效果,且荧光猝灭程度与Hg2+的浓度存在良好的线性关系,这种检测方法对Hg2+的理论检出限为2.667 nmol/L,低于自来水检测标准(0.001 mg/L),可以满足其检测需求。本研究中果汁样品加标试验结果表明,建立的方法可以用于稀释果汁样品中Hg2+的检测,这种检测方法对应的最低检测浓度为2.0×10-5mol/L。另外,对Hg2+荧光猝灭CdTe/CdS半导体量子点反应机理进行讨论,根据现有文献报道,量子点荧光猝灭主要有3种发生方式,分别是能量转移、电荷传递、表面吸附[32]。本研究中电子转移起着重要的作用:以巯基乙酸修饰合成的CdTe/CdS量子点表面带有羧基特征基团(-COOH),在pH7~8的中性或弱碱性环境中,羧基上的H+逐步解离使其表面带上负电荷(-COO-)[33],而带正电荷的Hg2+不仅会发生电子转移,而且会与羧基基团发生离子键合作用,从而被束缚在量子点表面,使量子点表面性质改变导致荧光量子产率降低,即发生荧光猝灭,从而实现了Hg2+的检测。
