吉西他滨联合大黄素对胰腺癌SW1990 细胞多耐药基因-1、miRNA-1271 及上皮-间充质细胞转化的影响
2020-04-30张旭程远方张江霞宋沛然张静
张旭,程远方,张江霞,宋沛然,张静
胰腺癌是世界范围内致死率较高的重度恶性消化系统癌症,病人多早期症状较为隐匿,疾病确诊时多已处于中晚期,多治疗效果不佳,5年生存率不及5%[1]。吉西他滨(Gemcitabin,GEM)是中晚期胰腺癌化疗的标准用药,但随着化疗期延长而逐步耐药,并具有一定的毒副作用,吉西他滨联用卡培他滨、奥沙利铂、5-FU 顺铂等虽能一定程度改善治疗效果,但疗效仍不理想[2-3]。因此,寻找一种能够降低胰腺癌细胞对吉西他滨耐药并提升其抑瘤效果的药物意义重大。在化疗过程中,多药耐药基因(multidrug resistance gene-1,MDR-1)是导致肿瘤细胞耐药和化疗失败的主要因素,MDR-1 编码的P 糖蛋白(P-gp)过表达而导致胰腺癌病人对多种化疗药物产生耐药[4]。同时,肿瘤细胞的侵袭转移与上皮-间充质细胞转化(cpithclial-mcscnchymal,EMT)有着显著相关性。大黄素本质为蒽醌类提取物,十多张抗肿瘤重要的有效活性成分,多项研究表明其能抑制肿瘤发展,促进肿瘤生长和凋亡[5]。本研究自2018年3月至2019年3月探究吉西他滨联合大黄素对胰腺癌SW1990 细胞增殖与侵袭的影响,并尝试初步分析联合应用增强胰腺癌治疗效果的可能机制。
1 资料与方法
1.1 细胞系与细胞培养 人胰腺癌细胞株SW1990由美国组织培养库(ATCC)提供。均培养于含100µg/mL 链霉素、100U/mL 青霉素和10%胎牛血清的RPMI1640 培养基中,37 ℃、5%二氧化碳培养箱中培养,至细胞单层贴壁生长融合70%~80%,胰蛋白酶消化传代。
1.2 药品、试剂和仪器 药品与试剂:胎牛血清、RPMI1640 及胰酶购自美国Gibco 公司;大黄素(emodin),购自美国Sigma 公司,用DMSO 配制成0.2 mol/L,终浓度<0.1%;吉西他滨购自法国礼来公司;Trizol 和MTT 试剂购自美国Sigma 公司;兔抗人Bcl-2 多克隆抗体及鼠抗人Bax 单克隆抗体购自美国Santa Cruz 公司;Caspase-3及Survivin 兔抗人单克隆抗体购自美国Abcam 公司;TWIST1、ZEB1、E-cadhcrin、β-actin 单克隆抗体购自美国CST 公司;Transwell 小室模型购自美国康宁公司;RT-PCR 试剂盒由中国吉麻制药技术有限公司提供。
仪器:Bio-Plex200 流式细胞仪及1658001 蛋白印迹电泳仪购自美国Bio-Rad公司,RD-PCR仪由西安天空科技有限公司提供,HH-CP-01W 二氧化碳细胞培养箱由上海兰仪实业有限公司提供。
1.3 细胞分组与处理 将处于生长对数期的SW1990 细胞分为大黄素组、吉西他滨组、大黄素联合吉西他滨组及对照组,大黄素组给予40µmol/L 大黄素处理SW1990/Gem 细胞,吉西他滨组给予20 µmol/L 吉西他滨处理SW1990/Gem 细胞,联合组给予与前等量大黄素和吉西他滨联合处理SW1990/Gem 细胞,对照组给予等量0.1%DMSO溶液。
1.4 流式细胞仪检测 (1)流式细胞仪检测细胞凋亡。96孔板每孔接种4×103的细胞过夜培养,细胞按照1.3分组处理48 h后,采用胰蛋白酶消化,1 000 r/min离心5 min,PBS冲洗2次,加入Binging Buffer重悬细胞,加入5µL PI 和5µL Annexin V-FITC,室温避光15 min,于激发波长488 nm、发射波长530 nm 上机检测,重复3次,采用Cell quest软件分析。
(2)流式细胞仪检测细胞膜糖蛋白(P-gp)阳性率。收集各组胰腺癌细胞调至1×107/mL备用,台盼蓝染色计数(>90%~95%),加入工作浓度(1∶50)PE标记荧光素抗体,以阴性SW1990 胰腺癌细胞做对照,室温孵育20 min,PBS冲洗2次,1 500 r/min离心3 min 弃去上清,PBS 冲洗2 次,加入300 mL PBS 重悬细胞,上机检测阳性率。
1.5 MTT 法检测细胞增殖 96 孔板每孔接种4×103的细胞过夜培养,细胞按照1.3分组处理48 h后,弃去上清,加入5 mg/mL的MTT溶液,培养4 h,弃掉培养液,加入150 µL DMSO 后震荡10 min,实验重复3 次,每组6 个重复,测定每孔光密度,计算细胞存活率。
1.6 Transwell 小室模型检测胰腺癌细胞侵袭能力 收集各组胰腺癌细胞调至1×105/mL 备用。将60 mg 于4 ℃冷藏过夜的Matrigel 胶取出放置在冰上,与无血清培养基混匀稀释,取60µL混合液加入Transwell 小室,于37 ℃5%二氧化碳培养箱孵育2 h,将200µL 预先备好的胰腺癌细胞悬液均匀加入Transwell小室底部膜上室面,下室面加入600µL的10%胎牛血清培养基,于37 ℃5%二氧化碳培养箱培养48 h,取出上室,弃去液体,4%多聚甲醛固定15~20 min,0.1%结晶紫染色40 min,PBS 冲洗静置干燥,×100显微镜下观察胰腺癌细胞穿透数量。
1.7 qRT-PCR 检测MDR-1、miRNA-1271及EMT相关标志物(TWIST1、ZEB1、E-cadhcrin)mRNA表达 (1)收集各组胰腺癌细胞,采用Trizol 试剂提取细胞总RNA,以RNA为模板逆转录合成cDNA,所有操作严格按照试剂盒说明书进行。反应体系:RNA 样本1µL,dNTPs(10 mmol/L)0.8µL,RT primers(1 µmol/L)1.3 µL,5×RT buffer 4 µL,MMLV Reverse TranscriptASC 0.3 µL,总 反 应 体 系20 µL,16 ℃30 min,42 ℃30 min,85 ℃10 min。
(2)RT-PCR反应体系:cDNA 1.33µL,无核酸酶水7.67µL、引物及探针混合物1.0µL、2×通用混合物10 µL,U6 及β-actin 基因作为内参,反应条件:95 ℃10 min,95 ℃15 s,60 ℃1 min,40个循环。
MDR-1 引物,正向:5′-GAATCTGGAGGAACACATGACC - 3′ ,反 向:5′ TCCAATTTTGTCACCAATTCC3′。
miRNA-1271 引 物,正 向:5′-CAGCACTTGGCACCTAGCA - 3′ ;反 向:5′ - TATGGTTGTTCTCCTCTCTGTCTC-3’。
TWIST1 引 物,正 向:5′ - AGCTGAGCAAGATTCAGACCCTCA-3′,反向:5′-CTGCAGCTTGCCATCTTGGAGT-3′。
ZEB1 引 物,正 向:5′ -GCACAACCAAGTGCAGAAGA-3′ ,反 向:5′ -CATTTGCAGATTGAGGCTG-3′。
E-cadhcrin 引物,正向:5′-AAGTGCTGCAGCCAAAGACAGA-3′,反向:5′-AGGTAGACCCACCTCAATCATCCTC-3′。
MDR-1、miRNA-1271、TWIST1、ZEB1及E-cadhcrin 相对表达量采用2-△△Ct计算,△△Ct=(待测组目的基因平均Ct 值-待测组内参基因平均Ct 值)-(对照组目的基因平均Ct 值-对照组内参基因平均Ct值)。
1.8 蛋白质免疫印迹法检测相关蛋白表达 收集各组胰腺癌细胞常规方法提取总蛋白,BCA法测定蛋白浓度,10%SDS-PAGE 凝胶电泳,将蛋白质转移至PVDF 膜,加入含5%脱脂奶粉Tris 缓冲液封闭2 h,加入Caspase-3、Survivin、TWIST1、ZEB1、E-cadhcrin 抗体孵育过夜,加入二抗孵育2 h,ECL 发光液显色。采用Bandscan 5.0 分析条带灰度值,并计算蛋白的相对表达量。目的蛋白相对表达量=目的条带灰度值/样本内参灰度值。
1.9 统计学方法 本研究实验数据采用SPSS 20.0统计学软件进行数据分析。观测资料主要为计量资料,多组间比较采用单因素方差分析+两两比较LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大黄素与吉西他滨单独及联合作用对胰腺癌SW1990 细胞凋亡、增殖及侵袭的影响 联合组可显著抑制胰腺癌SW1990 细胞增殖和侵袭,SW1990细胞凋亡率显著更高,与其他三组比较差异有统计学意义(P<0.05)。见表1。
表1 各组胰腺癌SW1990细胞凋亡、增殖及侵袭能力比较/

表1 各组胰腺癌SW1990细胞凋亡、增殖及侵袭能力比较/
注:与对照组比较,aP<0.05;与联合组比较,bP<0.05
组别对照组大黄素组吉西他滨联合组F值P值细胞侵袭/个244.4±9.1 175.3±9.5ab 192.0±8.6ab 105.8±7.8a 13.141 0.000细胞凋亡/%2.2±1.5 8.3±2.4ab 10.1±3.0ab 26.9±3.7a 14.622 0.000细胞增殖/%100.0±3.0 80.5±2.8ab 77.6±3.1ab 60.1±2.4a 9.850 0.000
2.2 RT-PCR 检测MDR-1、miRNA-1271 及EMT相关标志物表达 联合组MDR-1 mRNA显著降低,miRNA-1271 及E-cadhcrin mRNA 显著升高,且与其他组比较差异有统计学意义(P<0.05),各组TWIST1、ZEB1 mRNA 水平比较差异无统计学意义(P>0.05)。见表2。
表2 各组MDR-1、miRNA-1271及EMT相关标志物表达RT-PCR检测结果
表2 各组MDR-1、miRNA-1271及EMT相关标志物表达RT-PCR检测结果
注:与对照组比较,aP<0.05;与联合组比较,bP<0.05,MDR-1为多耐药基因-1,miRNA-1271为微小RNA-1271,EMT为上皮-间充质细胞转化
ZEB1 1.0±0.3 1.1±0.5ab 1.0±0.5ab 1.1±0.4a 0.988 0.326组别对照组大黄素组吉西他滨联合组F值P值MDR-1 3.6±0.7 2.2±0.3 2.3±0.4 1.3±0.1 20.572 0.000 miRNA-1271 0.3±0.1 1.1±0.3ab 1.0±0.4ab 3.8±0.8a 27.456 0.000 E-cadhcrin 0.6±0.2 1.1±0.4ab 0.9±0.3ab 2.8±0.5a 15.838 0.000 TWIST1 1.1±0.5 1.0±0.5ab 1.0±0.4ab 1.0±0.5a 0.894 0.374
2.3 流式细胞仪检测MDR-1编码的P糖蛋白(P-gp)阳性率 对照组、大黄素组、吉西他滨组与联合组P-gp 阳性率分别为(42.6±3.5)%、(28.4±2.9)%、(23.6±1.8)%、(13.3±1.8)%,联合组显著低于其他组,差异有统计学意义(F=12.777,P=0.000)。见图1。
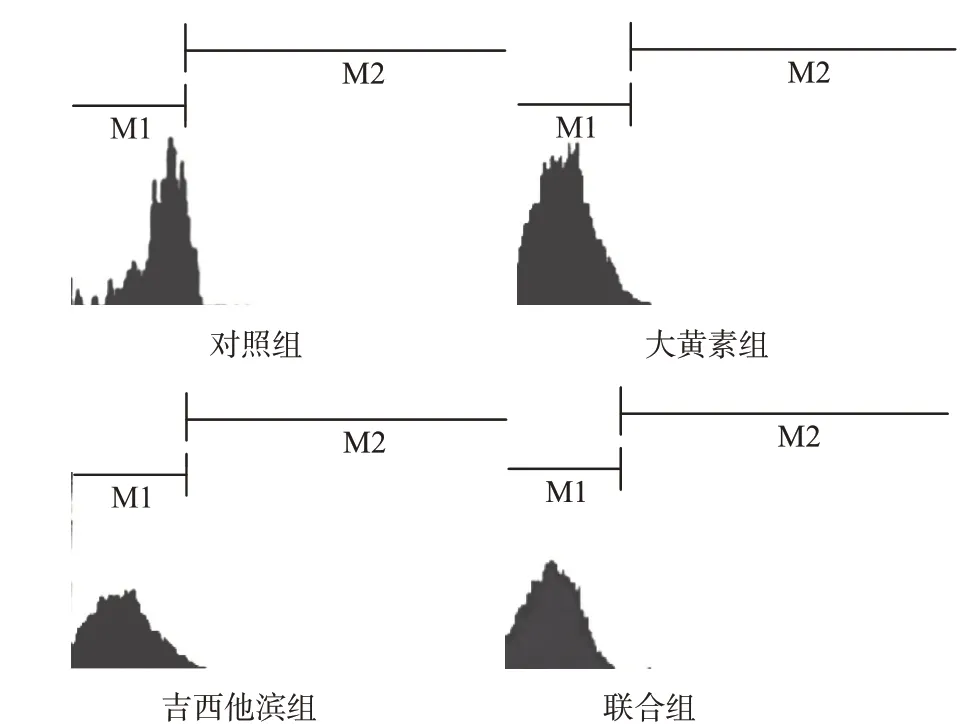
图1 流式细胞仪检测各组P糖蛋白表达情况
2.4 蛋白质免疫印迹法检测肿瘤组织凋亡相关蛋白及EMT 相关标志物蛋白含量 联合组可以显著抑制Bcl-2、Caspase-3 及Survivin 表达,上调Bax 表达,降低Bcl-2/Bax 比值,其效果明显高于吉西他滨组和大黄素组(P<0.05)。联合组E-cadhcrin 蛋白表达显著高于其他组,TWIST1、ZEB1蛋白表达显著低于其他组(P<0.05)。见表3,图2。

图2 各组蛋白质免疫印迹法检测结果:1为对照组,2为大黄素组,3为吉西他滨组,4为联合组
3 讨论
胰腺位于腹腔深侧,早期胰腺癌症状相对不明显,轻度症状容易被忽视,当疾病确诊时往往处于中晚期而错失了手术根除治疗的机会。手术治疗的病人往往远期效果不十分理想,容易发生远器官转移或复发。吉西他滨是晚期胰腺癌化疗的首选药物之一,但吉西他滨单一药物作用不能很好地与胰腺癌病人发生反应,吉西他滨与其他化疗药物合用岁能够提高肿瘤的治疗效果,但伴随着高药物毒性,病人的生存率和生存质量得不到明显改善[6]。研究中指出[7],多数恶性肿瘤存在不同程度的多药耐药。因此,寻找一种毒副作用较小的药物与吉西他滨联用,提升化疗对胰腺癌的作用效果,改善病人预后具有重大意义。大黄素是一种天然的化疗辅助药物,其能够抑制多种恶性肿瘤疾病进展,多项研究显示[8-10],大黄素可以增强顺铂、紫杉醇等多种药物对于恶性肿瘤细胞的诱导凋亡作用。本研究对大黄素增强吉西他滨治疗胰腺癌的效果并尝试分析了可能的机制。本研究结果显示,大黄素联合吉西他滨可显著抑制胰腺癌SW1990 细胞增殖和侵袭,SW1990 细胞凋亡率显著更高,与其他三组比较差异有统计学意义(P<0.05)。提示,大黄素在不增加吉西他滨剂量的条件下提升了吉西他滨对胰腺癌细胞的杀灭效率。细胞增殖和侵袭能力与细胞凋亡有着密切关系,恶性肿瘤细胞普遍存在细胞凋亡异常,大黄素联合吉西他滨能够诱导肿瘤细胞凋亡增加,进而遏制肿瘤的发生和发展。
化疗后获得性耐药是恶性肿瘤治疗效果不佳的重要原因[11]。本研究采用RT-PCR检测MDR-1基因水平和编码蛋白P-gp 水平,并通过蛋白质免疫印迹法检测肿瘤组织凋亡相关蛋白Bcl-2、Bax、Caspase-3 及Survivin 水平。结果显示,吉西他滨联合大黄素组MDR-1 mRNA、P-gp、Bcl-2、Caspase-3及Survivin 表达显著降低,Bax 表达显著升高,与其他几组比较差异有统计学意义(P<0.05)。研究显示[12-13],大黄素能够诱导肿瘤细胞产生活性氧(ROS),从而导致Bax 表达升高,Bcl-2 表达降低,导致线粒体Cytochrome C 大量释放进入胞质,激活Caspase3 活性,进而抑制细胞增殖,诱导细胞凋亡。Bcl-2 和Bax 表达异常输尿管是导致吉西他滨耐药的关键因素,NF-kB 能够调控肿瘤细胞Bcl-2、Bax、Caspase-3等细胞凋亡相关基因,进而一直肿瘤细胞凋亡。Survivin是NF-kB的下游蛋白,其能抑制Caspase 酶的活性从而抑制肿瘤细胞凋亡,在胰腺正常导管中机会不表达,在胰腺上皮内瘤或胰腺导管腺癌中表达明显上升。研究显示[14],吉西他滨等化疗药物作用于肿瘤细胞容易激活NF-kB 途径,导致肿瘤细胞对于吉西他滨治疗不敏感。因此,本研究推测大黄素能够通过降低NF-kB 活性,进而增强吉西他滨对于胰腺癌的敏感性,并上调Bax 表达,下调Bcl-2/Bax比值,促进胰腺癌肿瘤细胞凋亡。
人miR-1271 定位于ARL10 基因的第2 内含子区域,研究发现,miR-1271 在多种恶性肿瘤中低表达,上调miR-1271 可显著抑制肿瘤细胞增殖和侵袭,并抑制TWIST1、ZEB1、FOXQ1等蛋白表达,从而发挥抑制癌症发展的作用[15]。miRNA 除了参与癌

表3 各组肿瘤组织凋亡相关蛋白及EMT相关标志物蛋白质免疫印迹检测结果/x¯±s
细胞凋亡,还参与抑制EMT,EMT 是促进肿瘤细胞侵袭和转移的重要病理机制。E-cadhcrin、TWIST1、ZEB1 是肿瘤细胞EMT 进程发挥重要作用的转录因子,研究显示[16]TWIST1、ZEB1可作为胰腺癌恶性程度的重要指示指标。本研究中,在吉西他滨大黄素作用下,miRNA-1271 及E-cadhcrin mRNA显著升高,同时,联合组E-cadhcrin蛋白表达显著高于其他组,TWIST1、ZEB1蛋白表达显著低于其他组(P<0.05)。大黄素可以通过调节多种信号抑制恶性肿瘤的转移、侵袭,研究发现[17]大黄素可以调节miR-1271 表达抑制恶性肿瘤的恶性生物学行为。因此,大黄素不仅可以增强吉西他滨对于胰腺癌细胞的药效,还可以提高miRNA-1271水平,抑制胰腺癌细胞EMT转化,从而发挥抑制胰腺癌细胞侵袭迁移能力的效果。
