芍药色素对2型糖尿病合并非酒精性脂肪肝小鼠的保护作用
2020-04-29焦宏伟
焦宏伟
[海南省干部疗养院(海南省老年病医院)疼痛康复科,海口 571100]
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种与肥胖高度相关的代谢性疾病,长期的血糖增高会对心、脑、血管、神经系统、消化系统等带来严重损伤,甚至威胁到患者的生命[1-3]。临床研究发现,50%以上的T2DM合并有非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD),NAFLD会促进胰岛素抵抗,导致病情进一步加重[4-5]。
芍药色素是一种天然水溶性植物色素,属多酚类化合物,是花青素的一种。自然界中有数百种花青素,普遍具有抗炎、抗氧化等多种生物活性[6-7]。研究表明,黑豆种皮中提取的花青素能够降低T2DM小鼠的血糖和血脂水平[8],紫玉米中提取的花青素能够促进胰岛素分泌和加快肝脏对葡萄糖的吸收[9]。芍药色素对T2DM合并NAFLD的作用,笔者目前未见报道。
本实验研究了芍药色素对T2DM合并NAFLD小鼠的保护作用,并初步探讨了其作用机制,以期能为T2DM合并NAFLD的治疗寻找到更多天然的药物。
1 材料与方法
1.1实验动物 本研究采用的无特定病原体(SPF)级的C57BL/6雄性小鼠(8周龄),购自于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0011,饲养于海南医学院动物实验中心,使用许可证号:SYXK(琼)2012-0013。小鼠体质量20~25 g。所有实验用小鼠在实验前先正常喂养1周以适应环境。饲养环境保持温度在20~25 ℃,相对湿度50%±5%,每12小时交替明暗光照。所有小鼠均自由饮水与进食。
1.2试剂 实验用芍药色素采用氯化芍药色素-3-O-半乳糖(peonidin-3-galactoside,分子式C22H23ClO11,以下简称芍药色素,纯度>97%,批号:GY1195AF01)购自上海惠诚生物科技有限公司;小鼠胰岛素检测试剂盒(批号:PI602)、丙二醛(MDA)检测试剂盒(批号:032318180609)、超氧歧化酶(superoxide dismutase,SOD)检测试剂盒(批号:040418180613)、增强化学发光试剂(批号:101617171013)、辣根过氧化物酶标记的羊抗兔抗体(批号:A0208)均购自上海碧云天生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号:M180424-102a)、白细胞介素-6(IL-6)检测试剂盒(批号:M170912-004a)购自欣博盛生物科技有限公司;p-p65抗体(批号:16)、p-IkB抗体(批号:18)、β-actin抗体(批号:17)购自美国Cell Signaling Technology公司;高脂饲料按照基础饲料82%,猪油10%,胆固醇2.5%,胆酸钠0.5%,蔗糖5%的比例自配。
1.3实验方法
1.3.1动物建模及分组 参考文献[10-11],使用链脲佐菌素加高脂饲料建立T2DM合并NAFLD动物模型。48只C57BL/6小鼠,按数字表法随机选取8只作为正常对照组,给予普通饲料;其余40只小鼠喂食高脂饲料,持续喂养4周,之后腹腔注射使用柠檬酸盐溶液配制的链脲佐菌素(30 mg·kg-1)溶液,正常对照组小鼠注射等体积柠檬酸盐。3 d后高脂喂养小鼠静脉采血检测空腹血糖,若连续3 d空腹血糖大于11.1 mmol·L-1说明T2DM建模成功。继续给予高脂饲料至第8周末,建T2DM合并NAFLD模型小鼠。按照随机数字表法抽取建模成功小鼠,每8只为一组,分成模型对照组及芍药色素大剂量组、中剂量组、小剂量组,每天分别给予剂量为400,200,100 mg·kg-1芍药色素(蒸馏水溶解)灌胃,模型对照组及空白对照组用同体积的蒸馏水灌胃,继续给药6周后空腹采集小鼠血清,留取肝组织用于检测。
1.3.2血清生化检测 小鼠禁食12 h后眼球采血取血清,使用全自动生化分析仪,检测样本血清中总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、空腹血糖(fasting blood glucose,FBG)水平。使用胰岛素检测试剂盒,检测小鼠血清空腹胰岛素(fasting insulin,FINS)水平。
1.3.3炎症因子水平检测 使用ELISA试剂盒,检测血清中TNF-α、 IL-6水平。血清样本稀释后加入反应孔,加入抗体37 ℃孵育1 h。洗涤后,加入100 μL辣根过氧化物酶标记链霉亲和素溶液,避光25 ℃下孵育30 min,洗涤后加入TMB溶液孵育20 min,之后加入终止液。检测450 nm处的吸光度,与标准品对比,计算TNF-α、IL-6的浓度。
1.3.4氧化应激水平检测 取小鼠肝组织加0.9%氯化钠溶液制备肝组织匀浆,使用ELISA试剂盒,检测肝组织匀浆中MDA、SOD的含量。
1.3.5肝组织病理学变化 取小鼠肝组织标本置于4%多聚甲醛中固定,使用石蜡包埋并切片。使用苏木精-伊红(hematoxylin-eosin,HE)染色,通过400倍光学显微镜观察肝组织病理变化。
1.3.6Western blotting检测蛋白表达 提取小鼠肝组织蛋白,使用BCA试剂盒测定蛋白浓度。蛋白样品在浓度为10%的聚丙烯酰胺凝胶中电泳分离、转膜。之后加入5%脱脂奶粉封闭静置2 h,加入一抗后于4 ℃下过夜,加入二抗继续孵育2 h,采用ECL化学发光法显色成像。
2 实验结果
2.1一般情况对比 正常对照组小鼠活动状态好,进食及饮水情况正常,皮毛光泽整洁;模型对照组小鼠活动度明显减少,进食及饮水均增加,尿量增多、皮毛凌乱无光泽;芍药色素大剂量组、中剂量组、小剂量组各组小鼠的一般情况,与模型对照组比较,均有不同程度的改善。在注射链脲佐菌素4周后,模型对照组小鼠体质量增加不明显,但与正常对照组比较,体质量差异有统计学意义(t=8.93,P<0.05);芍药色素组小鼠的体质量较模型对照组降低(P<0.05),大剂量组降低最明显(t=5.98,P<0.05),结果见表1。
2.2血清生化学指标比较 如表1,与正常对照组对比,模型对照组小鼠血清中TC、TG、ALT、AST、FBG、FINS水平上升(t=32.29,32.53,44.07,39.59,46.23,10.31,P<0.05),与模型对照组比较,芍药色素大、中、小剂量组小鼠血清中相应生化指标均下降,差异有统计学意义,其中大剂量组下降最明显(t=21.28,18.93,31.42,29.07,34.56,6.89,P<0.05)。
2.3血清炎症因子水平比较 如表2,与正常对照组对比,模型对照组小鼠血清中炎症因子TNF-α、IL-6水平显著升高(t=50.44,34.32,P<0.05);与模型对照组比较,芍药色素大、中、小剂量组小鼠血清中TNF-α、IL-6水平均明显下降,差异有统计学意义,其中高剂量组下降最明显(t=43.48,22.76,P<0.05)。
2.4肝组织氧化应激水平比较 如表3,与正常对照组比较,模型对照组肝组织匀浆中MDA水平升高(t=12.58,P<0.05),SOD水平下降(t=22.32,P<0.05);与模型对照组比较,芍药色素大、中、小剂量组小鼠肝组织匀浆中MDA水平均明显下调、SOD水平均明显上升,差异有统计学意义,其中大剂量组差异最明显(t=7.63,18.21,P<0.05)。
2.5肝组织病理学改变 如图1,在显微镜下观察小鼠肝组织HE染色切片,正常对照组肝小叶结构正常,无明显肝细胞脂肪变性及炎症细胞浸润;模型对照组小鼠肝组织可见弥漫性肝细胞脂肪变性且有大量炎症细胞浸润;与模型对照组比较,芍药色素大、中、小剂量组小鼠肝细胞脂肪变性及炎症细胞浸润均有不同程度地减轻,其中大剂量组改善最显著。
2.6肝组织NF-κB蛋白活化水平 如图2,模型对照组肝组织代表NF-κB活性水平的p-p65、p-IkB蛋白表达水平与正常对照组比较明显上调,芍药色素组相应蛋白表达水平与模型对照组比较明显下调。
3 讨论
T2DM与NAFLD高度相关[12-13],T2DM可进一步引发NAFLD,而NAFLD也会诱导T2DM的发生[14]。这与T2DM可引起胰岛素抵抗促进肝脏脂质沉积,过量脂质沉积加剧脂质氧化又可促进胰岛素抵抗有关。T2DM与NAFLD之间的相互作用,会导致疾病进一步加重,威胁生命健康[15]。
T2DM合并NAFLD的发病机制目前还没完全明确,已有研究表明糖毒性、脂毒性及其引发的慢性炎症是其重要发病机制[16]。肝脏是脂肪代谢的主要场所,过量脂肪的代谢会产生过量的氧自由基,氧自由基引起细胞脂质过氧化,从而引起氧化应激反应和炎症因子浸润,持续的炎症进一步会诱发胰岛素抵抗,从而导致T2DM合并NAFLD疾病进展[17]。因此抗炎、抗氧化是治疗T2DM合并NAFLD的重要途径。
芍药色素是花青素中的一种,是常用的食品添加剂。花青素类化合物普遍具有抗炎、抗氧化的作用[18-19]。本研究中给予芍药色素干预的小鼠,血清中TNF-α、IL-6、MOD水平明显下降,SOD水平上升,结果表明芍药色素对T2DM合并NAFLD小鼠有抗炎、抗氧化的作用。生化学指标检测显示,芍药色素干预后,小鼠血清中TC、TG、ALT、AST水平显著下降。小鼠肝组织HE染色结果显示肝细胞脂肪变性以及炎症细胞浸润显著减少,以上结果提示芍药色素对T2DM合并NAFLD小鼠具有保护作用。
NF-κB是机体中调节TNF-α、IL-6等炎症因子的重要转录因子,p65是NF-κB蛋白重要的亚型,磷酸化IkB激活NF-κB,从而使其发挥转录活性[20-21]。研究发现,草莓和桔梗中提取的花青素,能够通过NF-κB通路来抑制小鼠的炎症[22]。本实验结果发现,芍药色素能够下调T2DM合并NAFLD小鼠肝组织中p-IkB、p-p65的表达。提示芍药色素可能通过NF-κB信号通路来调节炎症因子的分泌,从而发挥抗炎作用。
表1 5组小鼠体质量及血清生化指标
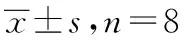
组别体质量/gTCTGFBG(mmol·L-1)ALTAST(U·L-1)FINS/(mU·L-1)正常对照组24.26±0.851.348±0.2131.215±0.1876.872±0.52626.427±4.56235.764±5.25912.457±1.036模型对照组28.85±1.18①6.351±0.383①5.126±0.284①18.326±0.463①215.295±11.231①184.672±9.247①21.879±2.367①芍药色素 小剂量组26.95±1.29②4.264±0.227②3.569±0.246②13.245±0.387②95.478±5.893②87.882±6.721②17.478±1.875② 中剂量组26.37±1.56②3.112±0.217②2.958±0.273②12.458±0.318②81.342±6.775②75.354±5.732②15.578±1.679② 大剂量组25.23±1.24②2.876±0.258②2.536±0.263②11.182±0.357②76.788±5.421②66.544±6.825②15.268±1.327②
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05。
①Compared with normal control group,P<0.05;②compared with model control group,P<0.05.
表2 5组小鼠血清炎症因子水平
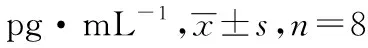
组别TNF-αIL-6正常对照组42.471±4.56824.513±3.376模型对照组235.665±9.823①125.788±7.633①芍药色素 小剂量组82.364±5.679②68.385±5.234② 中剂量组75.324±4.236②58.572±4.281② 大剂量组71.677±4.163②53.321±4.782②
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05。
①Compared with normal control group,P<0.05;②compared with model control group,P<0.05.
表3 5组小鼠肝组织氧化应激水平
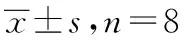
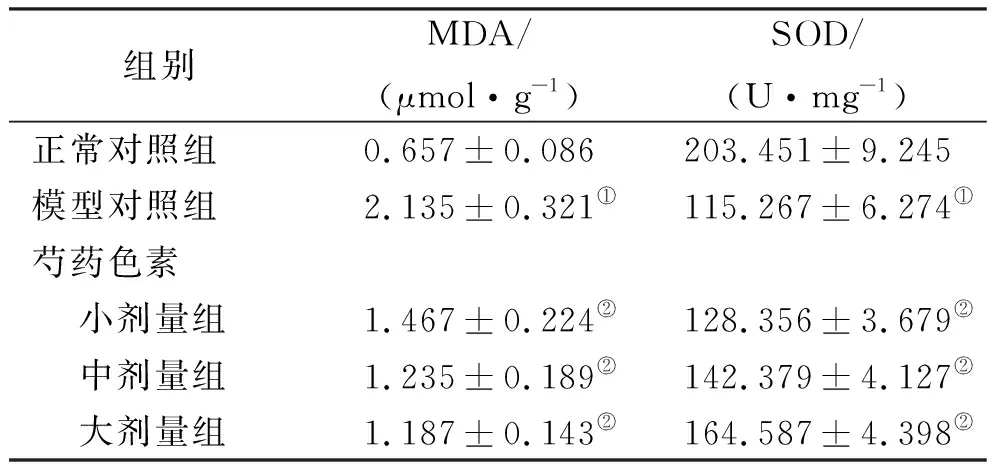
组别MDA/(μmol·g-1)SOD/(U·mg-1)正常对照组0.657±0.086203.451±9.245模型对照组2.135±0.321①115.267±6.274①芍药色素 小剂量组1.467±0.224②128.356±3.679② 中剂量组1.235±0.189②142.379±4.127② 大剂量组1.187±0.143②164.587±4.398②
①与正常对照组比较,P<0.05;②与模型对照组比较,P<0.05。
①Compared with normal control group,P<0.05;②compared with model control group,P<0.05.
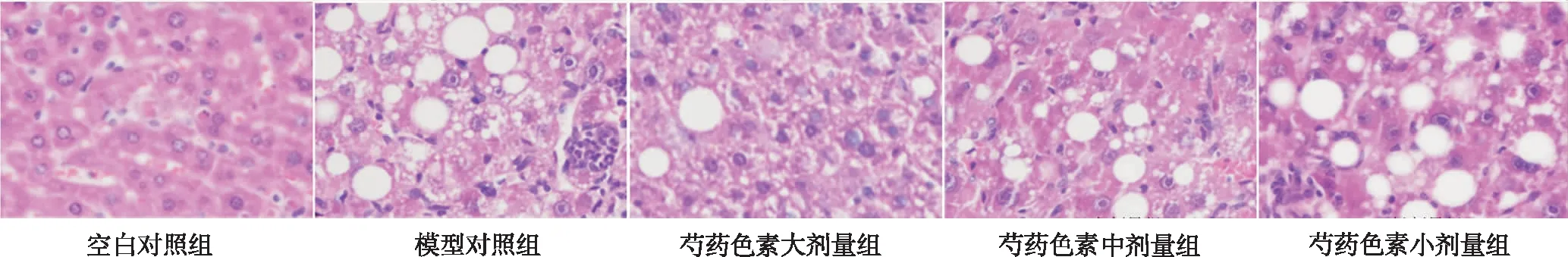
图1 5组小鼠肝组织HE染色(×400)
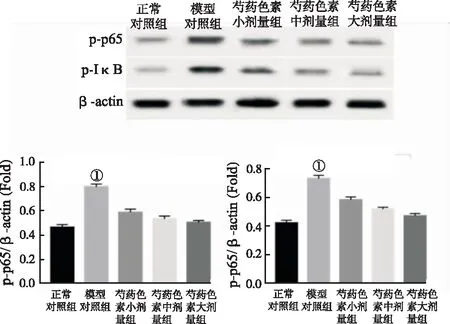
①与模型对照组比较,P<0.01。
图2 5组小鼠NF-κB蛋白活化水平
①Compared with model control group,P<0.01.
Fig.2TheproteinexpressionofNF-κBinfivegroupsofmice
综上所述,芍药色素对T2DM合并NAFLD小鼠具有抗炎、抗氧化、调节血糖和胰岛素的作用,进一步研究提示芍药色素可能是通过NF-κB通路来发挥抗炎作用的。虽然目前的研究未能明确芍药色素介导NF-κB通路的具体机制,但表明芍药色素可能是治疗T2DM合并NAFLD的一个潜在的药物,作为常用的食品添加剂,芍药色素在饮食和健康领域可以发挥更大的作用。
