海洋放线菌抗肿瘤活性物质的研究进展
2020-04-27苏雨欣庞启华
丁 衍,苏雨欣,庞启华
广东省药食生物资源加工及综合利用工程技术研究中心 华南师范大学生命科学学院,广州 510631
放线菌(actinomycete)是一类革兰氏阳性菌,隶属放线菌门。放线菌与人类关系密切,据统计,在已知的超过33500种的微生物次生代谢产物中,40%以上由放线菌产生[1],已发现的天然抗生素中,70%以上来源于放线菌[2],如庆大霉素、红霉素、头孢菌素和利福霉素等。此外,一些放线菌的次级代谢产物还在临床上作为抗肿瘤药物,如蒽环类(阿霉素)、肽类(博来霉素和放线菌素D)等[3]。主要的药用放线菌包括链霉菌(Streptomyces)、小单孢菌(Micromonospora)、红球菌(Rhodococcus)等。研究表明,大部分药用放线菌来源于链霉菌属,大约7 600种化合物是由链霉菌产生的,这使得链霉菌成为制药工业的主要生产微生物[4]。随着抗生素的过度使用和病原体耐药性的出现,寻找新的抗生素成为药物研究的重要目标之一。20世纪60年代以来,人们将药物研发的关注点转向海洋[5]。由于海洋独特的生存环境,如高压、低温、缺乏光照以及不同的盐度和氧浓度[6],使海洋放线菌产生了特有的活性代谢产物,为药物开发提供了新资源[7]。本文以种属为主线对2015年以来报道的具有抗肿瘤活性代谢物的海洋放线菌进行综述(表1)。
1 链霉菌属
链霉菌属种类丰富、分布广泛,据2011年统计,该属包含560多个生效发表种、38个亚种[8],利用链霉菌生产了大量的抗生素,如红霉素、链霉素和四环素等,链霉菌在海洋放线菌中占据了重要的地位。
链霉菌属放线菌大部分来源于海洋沉积物。角环素类(angucyclinone)化合物是众多链霉菌活性物质中的一种,角环素糖苷是由糖与一个含苯并蒽醌的四环骨架组成,糖基与四环以碳碳键连接[9]。结构-活性关系(SAR)研究表明,角环素糖苷类(angucycline glycosides)化合物的二糖部分中酮基和C-2″-O-C-3′的连接对肿瘤细胞的抑制起决定性作用[10]。Song等[10]、Zhu等[11]和Lai等[12]均从链霉菌中分离出角环素糖苷类化合物,分别命名为marangucycline B(1)、grincamycin H(2)、grincamycin J(3)(图1)。化合物1对肺癌细胞(A594)、鼻咽癌细胞(CNE2)、肝癌细胞(HepG2)和乳腺癌细胞(MCF-7)均有抑制作用,IC50在0.24~0.56 μmol/L之间;化合物2对人外周血白血病T细胞(Jurkat)增殖有抑制作用,IC50为3.0 μmol/L;化合物3对乳腺癌细胞(MDA-MB-435、MDA-MB-231)、肺癌细胞(NCI-H460)、结肠癌细胞(HCT116)和HepG2以及人正常乳腺上皮细胞(MCF10A)显示出细胞毒性,IC50在0.4~6.9 μmol/L之间。另外,从中国胶州湾沉积物分离的菌株S.griseusM268中获得角环素类化合物grisemycin(4),该化合物是第一次发现具有醚桥且含硫的角环素类化合物,对早幼粒白血病细胞(HL-60)的IC50为31.54 μmol/L[13]。
肽类化合物(peptides)由氨基酸通过肽键相连而成,可通过破坏肿瘤细胞膜脂肪酸、阳离子载体或离子通道的形成等方式,导致肿瘤细胞膜渗漏孔道的形成,诱导肿瘤细胞凋亡[14]。有研究报道从海洋沉积物的链霉菌中分离出肽类活性物质,它们对肿瘤细胞的IC50普遍较低,显示出较强的抑制作用。Aftab等[14]从菌株SSA 13发酵液中获得环状脂肽iturin A6(5),这是首次从链霉菌中得到有抗肿瘤活性的iturin家族成员,它对宫颈癌细胞(HeLa)、MCF-7和HepG2显示出抗肿瘤活性,IC50分别为1.73±0.9、6.44±0.6和8.9±1.09 μg/ mL;Wang等[15]从菌株S.heliomycini中分离出放线菌素X2(6),对MCF-7、人慢性粒细胞白血病细胞(K562)和肺癌细胞(A549)的IC50在0.8~1.8 nmol/L之间,但对人正常肝细胞(L02)的毒性较低。从印度钦纳穆塔姆海岸(Chinnamuttam)海洋沉积物的菌株ICN19中分离出肽类化合物ala-geninthiocin(7),对A549的IC50为6 nmol/L[16]。除了海洋沉积物之外,研究者还从海绵Gelliodescarnosa来源的链霉菌LS298中发现了肽类抗肿瘤活性物质,1个新的棘霉素quinomycin G(8),对Jurkat细胞的IC50为0.414 μmol/L[17]。从中国三亚海岸采集的海绵来源菌株S.spongiicolaHNM0071T的发酵液中分离出肽类化合物棘霉素,该研究还首次报道了来自海绵的放线菌的全基因组序列[18]。
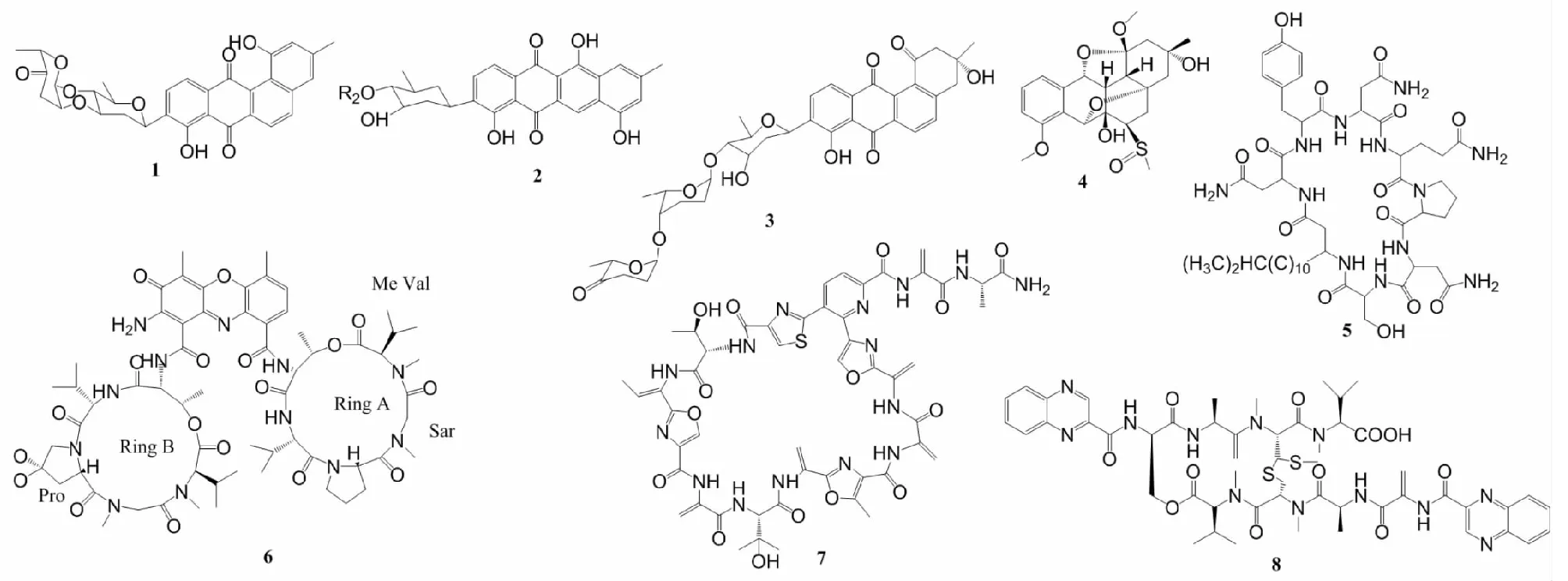
图1 化合物1~8的结构Fig.1 Structures of compounds 1-8
吲哚并咔唑(indolocarbazole)是咔唑的衍生物,此类化合物含有吲哚环与咔唑环稠合的基本骨架,因其可变的化学结构和优异的生物活性在化学和生物领域引起了广泛的关注[19]。从浙江省洞头县海洋沉积物里的链霉菌菌株A68,以及其利福平抗性突变株R-M1的发酵液中分离纯化出3个新型吲哚并咔唑类似物(indolocarbazole analogues)(9~11)(图2),它们对PKCα、ROCK II和BTK均表现出较强的激酶抑制活性,IC50在0.17~3.24 μmol/L之间,此外,它们均对前列腺癌细胞(PC-3)有抑制作用,IC50分别为0.80、6.2和1.5 μmol/L[20]。
生物碱(alkaloids)大多为复杂的环状结构,且含氮,星形孢菌素是一种具有吲哚并咔唑结构的生物碱[21]。从浙江省宁波市海洋沉积物中获得的菌株NB-A13里分离出5个新的(12~16)和8个已知的(17~24)星形孢菌素衍生物,其中化合物12~16,18~24对PC-3和人结肠癌细胞(SW620)表现出细胞毒性,IC50的范围是0.02~16.60 μmol/L,除此之外,化合物12~17还表现出对蛋白激酶PKC-θ有抑制作用,IC50在0.06~9.43 μmol/L之间[22]。Davies-Bolorunduro等[23]从拉各斯泻湖(Lagos Lagoon)沉积物来源的菌株S.bingchenggensisULS14中获得了2个抗肿瘤化合物,命名为ULDF4(25)和ULDF5(26),它们的化学结构均与星形孢菌素相似,对HeLa、胃癌细胞(AGS)、MCF-7、K562、HL-60表现出抗癌活性,IC50范围为0.030~4.4 mg/mL。
抗霉素是一种天然的生物碱类抗生素,红树林来源的链霉菌菌株THS-55含有4个新抗霉素antimycin E-H(27~30),均由一个与3-甲酰胺基水杨酸单元相连的大环组成,它们对HPV感染的HeLa的IC50的范围为0.8~13.8 μmol/L[24]。红树林的链霉菌菌株CHQ-64产生杀粉蝶素F(piericidin F,31),对HeLa的IC50为0.003 μmol/L,此外,它还对急性早幼粒细胞白血病细胞(NB4)、A549和肺癌细胞(H1975)显示出抑制作用,IC50分别为0.037、0.56和0.49 μmol/L[25]。Che等[26]从中国西沙海域的海绵来源的菌株CHQ-64中分离出化合物drimentine I(32),1个新型杂合异戊二烯生物碱,分子结构里具有通过两个桥联形成的罕见的七环骨架,其对HeLa的IC50为16.73 μmol/L。
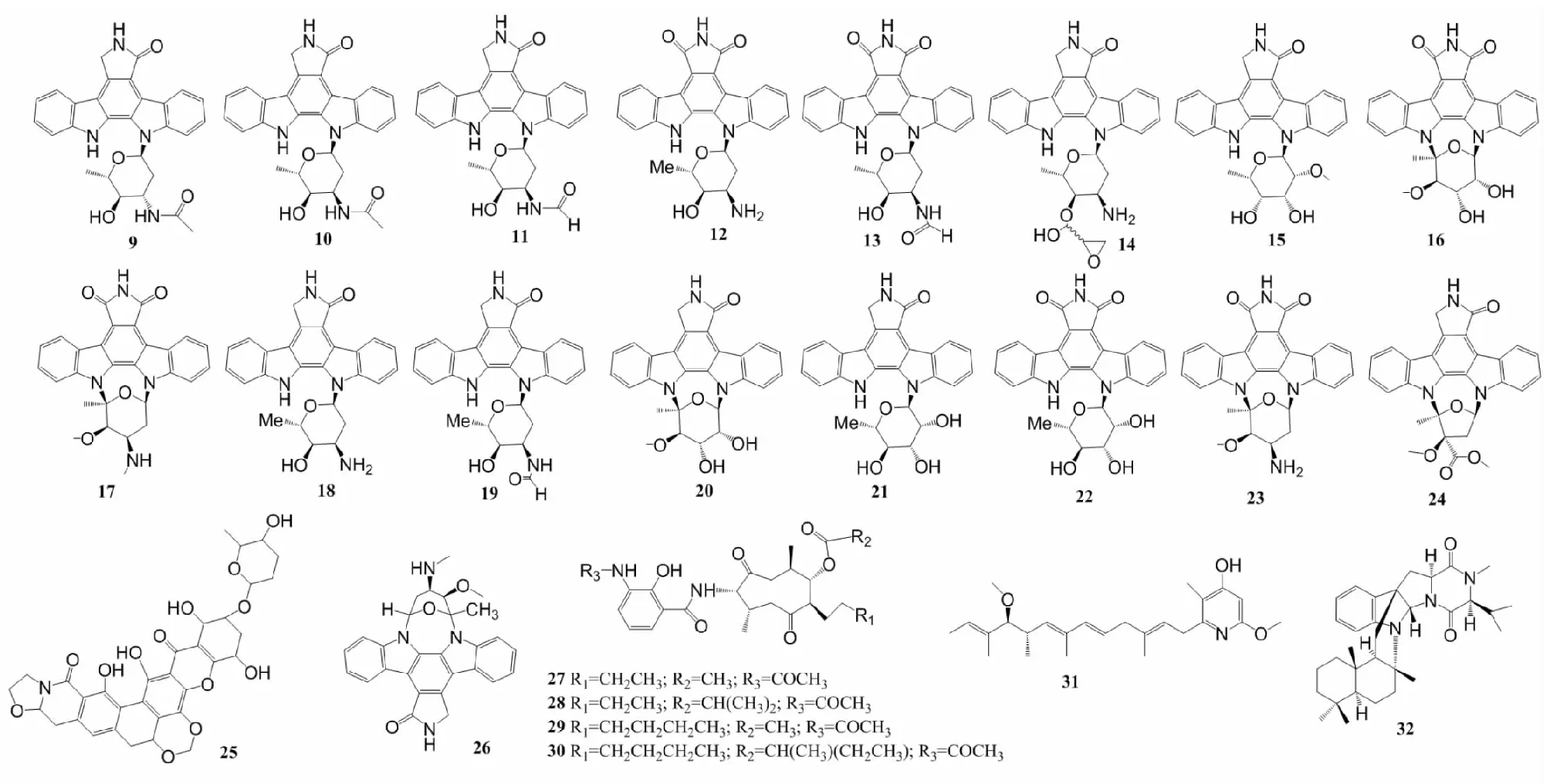
图2 化合物9~32的结构Fig.2 Structures of compounds 9-32
大环内酯类(macrolides)化合物的分子结构由12~16碳内酯环以及配糖体组成[21],通过竞争性结合肿瘤细胞耐药基因的代谢产物P-糖蛋白,抑制肿瘤细胞粘附能力,增加细胞因子的抗癌活性等机制,产生抗癌活性[27]。从红树林来源链霉菌中分离出1个新洋橄榄叶素衍生物halichoblelide D(33)(图3),对HeLa和MCF-7的IC50分别为0.30 μmol/L和0.33 μmol/L[28]。不少来源于海洋动植物的链霉菌中也分离出大环内酯类化合物,Braa等[29]在坎塔布连海海藻Ulvasp.来源的菌株S.althioticusMSM3中分离出了1个新型沙漠霉素(desertomycin):沙漠霉素G(34),对MCF-7、A549以及结肠癌细胞(DLD-1)的IC50范围在3.8~8.7 μmol/L。研究者从海藻来源菌株HZP-2216E的浸提物中获得2个巴弗洛霉素(bafilomycins),分别命名为21,22-en-bafilomycin D(35)和21,22-en-9-hydroxybafilomycin D(36),它们对胶质瘤细胞U251和C6的IC50在0.12~1.08 μmol/L之间[30]。
Pérez等[31]从太平洋瓜达鲁普岛的多毛动物中获得菌株GUA-06-05-006A,从其培养液中分离出2个新的大环内酯类化合物PM100117(37)和PM100118(38),这2个化合物侧链含有3种脱氧糖和1,4-萘醌生色团,对肿瘤细胞的不同抑制作用可归因于侧链上存在的不同糖单位,它们对A549、MDA-MB-231和结肠癌细胞(HT29)的IC50范围在0.7~9.2 μmol/L。Hu等[32]分离出3个新型尼菲霉素(niphimycin),分别命名为niphimycin C(39)、niphimycin E(40)和17-O-methylniphimycin(41),它们对HeLa细胞的IC50范围是3.0~9.0 μmol/L。
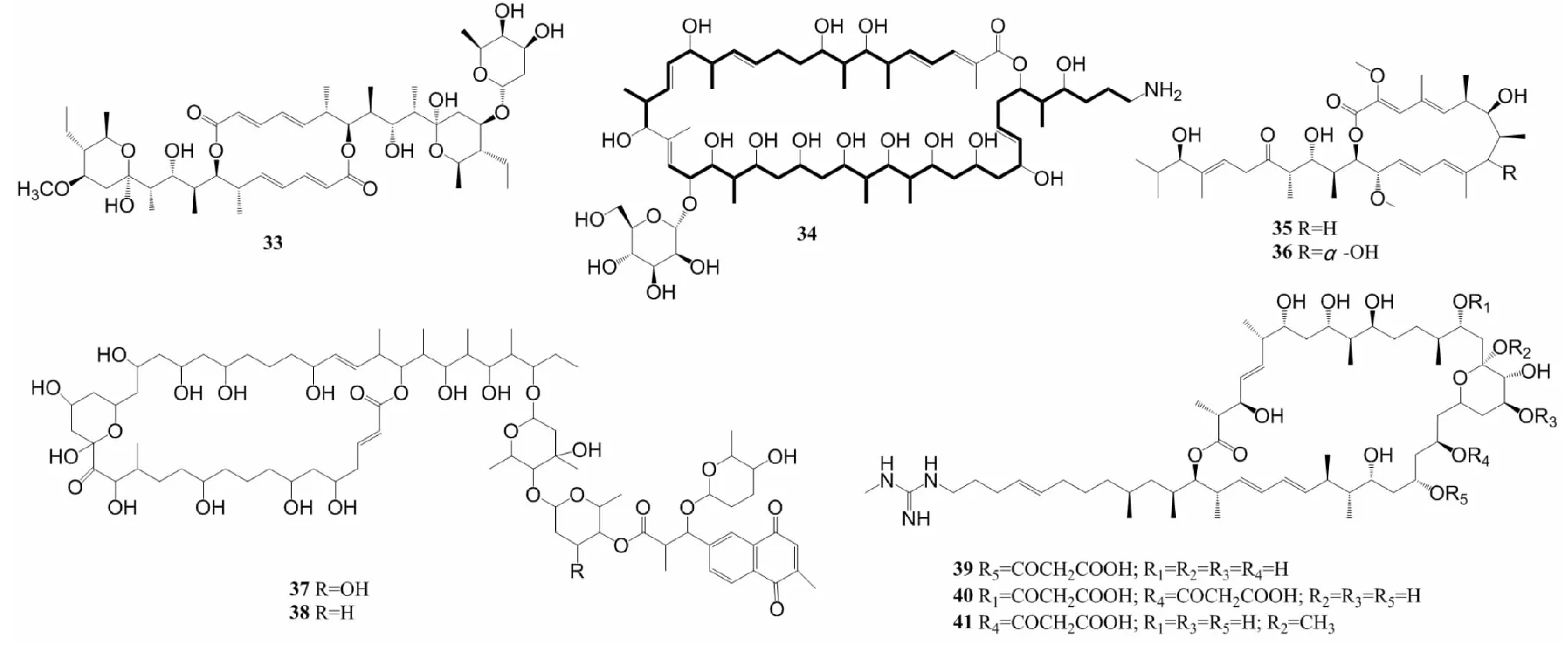
图3 化合物33~41的结构Fig.3 Structures of compounds 33-41
除了大环内酯之外,研究者从红树林来源的菌株S.antibioticussp.H12-15中分离出2个新的苯甲酰胺类九元环双内酯类(benzamido nine-membered dilactones)化合物neoantimycins A(42)和neoantimycins B(43)(图4),它们是首次发现经修饰的天然来源抗霉素A(ANTs),对人神经癌细胞(SF-268)的IC50分别为33.6和41.6 μg/mL[33]。Chen等[34]获得红树林来源链霉菌的苯酚酯类化合物(phenol ester)bagremycin B(44)和新化合物bagremycin C(45),化合物44具有N-乙酰基-(S)-半胱氨酸结构,化合物45对胶质瘤细胞(U87MG)有丝分裂的G0/G1周期有抑制作用。它们对U87MG、U251、SHG44和C6四种胶质瘤细胞的IC50分别在7.3~13.3 μmol/L和2.2~6.4 μmol/L范围内。
二酮哌嗪类(diketopiperazines)化合物为环二肽结构,即两个氨基酸缩合而成的最小的环肽,且具有稳定的六元环骨架[35],该类化合物可通过抑制肿瘤细胞有丝分裂M周期[36]、抑制DNA拓扑异构化酶Ⅱ活性[37]、诱导细胞凋亡等机制来抑制肿瘤[38]。Qu等[39]从烟台逛荡河入海口沉积物来源的菌株223中分离到1个新型二酮哌嗪类化合物,鉴定为(3S)-(1,4)-二甲基-3-异丙基-(2,5)二酮哌嗪(46),对HeLa细胞的IC50为18.7 μmol/L。
萜类(terpenoids)化合物由异戊二烯或异戊烷单元组成[21],在致癌的起始阶段可防止致癌物与DNA的相互作用,在促进阶段可抑制癌细胞的发育和迁移[40]。Martucci等[41]在美国旧金山湾潮滩沉积物中分离得到的菌株CNQ509中获得2个新的萜类化合物naphthablins B(47)和C(48),在浓度为33 μmol/L时,对HeLa细胞的抑制率分别为25%和32%。
醌类(quinones)化合物是具有不饱和的环二酮结构或容易转变成该结构的天然有机成分[21],该类化合物可作用于肿瘤细胞DNA,如产生自由基导致肿瘤细胞DNA损伤、DNA烷基化、DNA交联或抑制拓扑异构酶II的活性[42]。从海洋沉积物来源链霉菌分离的并四苯醌类化合物sharkquinone(49),在10 μmol/L时能减少AGS对肿瘤坏死因子诱导的凋亡配体(TRAIL)的抗性,对AGS的IC50为7.3 μmol/L[43]。除此之外,研究者从中国西沙海域的海绵分离的菌株HDN-10-293中分离出醌类化合物naquihexcins A(50),化合物50结构中具有不饱和己糖醛酸,可抑制对阿霉素具耐药性的人乳腺癌细胞(MCF-7 ADM)的增殖,IC50为16.1 μmol/L[44]。
从链霉菌中还获得了其它化合物,如从地中海海绵来源菌株SBT345中分离出1个新的吩恶嗪类化合物(phenoxazin)strepoxazine A(51),它对HL-60的IC50为8.3 μmol/L[45]。从菌株H74-21获得的化合物streptomyceamide C(52),对MCF-7的IC50为27.0 μmol/L[46]。有报道显示,一些链霉菌含有的活性物质,比现有的抗癌药物具有更佳的抗癌效果。El-Naggar等[47]从埃及亚历山大港西部分离了菌株AMS11,其培养上清液对HepG2的IC50为1.24±0.56 μmol/L,比治疗肝癌的常用药物5-氟尿嘧啶显示更强的抗癌效果。
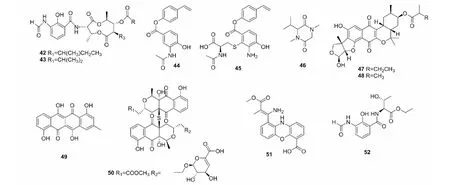
图4 化合物42~52的结构Fig.4 Structures of compounds 42-52
2 稀有放线菌
稀有放线菌是链霉菌属以外种类较少的放线菌类群。其中,小单孢菌属的分离频率仅次于链霉菌属,是一类好氧、不抗酸的革兰氏阳性菌,能产生庆大霉素等抗生素。据2017年统计,该属共有72个种和7个亚种[48]。Gong等[49]从小单孢菌株MicromonosporacarbonaceaLS276的发酵液中分离出2个spirotetronate糖苷类化合物tetrocarcin A(53)和arisostatin A(54)(图5),spirotetronate类化合物是由一个螺原子相连的两个环状结构组成[50],化合物53、54对HepG2、HCT116、A549和人胃癌细胞(BGC823)的IC50范围为5.33~19.7 μmol/L,此外它们对U87MG的IC50分别为0.50和2.42 μmol/L。Sarmiento-Vizcaíno等[51]从坎塔布里亚海阿维峡谷2000米深海沉积物来源的小单孢菌株M.matsumotoenseM-412中分离出保洛霉素G(55),这是首次从小单孢菌属菌种中分离出保洛霉素(paulomycin)的家族成员。化合物55对HepG2、MCF-7和人胰腺癌细胞(MIAPaCa-2)均具有细胞毒性,IC50在1.46~4.72 μmol/L之间。
从中国东海岸土壤来源的小单孢菌菌株FIM05328中分离出1个新的大环内酰胺(macrolactams)化合物FW05328-1(56),大环内酰胺类化合物是十二元环及以上且含有一个或多个酰胺键的化合物[52],化合物56对人食道癌细胞(EC109)具有很强的抑制作用,IC50为0.000 20 μmol/L[53]。梅显贵等[54]从山东威海的海泥中得到异壁放线菌菌株ActinoalloteichuscyanogriseusWH1-2216-6,从其浸提物中获得1个新的多环稠合大环内酰胺类化合物(polycyclic tetramate macrolactams,PTMs)16-hydroxymaltophilin(57),PTMs结构由大环内酰胺环(macrolactam ring)和多环稠合的三环结构(carbocyclic ring)组成[55],化合物57对HCT116、MCF-7、Jurkat细胞、人胰腺癌细胞(BXPC-3、PANC-1)以及L02的IC50在24.3~29.9 μmol/L范围内。
聚酮类(polyketides)化合物是一类由低级羧酸通过脱羧反应形成的聚酮链骨架,经过环化,芳香化或与脱氧糖等结构单位连接而形成的化合物[56]。Yang等[57]从日本Sagami海湾800 m深海水来源的野野村氏菌菌株AKA32中分离出1个新的聚酮类化合物akazamicin(58)和2个已知化合物actinofuranone C(59)、N-formylanthranilic acid(60),它们对小鼠黑色素瘤细胞株(B16)的IC50分别为1.7、1.2和25 μmol/L。从中国大连黑石礁海湾沉积物里的糖丝菌属菌株10-10中提取出新的聚酮类化合物saccharothrixone D(61),对HepG2的IC50为7.5 μmol/L[58]。
据报道,从中国广东汕尾海参Holothuriamoebii泄殖腔中获得的假诺卡氏菌菌株HS7的浸提物中分离出一个新的大环内酯类化合物curvularin-7-O-α-D-glucopyranside(62),具有α-D-吡喃葡萄糖取代基。该化合物对U251、结肠癌细胞(SW620、HCT-15)都表现出细胞毒性,IC50在20.8~32.2 μmol/L之间,另外还分离出2个已知化合物(11S,15R)-11-hydroxycurvularin(63)、(11R,15)-11-hydroxycurvularin(64)、trans-dehydrocurvularin(65)、curvularin(66),以及2个化合物curvularin的酰基产物(67和68)(图6),化合物62~65、67、68对SW620、HCT-15以及胶质瘤细胞C6、U87MG、SHG-44、U251均表现出抑制作用,其中化合物65表现出较强的细胞毒性,IC50值在0.59~3.39 μmol/L之间[59]。
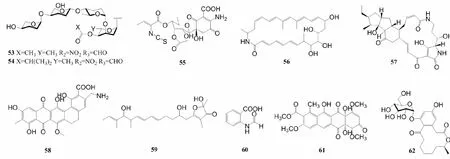
图5 化合物53~62的结构Fig.5 Structures of compounds 53-62
在巴西圣彼得和圣保罗群岛沉积物来源的马杜拉放线菌菌株BRA 177的乙酸乙酯粗提物中分离出3个红色素类(red pigments)化合物nonylprodigiosin(69)、cyclononylprodigiosin(70)和methylcyclooctilprodigiosin(71),它们对HCT116、MCF-7、黑色素瘤细胞(SK-Mel-147)、人胚肺成纤维细胞(MRC-5)等的IC50范围为0.26~4.25 μmol/L[60]。
Sun等[61]从深海沉积物来源的拟诺卡氏菌菌株YIM M13066中分离出2个新的二酮哌嗪类化合物nocazine F(72)和nocazine G(73),它们对U251、MCF-7、肺癌细胞(H1299)、HeLa、PC-3和人肝正常细胞(HL7702)均有抑制作用,除了nocazine G对U251的IC50大于40 μmol/L之外,nocazine F和nocazine G对其它肿瘤细胞均有较强的抑制作用,IC50值在2.60~22.5 μmol/L范围内。El-Naggar等[47]分离出2株新的拟诺卡氏菌菌株AMS10A和AMS10B,它们的上清液对HCT116或HepG2的作用与阳性对照药物5-氟尿嘧啶相比,显示出更好的抗癌效果,其中菌株AMS10A的上清液对HepG2的IC50为0.74±0.47 μmol/L,菌株AMS10B的上清液对HCT116的IC50为2.53±2.49 μmol/L。
3 具有选择性抗肿瘤活性化合物的放线菌
一些放线菌的活性化合物对肿瘤细胞有抑制作用,但对正常的组织细胞没有明显毒性,对抗肿瘤表现出选择性。从糖丝菌属菌株Saccharothrixsp.中分离出芳香族聚酮类化合物tetracenomycin X(74),该化合物通过下调细胞周期蛋白D1引起的细胞周期停滞,发挥抗肿瘤活性,该化合物对H157、H1975、HCC827、H460和A549五种肺癌细胞有抑制作用,但几乎不影响肺成纤维细胞的增殖,表现出选择性抗肿瘤作用,其中对A549和H460细胞的IC50分别为7.58±2.21和0.60±0.26 μmol/L[62]。从海葵(Haliplanellalineata)来源的链霉菌菌株ZZ406中分离出1个新的蒽醌类衍生物(anthraquinone derivative)化合物(75),对神经胶质瘤细胞U87MG、U251和SHG44的IC50在4.7~8.1 μmol/L之间,选择性指数高(>12.3~21.3),具有成为抗神经胶质瘤新药的潜力,有较高的研究价值[63]。另外,从泰国安达曼海海绵获得的链霉菌菌株GKU 220中分离出新的肽类化合物rakicidin F(76)对鼠结肠癌细胞(26-L5)有选择性抑制作用,IC50为17 μmol/L[64]。从鹿角珊瑚(Acroporaformosa)分离的小单孢菌菌株M.marinaKJ816786中得到高效生物表面活性素(surfactin),经鉴定,表面活性素含有脂肪酸(-CH3CH2-)、棕榈油酸、脂肽单酯和芳香族质子和碳,它通过切割线粒体膜电位诱导肿瘤细胞凋亡,对MCF-7的IC50为50 μg/mL,而对正常细胞系不产生明显毒性[65]。放线菌抗肿瘤化学物质汇总表见表1。
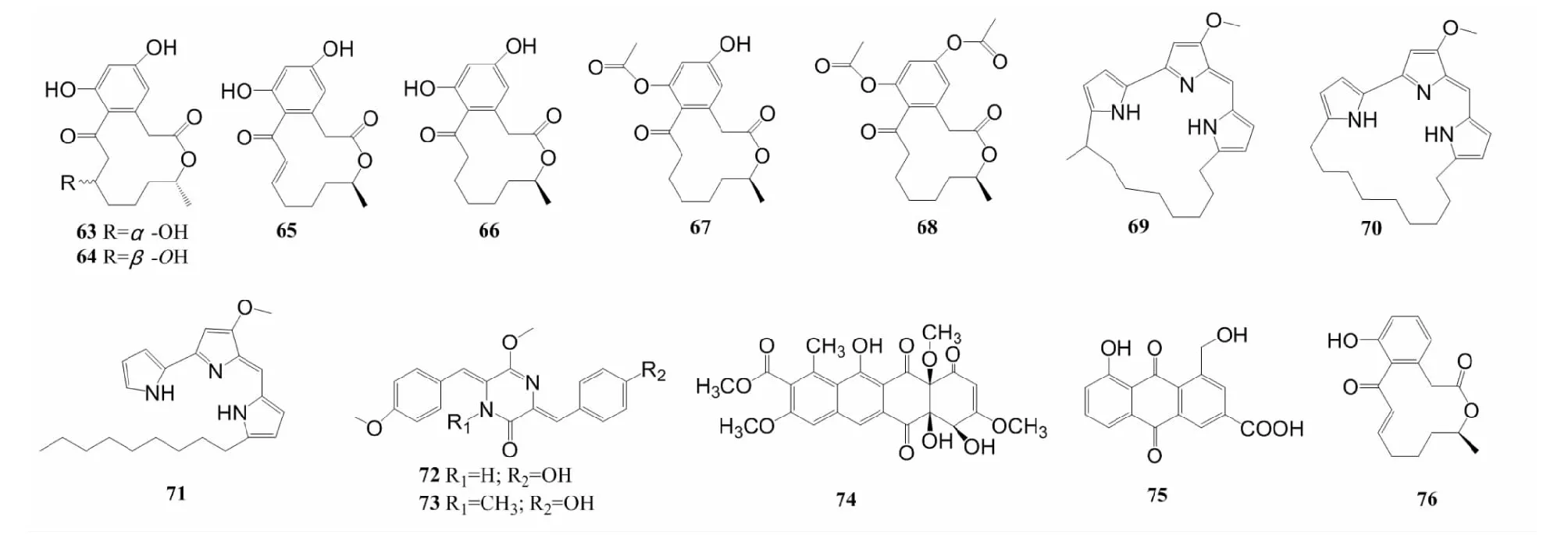
图6 化合物63~76的结构Fig.6 Structures of compounds 63-76
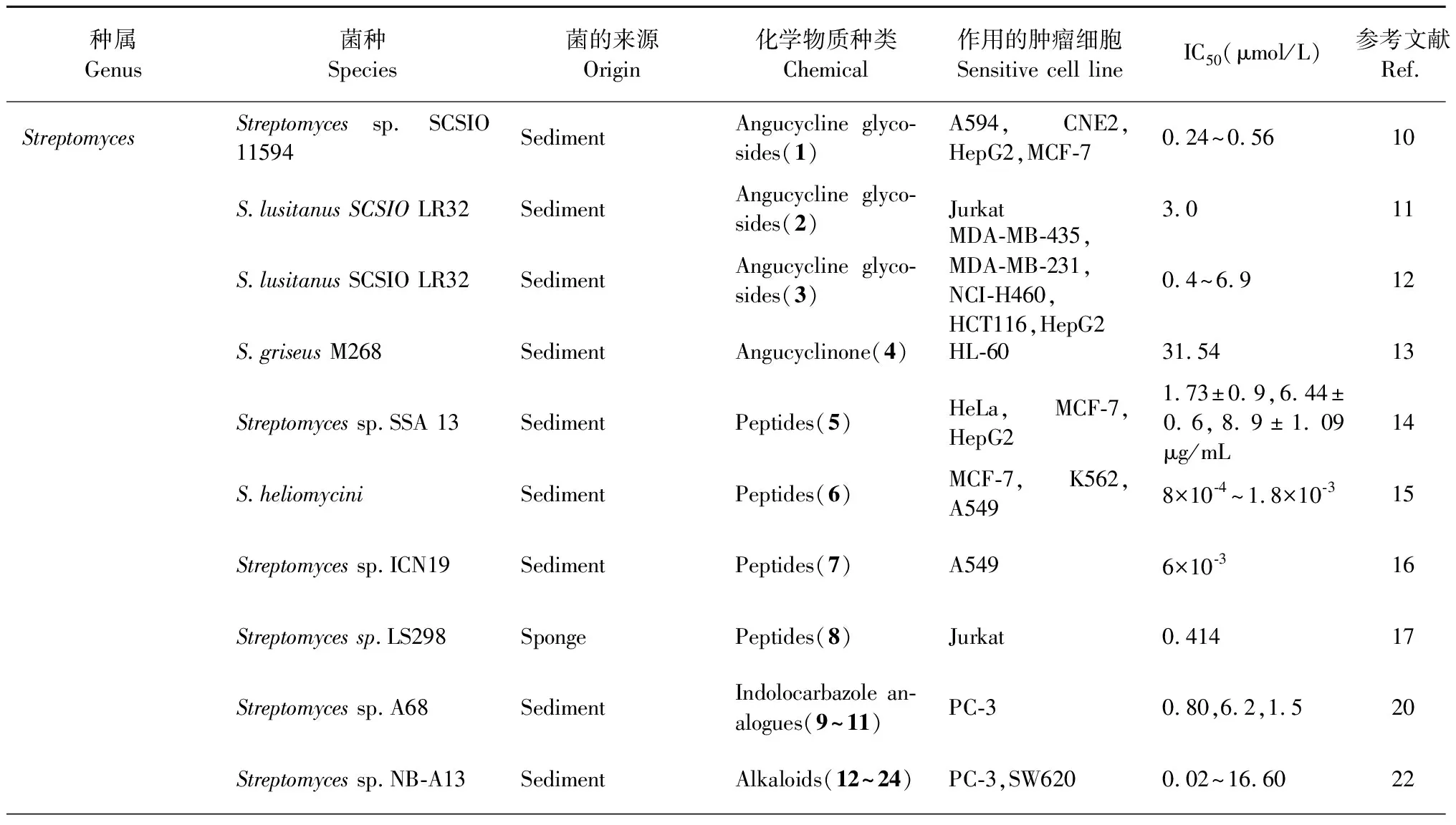
表1 放线菌抗肿瘤化学物质汇总表
续表1(Continued Tab.1)
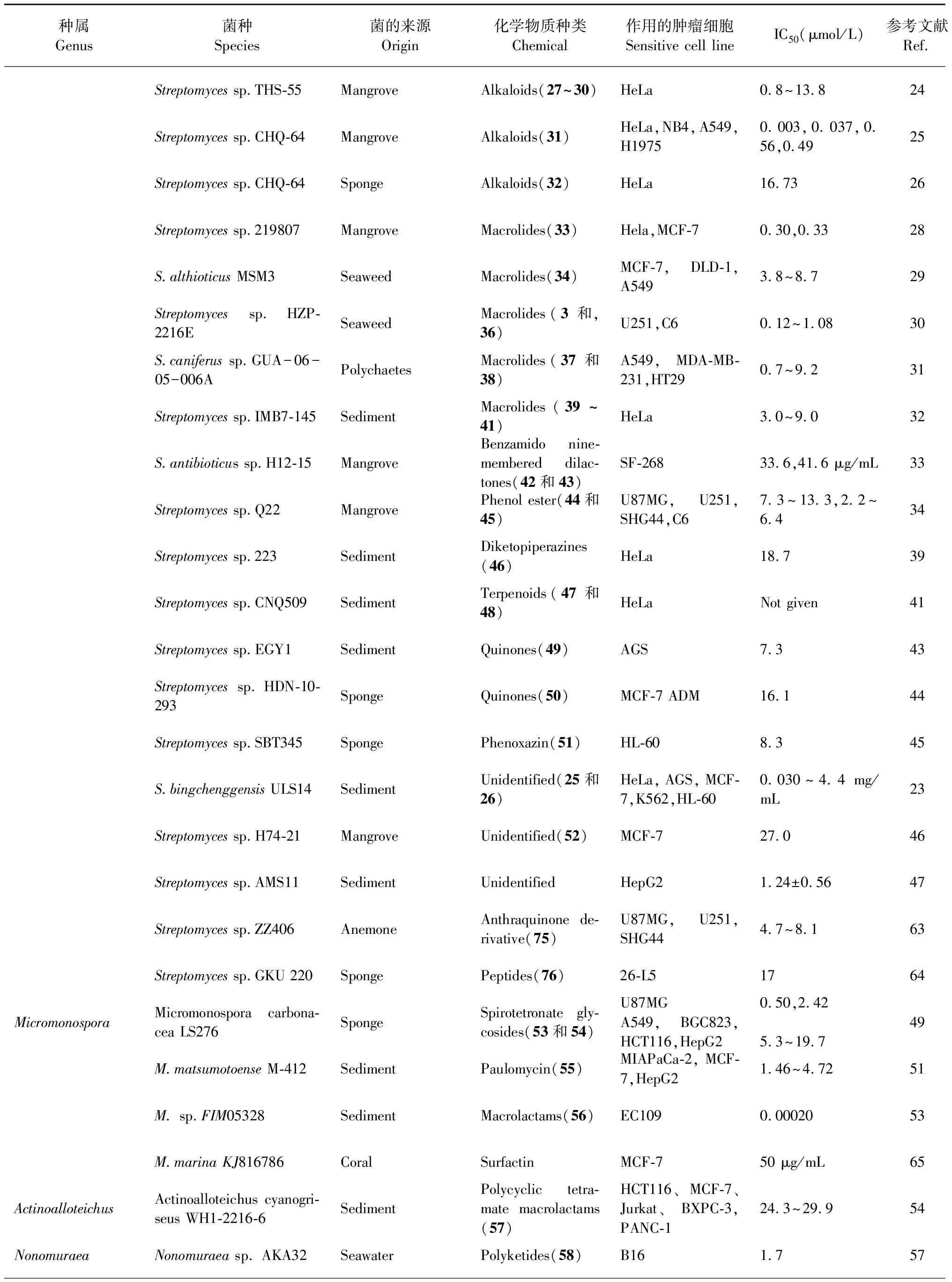
种属Genus菌种Species菌的来源Origin化学物质种类Chemical作用的肿瘤细胞Sensitive cell lineIC50 (μmol/L)参考文献Ref.Streptomyces sp.THS-55MangroveAlkaloids(27~30)HeLa0.8~13.8 24Streptomyces sp.CHQ-64MangroveAlkaloids(31)HeLa,NB4,A549,H19750.003,0.037,0.56,0.49 25Streptomyces sp.CHQ-64SpongeAlkaloids(32)HeLa16.73 26Streptomyces sp.219807MangroveMacrolides(33)Hela,MCF-70.30,0.33 28S.althioticus MSM3SeaweedMacrolides(34)MCF-7,DLD-1,A5493.8~8.729Streptomyces sp.HZP-2216ESeaweedMacrolides(3和,36)U251,C60.12~1.08 30S.caniferus sp.GUA-06-05-006APolychaetesMacrolides(37和38)A549,MDA-MB-231,HT290.7~9.2 31Streptomyces sp.IMB7-145SedimentMacrolides(39~41)HeLa3.0~9.0 32S.antibioticus sp.H12-15MangroveBenzamido nine-membered dilac-tones(42和43)SF-26833.6,41.6 μg/mL33Streptomyces sp.Q22MangrovePhenol ester(44和45)U87MG,U251,SHG44,C67.3~13.3,2.2~6.4 34Streptomyces sp.223SedimentDiketopiperazines(46)HeLa18.7 39Streptomyces sp.CNQ509SedimentTerpenoids(47和48)HeLaNot given41Streptomyces sp.EGY1SedimentQuinones(49)AGS7.3 43Streptomyces sp.HDN-10-293SpongeQuinones(50)MCF-7 ADM16.1 44Streptomyces sp.SBT345SpongePhenoxazin(51)HL-608.3 45S.bingchenggensis ULS14SedimentUnidentified(25和26)HeLa,AGS,MCF-7,K562,HL-600.030~4.4 mg/mL23Streptomyces sp.H74-21MangroveUnidentified(52)MCF-727.0 46Streptomyces sp.AMS11SedimentUnidentifiedHepG21.24±0.56 47Streptomyces sp.ZZ406AnemoneAnthraquinone de-rivative(75)U87MG,U251,SHG444.7~8.1 63Streptomyces sp.GKU 220SpongePeptides(76)26-L517 64MicromonosporaMicromonospora carbona-cea LS276SpongeSpirotetronate gly-cosides(53和54)U87MGA549,BGC823,HCT116,HepG20.50,2.425.3~19.7 49M.matsumotoense M-412SedimentPaulomycin(55)MIAPaCa-2,MCF-7,HepG21.46~4.72 51M. sp.FIM05328SedimentMacrolactams(56)EC1090.00020 53M.marina KJ816786CoralSurfactinMCF-750 μg/mL65ActinoalloteichusActinoalloteichus cyanogri-seus WH1-2216-6SedimentPolycyclic tetra-mate macrolactams(57)HCT116、MCF-7、Jurkat、BXPC-3,PANC-124.3~29.9 54NonomuraeaNonomuraea sp. AKA32SeawaterPolyketides(58)B161.7 57
续表1(Continued Tab.1)
种属Genus菌种Species菌的来源Origin化学物质种类Chemical作用的肿瘤细胞Sensitive cell lineIC50 (μmol/L)参考文献Ref.SaccharothrixSaccharothrix sp.10-10SedimentPolyketides(61)HepG27.5 58Saccharothrix sp.Not given Polyketides(74)A549,H4607.58±2.21,0.60±0.26 62PseudonocardiaPseudonocardia sp.HS7Sea cucumberMacrolides(62)SW620,HCT-15,U25120.8~32.2 59ActinomaduraActinomadura sp.BRA 177SedimentRed pigments(69~71)HCT116,MCF-7,SK-Mel-1470.26~4.25 60NocardiopsisNocardiopsis sp.YIM M13066SedimentDiketopiperazines(72和73)H1299,HeLa,MCF-7,PC-33.87~8.17,2.6~8.73 61N.halotolerans AMS10BN.halotolerans AMS10ASedimentSedimentUnidentifiedUnidentifiedHCT116HepG22.53±2.49 0.74±0.47 47
4 总结与展望
根据所查阅的2015年以来的文献表明,研究报道涉及的海洋放线菌有42种,其中链霉菌属29种,小单孢菌属4种、拟诺卡氏菌属3种、糖丝菌属2种、野野村氏菌属、假诺卡氏菌属、马杜拉放线菌属和异壁放线菌属各1种,链霉菌属超过一半。在来源方面,21种放线菌来源于海洋沉积物,13种来源于海洋动植物,6种来自红树林,1种来自海水,1种来源未知,可见海洋沉积物来源的放线菌占了很大部分。
海洋放线菌在适应特殊生存环境的过程中产生了丰富的的代谢产物。文献报道的76个抗肿瘤活性物质主要可归纳为多类不同的化合物。其中报道最多的是生物碱(19个),后面依次是大环内酯(10个)、肽类(6个)、角环素类(4个)、二酮哌嗪(3个)、红色素类(3个)、萜(2个)和大环内酰胺(2个)等。这些活性物质多数为链霉菌所产生,有一些为稀有放线菌的产物。从稀有放线菌中发现了聚酮类,还有一些尚未鉴定的新化合物。
活性研究表明,海洋放线菌次生代谢物对多种癌细胞具有抑制作用。包括:宫颈癌、乳腺癌、结肠癌、肝癌、胃癌、胰腺癌、食道癌、肺癌、前列腺癌、胶质瘤、黑色素瘤和白血病细胞等。一些海洋放线菌的活性物质对癌细胞具有很强的抑制作用,IC50很低,如大环内酰胺类化合物FW05328-1对食道癌细胞的IC50低至0.20 nmol/L,肽类化合物ala-geninthiocin对肺癌细胞的IC50为6 nmol/L。此外,有些活性化合物具择性抗肿瘤作用。这些高效和选择性抗肿瘤的化合物有很高的潜在应用价值,值得进一步研究和开发。
已研究的海洋放线菌大多数来源于沿海地区,只占全部海洋的大约7%~8%,远深海放线菌活性化合物的研究仍然具有广阔的前景。目前已发掘的药用放线菌多数为链霉菌,而其它稀有或未知种属放线菌仍然具有很大的挖掘空间。然而,虽然海洋放线菌抗肿瘤活性物质的筛选、分离纯化和药理研究取得了一定的进展,但是最终进入市场的活性化合物却较少,产出效率低[66]。主要原因在于,活性化合物筛选有一定的盲目性,而且天然活性物质产量较低,难以满足生产需求。此外,一些天然活性物质对正常细胞有毒副作用,限制了海洋放线菌抗肿瘤活性物质的进一步开发利用。针对存在问题,首先,可通过基因分析和勘探技术,选择性定向分离海洋放线菌,减少筛选工作的盲目性。再者,深入解析活性产物的合成代谢途径,利用基因工程技术激活和调控活性化合物关键合成酶基因的表达,结合育种、发酵及分离纯化工艺优化,促进活性化合物的扩大生产。最后,深入研究海洋放线菌活性化合物抗肿瘤机制,探明主要作用靶点,研究靶向抗肿瘤药物,提高药效,减少毒副作用。
总言之,我国幅员广大,拥有黄海、渤海、东海、南海等辽阔海域,随着科技的不断进步和发展,我国在海洋放线菌活性产物的研究和应用上还有巨大潜力和宽阔前景。
