菜地土壤中纤维素降解菌的筛选及其产酶条件优化
2020-04-20宋旭来耿慧王兰萍
宋旭来 耿慧 王兰萍
摘要 利用传统的微生物学方法,从菜地土壤中筛选出高产纤维素酶的菌株,并对其产酶条件进行优化。结果表明,从4种菜地土壤中共分离获得16株纤维素降解菌,其中生菜地土壤中获得的菌株最多,白菜地土壤中获得的菌株最少;在16个菌株中,从油菜地中分离纯化的1个菌株具有最强的纤维素降解能力;对该菌株的产酶条件优化发现,以麸皮作为唯一碳源、培养温度35 ℃、培养时间96 h时酶活力最高。
关鍵词 菜地土壤;纤维素降解菌;筛选;产酶条件
中图分类号 X703 文献标识码 A
纤维素酶是一种能够在分解纤维素时起生物催化作用的酶,可以将纤维素分解成寡糖或单糖。纤维素酶广泛存在于自然界中的细菌、真菌和一些动物的体内[1-3]。通常使用的纤维素酶主要来自于真菌,比较典型的有木霉属、曲霉属和青霉属。纤维素酶在农作物秸秆降解过程中起着至关重要的作用,是秸秆高效利用的关键因素[4-7]。经纤维素酶处理后的农作物秸秆可用于肥料、饲料、生活燃料以及食用菌培养基质等方面,能够为能源、食品、化工、纺织、医疗等领域提供基础原料,其产生的纤维素被认为是地球上分布最广、数量最多的可再生有机资源。
本研究通过从菜地土壤中筛选纤维素降解菌株,优化菌株的产酶条件,以期为农作物秸秆高效生产纤维素提供基础材料。
1 材料与方法
1.1 土壤样品采集
试验从江苏省盐城市市郊菜地(青菜地、油菜地、白菜地、生菜地)中,距表层土壤5 cm处挖取土壤约50 g,用无菌袋密封采集的样品,编号后置于冰盒中,实验室4 ℃保存备用。
1.2 培养基制备
菌种富集培养基(PDA):马铃薯200 g,蔗糖20 g,水1 000 mL。
选择性培养基(羟甲基纤维素钠CMC-Na培养基):CMC-Na 10 g,(NH4)2SO4 4 g,KH2PO4 4 g,MgSO4·7H2O 0.5 g,蛋白胨1 g,琼脂16 g,水1 000 mL。
纤维素刚果红鉴别培养基:(NH4)2SO4 2 g,MgSO4·7H2O 0.5 g,K2HPO4 1 g,NaCl 0.5 g,微晶纤维素2 g,刚果红0.4 g,琼脂20 g,水1 000 mL。
种子培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,调节pH值为7.0~7.2。
发酵培养基:NaCl 10 g,蛋白胨10 g,酵母粉5 g,CMC-Na 10 g,水1 000 mL。
碳源发酵培养基:NaCl 10 g,蛋白胨10 g,酵母粉5 g,葡萄糖或淀粉或秸秆粉各10 g,水1 000 mL。
上述各种培养基均置于121 ℃灭菌20 min,配制固体培养基时需要按照比例添加琼脂粉。
1.3 菌株分离与纯化
采集的土壤样品作预处理,具体方法参照文献[8]进行。每个样品称取2份,每份1 g。一份样品作风干处理(平摊于白纸上,放置于室内自然风干20 d),用于分离放线菌;将风干的土样放入75%乙醇消毒过的玻璃研钵中,加入10 mL无菌水,在超净工作台中研磨10 min,静止5 min后取上清液备用。另一份样品不风干,其余的步骤与风干样品的处理相同。
采用PDA平板培养基梯度稀释法分离菌种[9]。在超净工作台中,移液器移取上述预处理的土壤样品上清液1 mL作为原液,加入装有9 mL无菌蒸馏水的试管中,作为10-1浓度梯度的样品液。重复同样的操作,则依次得到10-2、10-3、10-4、10-5、10-6浓度的样品溶液。稀释均匀后,用无菌定量吸管移取各浓度的样品溶液0.3 mL,移入分离培养基平板上,用灭菌涂布器将样品溶液均匀涂布至整个平板,在培养皿上作相应标记。涂布完成后,将平板倒置于30 ℃培养箱中培养。细菌的培养时间一般为3~6 d,真菌的培养时间为4~14 d,放线菌的培养时间为7~17 d。
采用平板划线法纯化菌株。在上述培养基上选取长势良好的菌株,用灭菌接菌环挑取菌落的孢子或菌丝,接种于无菌纯化培养基平板,连续划线后倒置于30 ℃培养箱中,培养时间为3~7 d,定期观察各平板上的菌落颜色和形态的一致性。如果仅通过一次划线法不能将菌株纯化,需要多次划线纯化,直到整个培养基上的菌落形态一致,表明单菌株纯化成功。
1.4 纤维素降解菌株的鉴定
将分离纯化得到的菌株接种于CMC-Na选择性培养基平板上,在28 ℃、160 r/min条件下培养48 h,每个菌株设置3个重复。
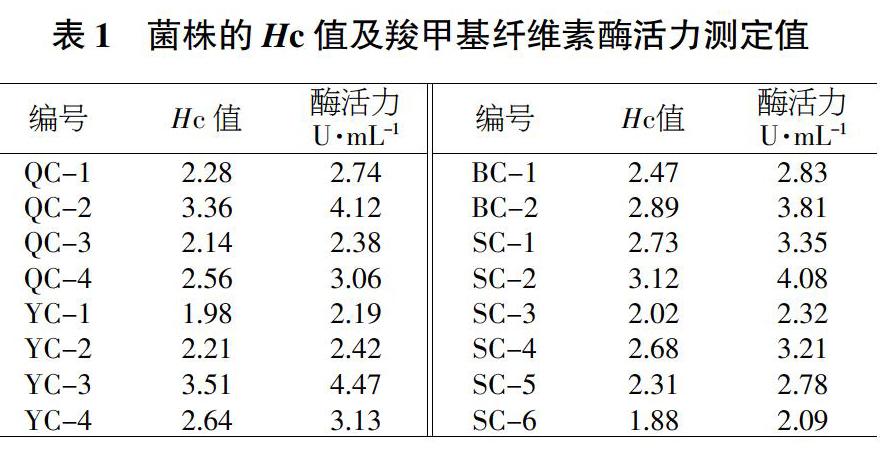
参照文献[10]中提供的方法,将获得的菌株转接到纤维素刚果红鉴别培养基平板上,每个菌株设置3个重复,28 ℃、160 r/min培养48 h。根据纤维素刚果红培养基平板上的透明圈直径(D)和菌落直径(d)大小,初步判断菌株降解纤维素能力。选取Hc值(Hc=D/d,即透明圈直径与菌落直径的比值)较大、生长快速的菌落划线分离纯化后保存[11-12]。
纤维素酶高产菌株的筛选:将产透明圈大且生长快速的菌株接种于液体发酵培养基,28 ℃、160 r/min培养;每隔24 h取样1次,3 000 r/min 离心10 min,收集上清液测定酶活力。参考文献[13]中的方法测定酶活力。
1.5 纤维素降解菌株产酶条件的优化
温度对菌株产酶能力的影响:取1 mL菌株培养液接种于10 mL液体发酵培养基中,分别在20、25、30、35、40、45、50 ℃培养3 d,测定其羧甲基纤维素酶活力。
碳源对菌株产酶能力的影响:分别在不同的碳源培养基(葡萄糖、蔗糖、淀粉、麸皮、秸秆)中接种1 mL菌株培养液,培养3 d,测定其羧甲基纤维素酶活力。
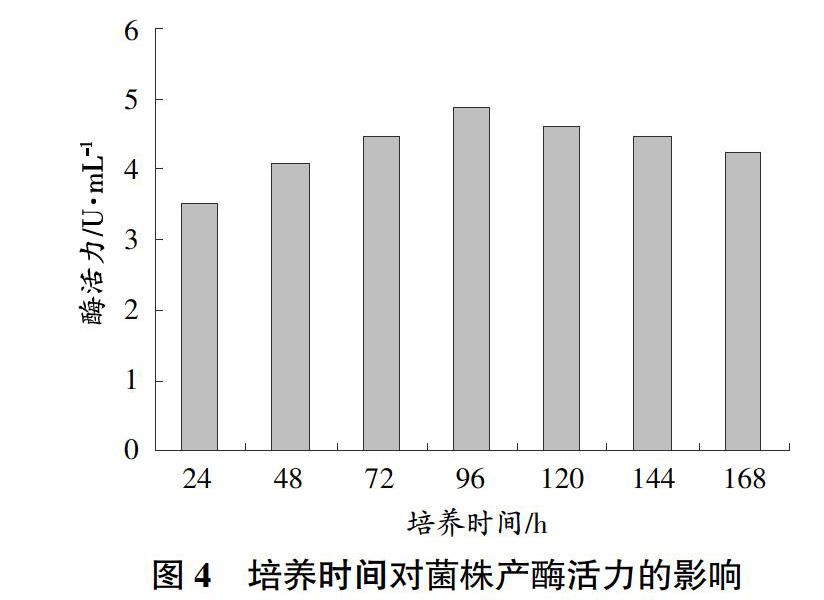
培养时间对菌株产酶能力的影响:取1 mL菌株培养液接种于10 mL液体发酵培养基中,分别培养24、48、72、96、120、144、168 h,测定其羧甲基纤维素酶活力。
2 结果与分析
2.1 菜地土壤中纤维素降解菌株的分离纯化结果
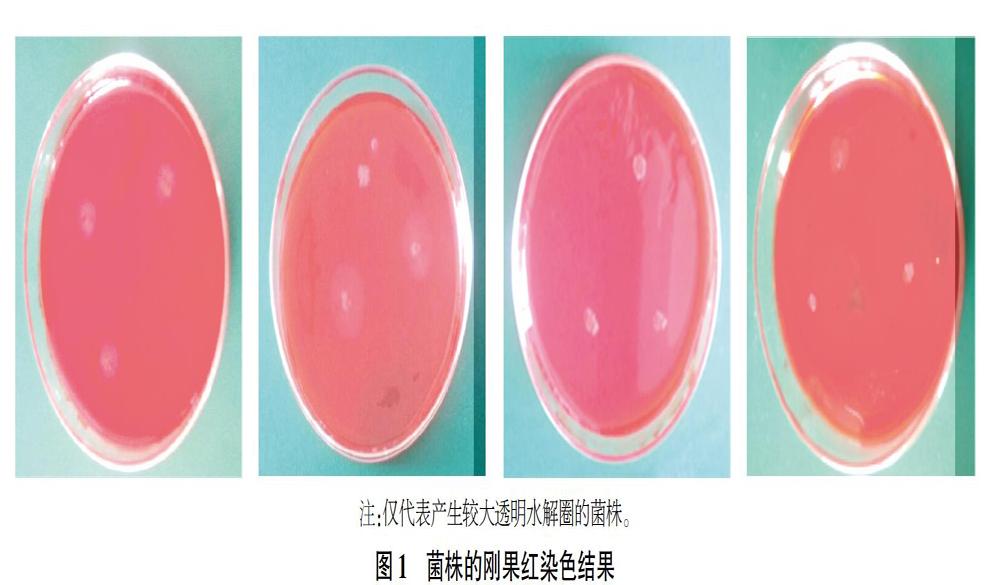
经过一系列连续分离纯化培养,依据刚果红染色后能够产生透明水解圈的标准,分别从青菜地、油菜地、白菜地、生菜地土壤中初步篩选获得4株(QC-1、QC-2、QC-3、QC-4)、4株(YC-1、YC-2、YC-3、YC-4)、2株(BC-1、BC-2)和6株(SC-1、SC-2、SC-3、SC-4、SC-5、SC-6)纤维素降解菌株(图1)。
从羧甲基纤维素酶活力复筛结果可以看出,在所有测定的16个菌株中,YC-3的Hc值最大(表1),初步判断其降解纤维素能力最强。经液体发酵培养后,菌株YC-3产生的羧甲基纤维素酶活力为4.47 U/mL,高于其他菌株的酶活力值,表明最佳纤维素降解菌株是YC-3。因此,根据透明圈与菌落直径的比值以及菌株的酶活力值大小可以看出,油菜地中分离纯化的菌株YC-3的降解能力最强,确定将对其产酶条件作进一步分析。
2.2 菌株的产酶条件优化结果
菌株产酶活力大小与培养温度的关系如图2所示,菌株酶活性随着培养温度的增加而逐渐增强,在最适培养温度35 ℃时达到最大酶活力值,之后随着温度的升高呈现下降趋势。
菌株产酶活力大小与培养基碳源的关系如图3所示,以麸皮作为培养基唯一碳源时的菌株产酶活力较高,以葡萄糖、蔗糖、淀粉、秸秆作为培养基唯一碳源时的菌株产酶活力则依次降低。
菌株产酶活力大小与培养时间的关系如图4所示,在整个培养过程中,菌株的产酶活性整体出现先增后减的变化趋势,菌株的最佳产酶时间为培养96 h。
3 结论与讨论
人们从土壤和动物消化道中筛选出许多种纤维素降解菌用于生产纤维素酶。这些筛选得到的纤维素降解菌能够将纤维素降解为纤维素二糖或葡萄糖等小分子有机物,以实现农作物秸秆的资源化利用目标。运用传统的微生物学方法,已经从植物根际土壤、湿地土壤、热泉土壤、酸性土壤等中筛选得到产酶能力较强的纤维素降解菌株,主要涉及枯草芽孢杆菌、地衣芽孢杆菌、短小芽孢杆菌、嗜热类芽孢杆菌、木霉、青霉、棘孢曲霉、尖孢镰刀霉、黑曲霉和米曲霉等[14-20]。从这些不同类型土壤中分离纯化获得的菌株经鉴定属于细菌、真菌和放线菌,主要以细菌和真菌为主。
本研究采用富集培养法和刚果红纤维素培养基法,从菜地土壤中共分离获得16株纤维素降解菌,其中生菜地土壤中获得的菌株最多,白菜地土壤中获得的菌株最少。运用酶活力测定法进一步筛选,从16个菌株中筛选出1株具有最高酶活力的纤维素降解菌,系从油菜地中分离纯化获得。进一步对该菌株发酵产酶条件优化研究表明,在添加麸皮作为培养基碳源、最适培养温度35 ℃时达到最大酶活力值,最佳产酶时间为培养96 h。然而,对纤维素酶活力影响较大的因素是碳源的种类和性质,导致菌株对各种碳源物质具有特定的代谢偏好性。本研究中,虽然麸皮和葡萄糖作为唯一碳源时的产酶活力都相对较高,但从经济效益的角度考虑,麸皮是优先选择的碳源。优先选择麸皮的原因在于麸皮是一种来源广泛的农产品加工副产物,价格低廉,利用其作为菌株的基础培养基,更能够有效地降低生产纤维素酶的经济成本。
4 参考文献
[1] 孙喆,鲍男,王涛,等.纤维素酶来源的研究进展[J].吉林畜牧兽医,2014(9):22-25.
[2] 郑秋燕,刘旭川,李清,等.瘤胃纤维素酶来源的微生物及其作用机制[J].广东农业科学,2015(12):105-110.
[3] 廖春蓉,郭雅蓉.产纤维素酶菌株的研究进展[J].职业与健康,2016,32(19):2722-2728.
[4] 孙旸,地里百尔·努尔,林晓琼,等.纤维素酶处理玉米秸秆工艺条件的优化[J].吉林农业大学学报,2017,39(5):544-550.
[5] 许富强,王曙阳,董妙音,等.可高效降解甜高粱秸秆产糖的纤维素酶研究[J].中国酿造,2018,37(5):126-129.
[6] 王兴吉,刘文龙,闫宜江,等.纤维素酶水解小麦秸秆的酶解动力学[J].江苏农业科学,2019,47(2):309-311.
[7] 万江春,于辉,张延辉.纤维素酶及乳酸菌对棉花秸秆青贮饲料发酵品质及体外消化率的影响[J].中国畜牧杂志,2019,55(4):104-106.
[8] COLEN G,JUNQUEIRA R G,MORAES-SANTOS T.Isolation and scre-ening of alkaline lipase-producing fungi from Brazilian savanna soil[J].World Journal of Microbiology & Biotechnology,2006,22:881-885.
[9] 吴越,王兰萍,耿荣庆.银杏根际土壤中菌株的分离及纤维素降解菌的筛选[J].现代农业科技,2018(23):187-189.
[10] 张超,李艳宾,张磊,等.纤维素-刚果红培养基鉴定产纤维素酶真菌的机理研究[J].纤维素科学与技术,2007,15(2):39-44.
[11] SHENG P,HUANG S,WANG Q,et al.Isolation,screening,and optimi-zation of the fermentation conditions of highly cellulolytic bacteria from the hindgut of Holotrichia parallela larvae(Coleoptera:Scarabaeidae)[J].Appl Biochem Biotechnol,2012,167(2):270-284.
[12] WANG A,CHAI Z,LI J,et al.Screening and identification of antagonistic Bacillus strains against pathogens of fusarium dry rot and black scurf in potato[J].Chin J Biol Control,2013,29(4):586-594.
[13] 朴哲,崔宗均,苏宝琳,等.高效稳定纤维素分解菌复合系MC1的酶活特性[J].中国农业大学学报,2003,8(1):59-61.
[14] 高静,席琳乔,马春晖,等.土壤中棉秆纤维素降解菌的筛选[J].塔里木大学学报,2010,22(4):6-10.
[15] 蒋玉俭,李新鑫,孙飞飞,等.竹林土壤中纤维素降解菌的筛选及产酶条件优化[J].浙江农林大学学报,2015,32(6):821-828.
[16] 白旭明.艾比湖湿地土壤纤维素降解菌筛选及酶活测定[J].绿色科技,2017(10):113-115.
[17] 王旭,王志,蔡梦宇,等.热泉土壤来源的纤维素降解菌的分离与初步鉴定[J].安徽农业大学学报,2017,44(3):482-486.
[18] 夏俊.不同湿地土壤中真菌群落分析以及纤维素降解菌的筛选[J].生物化工,2018,4(4):37-39.
[19] 吴越,王兰萍,耿荣庆.银杏根际土壤中菌株的分离及纤维素降解菌的筛选[J].现代农业科技,2018(23):187-189.
[20] 王翀,朱兆静,潘虎,等.酸性土壤中高效半纤维素降解菌的筛选与鉴定[J].化学与生物工程,2019,36(3):31-36.
