糖尿病肾脏病患者肠道菌群紊乱的发生发展机制*
2020-04-12刘旭生
张 青 ,刘旭生 ,2,张 蕾 ,2**
(1. 广州中医药大学第二临床医学院 广州 510000;2. 省部共建中医湿证国家重点实验室/广州中医药大学第二附属医院 广州 510120)
2 型糖尿病是由遗传和环境共同造成的一种慢性、全身性的代谢性疾病,已经成为全球死亡的第七大原因[1]。糖尿病肾脏病(diabetic kidney disease,DKD)是指由糖尿病引起的慢性肾脏病,是糖尿病主要的微血管并发症之一。随着社会经济的发展和人们生活方式的变化,20%-40%的糖尿病患者会发展为糖尿病肾病[2,3],是终末期肾脏病、心血管事件及高死亡率的主要原因。因此糖尿病肾脏病已成为严重危害人类健康的公共卫生问题。随着肠道菌群检测技术的成熟及广泛应用,逐渐揭示了肠道菌群在糖尿病肾脏病中的重要作用。本文结合国内外相关文献报道,对糖尿病肾脏病患者肠道菌群紊乱的具体作用机制进行综述,为糖尿病肾脏病的治疗及研究提供依据。
1 肠道菌群概述
人类的胃肠道,特别是大肠,由数百万亿微生物定居。生理情况下:肠道微生物分类有1000 种以上,99%以上属于厚壁菌门、拟杆菌门、变形菌门以及放线菌门,通常很少(0.1%)出现致病物种。碳水化合物和蛋白质是肠道细菌利用的主要营养物质,这两种之间的比例影响了肠道物种的组成。在有足够数量的未消化的复合碳水化合物(特别是膳食纤维)的情况下,糖分解细菌占优势,产生甲烷、氢和短链脂肪酸(short-chain fatty acids,SCFA)[4]等产物。然而,在缺乏碳水化合物的情况下,蛋白质和其他含氮化合物也可以被蛋白分解细菌分解,同时产生潜在的有毒产物,如氨、胺、硫醇、酚和吲哚[5]。肠道微生物群在机体中发挥重要作用,合成维生素、氨基酸及代谢碳水化合物、脂质和蛋白质[6]。除此之外,肠上皮屏障能够阻断细菌移位,并且参加肠道粘膜免疫反应[7,8]。现代研究表明,不健康饮食、缺乏运动、肥胖、高血压、高血脂等,导致肠道环境改变,这种肠道环境的破坏和肠道菌群紊乱被称为“肠道失调”。目前研究发现肠道失调与多种自身免疫和代谢性疾病相关,如过敏、哮喘、炎症性肠病、腹腔疾病、系统性红斑狼疮、关节炎、慢性肾脏病、糖尿病、肥胖、肿瘤和心血管疾病等[9-14]。
2 糖尿病肾脏病患者肠道菌群紊乱的表现
糖尿病肾脏病患者肠道菌群紊乱,主要表现为益生菌减少,机会致病菌增加。Tao 等人[15]的研究表明,糖尿病肾脏病患者与健康人及糖尿病无肾脏病患者相比,厚壁菌门减少,变形杆菌增多。厚壁菌门通常产生丁酸[16],保护肠道黏膜。变形杆菌促进内毒素释放增多[17,18]。同时还发现年龄和性别匹配后的DKD 患者与糖尿病无肾脏病患者相比,肠道Prevotella_9菌群减少,Escherichia-Shigella 菌群增多。Prevotella_9 与糖化血红蛋白和血肌酐水平呈显著负相关,能够减少急性肾损伤的炎症反应[19]。Escherichia-Shigella 可通过穿透肠上皮屏障[20],破环肠道屏障功能,产生乙醇[21],引起脂肪酸代谢紊乱[22]。也有研究表明,幽门螺杆菌感染与糖尿病和DKD的发生发展有关[23]。
3 肠道菌群紊乱加重糖尿病肾脏病的发生发展
糖尿病肾脏病患者普遍存在肠道菌群紊乱,反之肠道菌群紊乱又进一步加重糖尿病肾脏病的发展。肠道菌群紊乱在糖尿病肾脏病发生发展中的作用机制主要有以下几个方面:
3.1 短链脂肪酸减少
由于糖尿病肾脏病患者对糖和富钾食物的摄入受到限制,尤其对水果和蔬菜的限制,加重了肠道菌群紊乱,益生菌数量减少,导致SCFA 生成减少。SCFA 是由肠道菌群代谢膳食纤维而产生,通过抑制肾小管上皮细胞氧化应激反应减轻肾脏损伤[24,25]。SCFA 包括乙酸、丙酸和丁酸。其中丁酸是肠黏膜细胞的主要能量来源[26],可促进肠黏膜及其功能恢复,抑制炎症细胞因子的形成,起抗炎作用[27-29]。
生理情况下SCFA 可激活肠上皮细胞上G 蛋白偶联受体(G-protein coupled receptor,GPR)GPR41 和GPR43。GPR41 刺激肽 YY(peptideYY,PYY)的释放增强肠道蠕动,GPR43 减轻炎症反应,刺激胰高血糖素样肽1(glucagon-like peptide 1,GLP1)的释放,GLP1通过抑制食物摄取,刺激胰岛素分泌,诱导β细胞增殖发挥抗糖尿病作用[30],并能降低肾小球压力和蛋白尿[31],从而预防DKD 的发展[32](图1)。同样有研究表明,SCFA 与肾素-血管紧张素系统(renin-angiotensin system,RAS)有关,生理情况下,SCFA 与位于肾小球旁的入球小动脉中的受体结合,可介导肾素分泌,发挥与血管相关的作用[33]。病理情况下,由于DKD 患者肠道微生物群或其代谢产物的变化,以及外源性刺激物(高糖、尿毒素等)打破肾内RAS 的ACE/Ang II/AT1R和ACE2/Ang(1-7)/MAS轴之间的平衡,从而引起一系列级联反应,进而加大肾脏损伤,促进DKD进展[34]。
3.2 内毒素脂多糖增多
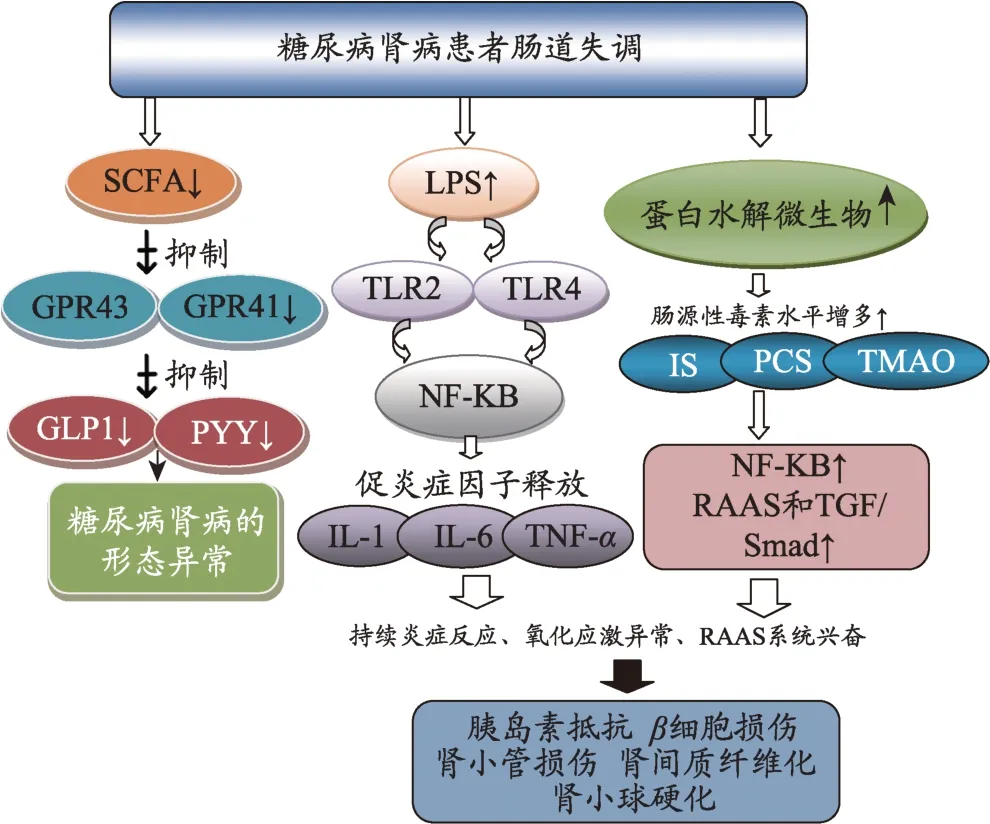
图1 糖尿病肾脏病患者肠道失调
脂多糖(lipopolysaccharides,LPS)是存在于革兰氏阴性细菌外膜中的一种内毒素,是机体炎症反应的启动者,可引起与炎症相关的慢性免疫反应。LPS 从革兰氏阴性菌中释放出来进入血液会导致LPS 相关毒性。越来越多的证据表明LPS与糖尿病肾脏病持续炎症反应,胰岛素抵抗密切相关[35-38]。糖尿病肾脏病患者肠道通透性增强,LPS 能够通过渗漏的肠紧密连接或通过渗透乳糜蛋白穿过胃肠粘膜,进入全身循环,渗透到肝脏或脂肪等组织,触发免疫反应[39]。LPS 通过Toll 样受体(Toll-like receptors,TLR)TLR2/4 相关途径启动炎症反应,激活核转录因子κB(nuclear transcription factor-κB,NF-κB),促进炎性细胞因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞 介 素 -1(interleukin-1,IL-1)、白 细 胞 介 素 -6(interleukin-6,IL-6)分泌增多[32],引发全身低度炎症反应,加重糖尿病肾脏病的发生和发展。
3.3 肠源性尿毒素增多
糖尿病肾脏病中晚期,肾脏滤过功能障碍,导致多种尿毒素在体内蓄积,其中一些尿毒素来源于食物,由肠道菌群合成,称之为“肠源性尿毒素”,主要包括以下几种:
氧化三甲胺(Trimethylamine N-oxide,TMAO),TMAO 是一种小的有机化合物,在摄入膳食左旋肉碱和磷脂酰胆碱后升高,但肠道菌群失衡是导致TMAO水平升高的主要原因[40]。Gruppen 等人研究发现糖尿病患者TMAO 水平普遍升高,尤其是eGFR <90 mL/min/1.73 m2的受试者中更为明显[41],因此糖尿病肾病患者TMAO 水平升高与肠道菌群紊乱和肾功能下降密切相关。血浆TMAO 水平升高,可通过激活NF-κB磷酸化,促进炎症因子IL-6和TNF-α水平升高[42,43],进一步损伤内皮功能,与胰岛素抵抗、肾间质纤维化密切相关[44-47]。
硫酸对甲酚(p-Cresol sulfate,PCS),PCS能与蛋白质高度结合,是肠道细菌代谢酪氨酸和苯丙氨酸的产物,与梭状芽胞杆菌和类杆菌属的丰度有关。在糖尿病肾病患者中,血清PCS 水平与肾功能呈负相关,并随肾脏疾病严重程度逐渐升高[48]。PCS 通过激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶氧化酶(nicotinamide adenine dinucleotide phosphate,NADPH)活性,增强肾小管细胞中活性氧的产生,上调与肾纤维化相关的炎性细胞因子 mRNA 水平和 TGF-β1 的分泌[49]。因此PCS可通过增强氧化应激,诱发炎症反应,导致肾小管细胞损伤,肾小管间质炎症和纤维化,肾小球硬化,进一步加重肾功能衰退[50]。
硫酸吲哚酚(indoxyl sulfate,IS),90%IS 能够与血清蛋白结合,血液透析(HD)难以去除。Atoh 等人研究表明IS 在早期糖尿病肾脏病患者中明显升高[51],与肾功能呈负相关关系。高浓度的IS 能够增加氧化应激,促进自由基产生,增强炎症基因的表达。研究表明,IS与1型糖尿病患者合并肾脏病的进展相关[52]。IS和PCS 可导致肾小管细胞损伤、肾小管上皮细胞转分化、肾小管间质炎症和纤维化[53]。在糖尿病肾脏病动物模型中,IS 和PCS 能够激活肾内 RAAS 和TGF/Smad途径。增加肾素、血管紧张素原和血管紧张素1 受体表达并降低血管紧张素2 受体表达,从而引起血管收缩,加重组织缺血[54]。
糖尿病肾脏病中晚期,肾小球滤过率下降,肠道菌群紊乱,肠道机会致病菌数量增多,是导致肠源性尿毒素(IS、PCS、TMAO)增多的主要原因,肠源性尿毒素可破环肠道黏膜,导致肠腔通透性增加,肠源性尿毒素通过损伤的肠腔转移至血液,进入循环,引起机体炎症反应和氧化应激,加重糖尿病肾脏病的进展。
3.4 肠道上皮屏障功能受损
健康人体的结肠具有完整的粘膜屏障,肠道屏障组成复杂,主要由肠上皮细胞和细胞间的紧密连接蛋白构成,如闭合蛋白(occludin)家族、封闭蛋白(claudin)家族和闭锁小带蛋白(zonula occluden,ZO)家族。肠道屏障功能与多种因素有关,如肠道灌注不足、感染、毒素、药物和不良生活方式等。近些年研究表明,血糖水平维持差的2型糖尿病患者,高糖通过诱导机体氧化应激及炎症反应,导致肠道上皮细胞功能损伤[55,56]。Vaziri[57]等人研究证实慢性肾脏病患者结肠粘膜中紧密连接蛋白claudin-1、occludin 和ZO1 明显减少,导致肠道通透性改变。这与致病菌和毒素水平增加引起肠道pH 的改变密切相关。但是目前关于探讨DKD患者肠道屏障功能障碍机制的文献较少,但结合既往研究,考虑糖尿病肾脏病患者肠道屏障功能受损与肠道菌群组成改变、内毒素增多、血糖增高等因素相关。
4 调控肠道菌群失调已成为治疗的新靶点
目前从肠道菌群调控入手,已成为治疗多种疾病的新靶点。益生菌/益生元/合生元通过调节肠道微生物群落的组成,降低肠内毒素的浓度,改善胰岛素敏感性和防止肾功能恶化[58,59]。口服碳质吸附剂AST-120 通过吸附肠道氨基酸代谢产生的IS 和PCS 前体,降低慢性肾脏病患者血清尿毒症毒素,减少氧化应激反应,延缓了大鼠肾功能衰竭和纤维化的进展[60,61]。抗性淀粉能够调节肠道细菌种群,促进肠道有益微生物群落生成,改善肠道内环境,增加SCFA 分泌,抑制低度炎症反应,同时减少产脲酶细菌,增加粪便氮排泄,减少尿毒症毒素的产生[62]。中药在调节肠道微生态方面也发挥着重要作用,柴胡多糖能够通过调节肠道微生物,改善肠道屏障,减少肾脏和结肠炎症反应的表达,改善糖尿病肾脏病进展[63]。目前通过调控肠道菌群失调治疗2型糖尿病和慢性肾脏病的研究比较多,但是治疗糖尿病肾脏病的研究不多,缺乏高质量临床证据,因此仍需要进一步的研究证实。
5 结语与展望
近年来,随着生物信息学和代谢组学的广泛应用,从肠道微生态角度出发,探讨糖尿病肾脏病的发生发展的研究也逐渐增多。糖尿病肾脏病患者普遍存在肠道菌群紊乱的现象,肠道菌群紊乱通过产生肠源性尿毒素,破坏肠道上皮屏障功能等机制,又进一步加重糖尿病肾脏病的发展,两者相互影响,互为因果。因此肠道菌群与糖尿病肾脏病的发生发展密切相关,探讨肠道微生物与糖尿病肾脏病的相关性,有助于DKD的早期诊断、早期治疗,预防疾病的进展。
从肠道菌群调控入手,通过提高益生菌的丰度,降低致病菌群的数量,有助于降低肠源性尿毒素,减轻机体炎症反应,提高胰岛素敏感性,延缓肾脏损害。目前研究较多的是服用益生菌调控肠道菌群种类的丰度,但如果不改善肠道微生态,单纯菌群移植或只补充益生菌,那么这些益生菌有可能不能长久存活,不能发挥其作用。中医药疗法,注重天人合一,整体调节,能改善人体内环境,改善肠道微生态,调控菌群繁殖,从而能够延缓疾病的进展。因此中医药疗法在调节肠道菌群方面能发挥优势,但目前仍需要高质量的大样本随机对照试验进行验证。
