铁死亡在肿瘤中的研究进展
2020-04-11胡善林莫钦国罗建芳聂云凤
胡善林, 莫钦国, 罗建芳, 聂云凤
(1. 广西医科大学肿瘤医学院,广西 南宁 530021;2. 广西壮族自治区肿瘤医院乳腺外科,广西 南宁 530021;3. 南宁市第一人民医院甲状腺乳腺外科,广西 南宁 530022)
铁死亡(ferroptosis)于2008年由斯托克博士首次报道,它是一种铁依赖性的非凋亡形式调节细胞死亡的过程[1]。铁死亡有独特的形态学和生物化学特征,其线粒体体积缩小,线粒体膜密度增加,线粒体嵴减少或消失,但细胞膜完整,细胞核大小正常,染色质无浓缩[2];细胞内谷胱甘肽消耗,谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)活性下降,NADPH依赖性脂质过氧化以及铁依赖性活性氧生成[2-4]。铁死亡发生与半胱氨酸代谢、脂质代谢和铁循环密切相关:半胱氨酸生成受抑制和谷胱甘肽减少是铁死亡的关键环节[5];多不饱和脂肪酸易发生脂质过氧化直接诱导铁死亡[6];铁离子的吸收、排除、存储和含量可影响细胞对铁死亡的敏感性[7]。铁死亡还受其他分子直接或间接地调节,包括电压依赖性阴离子通道(voltage dependent anion channel, VDAC)、核因子红细胞2相关因子2、肿瘤抑制基因p53以及NADPH氧化酶等[5,8]。人与小鼠的多种生理和病理过程都可发生铁死亡[9-12]。研究表明,诱导铁死亡可以抑制肿瘤细胞增殖,影响动物体内肿瘤的生长和转移。如抑制半胱氨酸脱硫酶可在体外诱发细胞铁死亡,减缓肺癌细胞增殖[13];下调视网膜母细胞瘤蛋白表达可以诱发细胞铁死亡,致肝细胞癌异种移植小鼠体内肿瘤明显消退[14];醉茄素A通过抑制GPX4活性诱发神经母细胞瘤细胞铁死亡,抑制肿瘤生长并减少动物体内的肿瘤复发[15]。本文对近年来有关细胞铁死亡的主要机制以及铁死亡在肿瘤方面的研究进展作一综述。
1 铁死亡的主要机制
肿瘤细胞铁死亡的诱导机制大体上分为经典和非经典途径。经典途径通过抑制胱氨酸/谷氨酸反向转运系统(system Xc-)-谷胱甘肽-GPX4轴,导致脂质活性氧积累引发细胞铁死亡,主要包括system Xc-、GPX4、转硫通路、甲羟戊酸通路等[2-5]。非经典途径是围绕铁代谢和线粒体直接或间接诱导铁死亡。例如,与铁代谢相关的核因子红细胞2相关因子2和热休克蛋白β调控通路[7],与线粒体相关的VDAC通路[5]。此外,p53既可通过经典途径抑制system Xc-间接诱导,又可通过非经典途径抑制二肽基肽酶4直接导致细胞铁死亡[5,8]。见图1。
1.1 直接抑制GPX4活性
GPX4是一种将H2O2和有机H2O2分解成水或相应醇的酶[16]。细胞内GPX4活性下降或GPX4直接降解会引发铁依赖性活性氧增加,进而诱发铁死亡[4]。RSL3可以直接与GPX4共价键结合并抑制其活性, 造成细胞内活性氧积累诱发铁死亡[1,5]。FIN56通过诱导GPX4功能退化,增加GPX4降解来诱导铁死亡[17],但其具体机制尚不清楚。此外,siRNA可以使GPX4 mRNA表达水平降低20倍,足以引起细胞活性氧积累和铁死亡[5]。目前认为GPX4是多种铁死亡诱导物诱导铁死亡的关键靶点[18]。见图1。
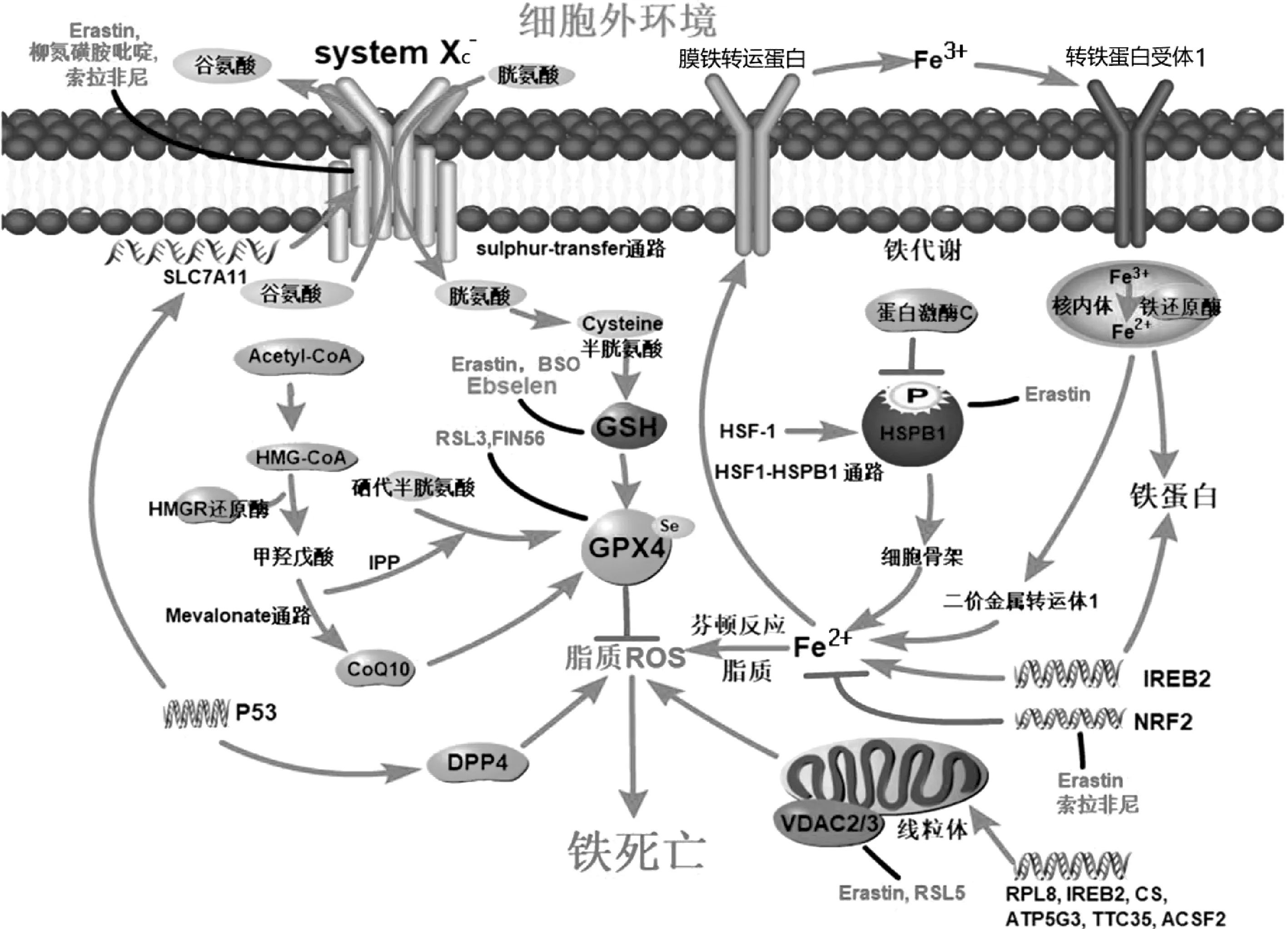
图1 铁死亡的分子机制及其信号转导通路
1.2 抑制system Xc-活性
另一种机制是抑制system Xc-从而达到对GPX4的间接抑制。system Xc-是膜Na+依赖的胱氨酸-谷氨酸反向转运体,是由轻链亚基SLC7A11和重链亚基SLC3A2组成的二硫键异二聚体[19]。system Xc-将细胞内谷氨酸转运至胞外的同时,将胞外胱氨酸转运至胞内,半胱氨酸在转硫通路中合成谷胱甘肽[20]。谷胱甘肽是GPX4激活的必要辅因子,其产生和维持是保护细胞免受氧化应激的关键[21]。因此,细胞对胱氨酸的摄取不仅是谷胱甘肽合成的关键步骤,更是铁死亡的核心。例如,Erastin通过抑制system Xc-阻止胞外胱氨酸进入细胞,减少半胱氨酸生成,降低细胞内谷胱甘肽水平,增加细胞内活性氧含量,最终导致铁死亡[2,5]。见图1。
1.3 其他机制
野生型p53对细胞的脂质合成和糖酵解起负调控作用,对氧化磷酸化和脂质分解起正调控作用,并通过调控活性氧直接参与铁死亡[22]。野生型p53表达增加可抑制system Xc-的关键成分SLC7A11表达,抑制胱氨酸摄取,减少谷胱甘肽生成,从而降低GPX4活性,诱导骨肉瘤U2OS细胞和乳腺癌MCF7细胞发生铁死亡[23]。另一项研究报道,野生型p53缺失或敲除时,二肽基肽酶4的积累明显减少,导致与质膜相关的脂质过氧化,使结直肠癌HCT116和SW48细胞对铁死亡敏感;并且,野生型p53表达增加可降低二肽基肽酶4活性,抑制由Erastin引起的铁死亡[24]。此外,突变型p53蛋白增多可结合主抗氧化的转录因子——核因子红细胞2相关因子2,抑制SLC7A11表达,谷胱甘肽合成减少,致食管癌细胞和肺癌细胞对铁死亡更敏感[25]。上述发现揭示p53在诱导不同肿瘤细胞的铁死亡过程中作用不同。大量的膜孔蛋白分布于线粒体外膜,其亦称为VDAC,是真核细胞中离子和代谢物运输的跨膜通道[26]。Erastin可与VDAC家族中的VDAC2和VDAC3结合,改变膜的通透性和离子选择性,只允许阳离子进入线粒体,导致线粒体功能障碍和氧化剂释放,可以直接导致铁死亡[3]。见图1。
2 铁死亡和肿瘤的关系
越来越多研究发现,铁死亡与卵巢癌、头颈部肿瘤、肝癌、宫颈癌、胰腺癌以及肾癌等多种肿瘤细胞的生长调节密切相关[8,27-30]。见图2。文献报道,多种化合物和抗癌药物通过诱导铁死亡导致癌细胞死亡和抑制肿瘤生长[6,8]。Erastin与顺铂、阿糖胞苷、多柔比星联合应用,可提高化疗疗效,诱导肿瘤细胞死亡[2,31-33];青蒿素衍生物诱导耐药的肿瘤细胞发生铁死亡并限制其转移[33-35];小鼠异种移植模型中,铁死亡诱导剂与磺胺嘧啶或丁硫氨酸亚砜亚胺联合治疗可降低肺肿瘤的生长[13]。以上为细胞铁死亡的潜在机制,几种特殊类型癌细胞中铁死亡诱导的具体机制综述如下。

图2 铁死亡参与的多种肿瘤
2.1 卵巢癌
青蒿琥酯是青蒿素的半合成衍生物,是一种抗疟疾药物,同时具有良好的抗癌活性[36]。研究表明,青蒿琥酯通过增加细胞中活性氧水平,导致细胞DNA损伤和G2/M期阻滞,诱导卵巢癌HEY1和HEY2细胞铁死亡[35]。在培养基中加入铁死亡抑制剂进行预处理,则能减少青蒿琥酯造成的细胞毒性[35]。由此提示,青蒿琥酯可能通过诱导铁死亡来治疗卵巢癌。此外,铁代谢与卵巢癌细胞生长、扩散转移潜在相关[37]。在体外实验中,卵巢癌细胞内铁含量增多可抑制其增殖;在动物体内实验中,则表现出肿瘤生长抑制和腹腔内播散减少[37]。其机制可能是当铁代谢受到干扰时,转铁蛋白受体1表达增加引起铁摄取增多,膜铁转运蛋白表达抑制导致铁存储增加,最终细胞内铁过度积累诱发铁死亡[37]。
2.2 头颈部肿瘤
研究表明,铁死亡可以降低头颈部肿瘤细胞对顺铂治疗的耐药性[33]。Roh等[33]发现,无论是基因工具沉默system Xc-转录,还是Erastin和磺胺嘧啶等药物都可以抑制system Xc-活性。system Xc-抑制后引起GPX4抑制和谷胱甘肽消耗,并诱导细胞活性氧水平升高,最终诱发铁死亡,使对顺铂耐药的肿瘤细胞对顺铂更加敏感[33]。有文献报道,通过诱导细胞铁死亡,双氢青蒿素在治疗头颈部鳞癌方面有潜在作用[34]。具体机制是双氢青蒿素通过调控细胞周期调节蛋白的表达,在S期和G2/M期抑制肿瘤细胞有丝分裂并诱导铁死亡[34]。研究还发现,在含有去铁胺的细胞系中,去铁胺通过减少细胞内Fe2+对抗双氢青蒿素诱发的铁死亡。由此可见,在双氢青蒿素诱导肿瘤细胞死亡中,Fe2+参与是该过程所必需[34]。这些研究表明,诱导细胞铁死亡可能是头颈癌治疗的有效策略。
2.3 肝细胞癌
肝细胞癌细胞铁死亡分为两类,一类与铁代谢相关,另一类与脂质代谢相关。吡格列酮通过稳定铁硫结构域1,抑制线粒体对铁的吸收,可以减少由Erastin引起的脂质过氧化和肝癌细胞铁死亡[38]。去铁胺能影响肝癌细胞的铁代谢,抑制索拉非尼诱导的细胞氧化应激反应,从而对抗索拉非尼对肝癌细胞的细胞毒性作用[39]。此外,在索拉非尼诱导细胞死亡的过程中,氟哌啶醇可以显著增加细胞中Fe2+和谷胱甘肽含量,以及活性氧水平,增强索拉非尼对肝癌细胞的毒性作用[40]。除铁代谢外,脂代谢也在肝细胞癌的铁死亡中起重要作用。在大鼠肝癌模型、小鼠肝癌细胞系中,低密度脂蛋白二十二碳六烯酸通过直接降解GPX4、消耗谷胱甘肽和促进脂质过氧化诱导肝癌细胞铁死亡[41]。金属硫蛋白1作为一种负调控因子,其下调可增加谷胱甘肽消耗和脂质过氧化物生成,加速索拉非尼诱导癌细胞死亡,增强皮下移植瘤模型中索拉非尼抗癌活性[42]。类似的铁死亡负调控因子还有视网膜母细胞瘤蛋白、核因子红细胞2相关因子2、p53,通过抑制其表达可增加索拉非尼药效并降低肝癌细胞耐药性[14,24,43]。这些分子可能是克服人肝细胞癌细胞对索拉非尼耐药的潜在治疗靶点。
2.4 其他肿瘤
在K-Ras基因突变型胰腺癌细胞中,青蒿琥酯不仅可以直接诱导脂质过氧化和活性氧水平升高,还能通过调控铁代谢来促进细胞铁死亡发生[44]。此外,在胰腺癌细胞中,system Xc-中SLC7A11蛋白表达上调,增加胱氨酸摄取,导致谷胱甘肽水平升高[45]。细胞内谷胱甘肽增多促进胰腺癌生长,并减少吉西他滨诱发的氧化应激和细胞死亡[45]。抑制SLC7A11蛋白表达诱发细胞铁死亡,可能是解决胰腺癌对吉西他滨耐药的潜在方法[45]。在横纹肌肉瘤细胞培养基中添加Erastin和RSL3,可以抑制system Xc-、减少谷胱甘肽生成并诱导细胞铁死亡[46]。另有文献报道,在弥漫性大B细胞淋巴瘤和肾细胞癌中,Erastin作用于GPX4,以积累脂质活性氧的方式诱导细胞铁死亡[5]。总之,已发现多种与铁死亡相关的调节分子和药物可直接或间接影响肿瘤细胞发生铁死亡;但是,在不同肿瘤细胞中铁死亡的作用机制以及调节因子不尽相同。
3 问题和展望
铁死亡是一种新发现的细胞死亡形式,它主要由活性氧积累和脂质过氧化诱发。抑制GPX4和system Xc-活性、调控p53以及线粒体功能障碍是铁死亡的潜在机制。半胱氨酸、脂质和铁代谢参与多种肿瘤细胞的铁死亡。青蒿琥酯、Erastin、氟哌啶醇、RSL3等药物通过铁死亡作用诱导癌细胞死亡并发挥治疗作用。在头颈部肿瘤、卵巢癌、肝细胞癌、胰腺癌等肿瘤中,p53、SLC7A11、视网膜母细胞瘤蛋白、铁硫结构域1、金属硫蛋白1等分子参与铁死亡。然而铁死亡详细的信号通路和关键的转录调控因子仍然未知。此外,铁死亡在肿瘤细胞的转移、自噬和耐药等方面的作用有待进一步研究。
