硝酸锂改性钛系离子筛的制备及其吸附性能
2020-04-06郭佳明刘明言吴强马永丽
郭佳明,刘明言,2,吴强,马永丽
(1 天津大学化工学院,天津300350; 2 化学工程联合国家重点实验室(天津大学),天津300350)
引 言
锂及其化合物因具有特有的优良性能而广泛地应用于新能源汽车电池、超轻高强度锂铝合金、核聚变冷却剂和燃料、核聚变发电、航空和航天等高科技领域[1-5]。锂矿资源开发存在成本、能耗和环境问题,促使液态锂资源受到更多关注[6-7]。层状钛系离子筛H2TiO3具有较高的理论最大吸附容量、可再生性和选择性,而常被进一步改性研究[8-11]。钛系离子筛的主要合成方法有固相法[12-13]、溶胶-凝胶法[14]和水热法[15-16]等。固相法合成具有反应条件不需精确控制、反应时间短、过程简便等优点,但是,通过固相法合成出的离子筛吸附量普遍较低[14]。最近,Gu 等[17]使用醋酸锂替换碳酸锂合成了钛系离子筛,降低了合成温度,对西台吉乃尔的卤水吸附量达到24.5 mg·g-1,准二级动力学常数为0.0508 g·(mg·h)-1;Wang 等[18]在氢氧化锂中掺杂了氧化铁,在pH 为8.8、Li+浓度为1.56 g·L-1的溶液中,吸附量达到34.8 mg·g-1,准二级动力学常数为0.024 g·(mg·h)-1。这些研究使其吸附量得到较大程度的提高,但是,吸附速率仍维持在较低水平,而提高吸附速率对于锂离子筛的工业应用具有重要意义。
硝酸锂作为一种高活性的锂源,已经在合成高吸附速率的锰系离子筛中被研究[19-22],但是,将其作为固相反应的锂源合成钛系离子筛,以提高吸附速率的研究尚未见报道。本文采用由硝酸锂和碳酸锂组成的混合锂源,与二氧化钛进行固相反应,以合成兼顾吸附容量和吸附速率的改性钛系锂离子筛,并对其锂离子吸附容量和吸附速率进行评估,探究其吸附机理。
1 实验材料和方法
1.1 主要仪器以及试剂
试剂:硝酸锂(上海阿拉丁生物生物科技有限公司),二氧化钛(锐钛型,上海麦克林生化科技有限公司),碳酸锂(嘉兴思诚化工有限公司),盐酸(天津市元立化工有限公司),氯化铵(福晨天津化学试剂有限公司),浓氨水(25%~28%,天津市科密欧化学试剂有限公司),氯化钠、氯化钾(天津市江天化工技术有限公司),六水合氯化镁、二水合氯化钙(天津市科密欧化学试剂有限公司),以上均为分析纯试剂,去离子水(永清源蒸馏水经营部)。
仪器:氮气保护马弗炉(KSXQ-6-14 型,宜兴市飞达电炉有限公司);集热式恒温加热磁力搅拌器(DF-101S型,天津星科仪器有限公司);高温差热分析仪(STA449F3 型,德国耐驰公司),测试条件为30~800℃,10℃·min-1升温速率;X 射线衍射仪(XRD)(D/MAX-2500 型,日本理学公司),扫描范围为10°~70°,10(°)·min-1;便携式精密pH 计(PHB-4型,上海仪电科学仪器有限公司);扫描电子显微镜(SEM)(ZEISS SUPRA55型,上海铸金分析仪器有限公司);电感耦合等离子体发射光谱仪(ICP-OES)(7000 series型,Thermo 公司);全自动气体吸附系统(ASAP2020 型,美国);Zeta 电位分析仪(Zetasizer Nano S90型,英国马尔文公司)。
1.2 离子筛前体的制备
将碳酸锂和二氧化钛以2∶1的摩尔比常温放入马弗炉中,在空气气氛中以6℃·min-1速率升温至700℃并保温4 h[11],冷却至室温后得到离子筛前体,记为改性前离子筛前体。
将硝酸锂和碳酸锂按一定的比例混合后加入二氧化钛在常温下放入马弗炉中,同时保证体系内锂和钛两元素的摩尔比为2∶1。在空气气氛中以6℃·min-1速率升温至300℃后保温1 h,以保证硝酸锂完全熔化,再以相同升温速率升温至500℃并保温4 h,冷却至室温后得到改性后离子筛前体。
对改性前后的锂钛原料进行差热分析,探究改性影响。
1.3 离子筛前体的酸洗
取1 g改性后离子筛前体,加入100 ml不同初始浓度的盐酸,在25℃下搅拌24 h[11]。取上清液,通过直径为0.22 μm 的滤膜后,采用ICP-OES 测定滤液的Ti4+和Li+浓度,分析酸洗液的最佳浓度。所有ICP数据测量次数不少于两次,结果取平均值所得,标准差小于1%。将最优酸浓度酸洗后的混合液用0.22 μm 的滤膜过滤,并洗涤至洗液中性,放入烘箱中60℃干燥6 h 得改性后离子筛,记为HTO-2。对改性前离子筛前体进行相同条件的酸洗,得到改性前离子筛,记为HTO-1。
将改性前后的离子筛进行XRD 分析、SEM 测试、粒度分析以及BET分析,评价改性效果。
1.4 锂离子筛在缓冲溶液下的吸附性能
为消除吸附过程pH 下降对吸附的影响,所有Li+溶液均采用缓冲溶液以保证pH 相对稳定。在1 L 去离子水中加入1.5 g氯化铵和5 ml浓氨水,得pH为9.50 的氨缓冲溶液,接着加入一定量的硝酸锂得Li+初始浓度为70 mg·L-1的氨缓冲溶液。
取不同添加比例合成出的离子筛前体在最优酸洗条件下酸洗后,放入Li+初始浓度为70 mg·L-1的氨缓冲溶液中吸附24 h,用ICP-OES 测定吸附前后溶液中的Li+浓度,根据式(1)计算出吸附量,将最高吸附量时的添加比例定义为最佳添加比例,并以该比例制得的离子筛进行后续吸附实验。

为测定吸附速率以及达到平衡的时间,取Li+初始浓度为70 mg·L-1的氨缓冲溶液100 ml,加入0.1 g改性前后离子筛,30℃下恒温搅拌不同的时间,分析吸附前后Li+浓度,对比改性前后离子筛的吸附速率常数。
为评价改性性能,在氨缓冲溶液中加入适量的硝酸锂配制出不同初始浓度的Li+溶液。取不同初始浓度的锂溶液100 ml,分别加入0.1 g 改性前后的离子筛,30℃下恒温搅拌24 h。分析吸附前后Li+浓度,对比改性前后离子筛的吸附量。
为评价吸附剂的吸附选择性,在氨缓冲溶液中配制出Li+、Na+、Ka+、Ca2+、Mg2+浓度均为70 mg·L-1的溶液。取该溶液100 ml,加入0.1 g 改性后离子筛,30℃下恒温搅拌24 h,对比吸附前后溶液中各种阳离子的浓度变化。
将吸附后的改性后离子筛过滤,用0.2 mol·L-1的盐酸溶液,以0.1 g 固体与50 ml溶液的比例,使其25℃脱附24 h[23],洗涤过滤后60℃干燥6 h,接着在Li+初始浓度为70 mg·L-1的氨缓冲溶液中,重复进行下次吸附实验,测量吸附量。如此循环5次,研究吸附剂的循环再生性能。
2 实验结果与讨论
2.1 钛系锂离子筛的制备与表征
2.1.1 热重分析 图1(a)为碳酸锂和二氧化钛的热重分析曲线,图1(b)为碳酸锂、硝酸锂和二氧化钛的热重分析曲线。mass 为质量变化曲线,DTA 为热量变化曲线,正值代表体系放热,负值代表体系吸热。图1(a)中, 体系在450~700℃之间质量下降明显,并伴有吸热峰,711℃以上体系质量不变,表明固相反应到700℃左右完全停止,后续热量消耗为碳酸锂熔化所致。图1(a)中DTA 在700℃左右的凸起由反应停止和碳酸锂熔化共同导致。图1(b)中,体系在255℃左右存在一吸热峰,质量无明显变化,表示新加入的硝酸锂在此温度下熔化。随着温度上升,体系在500~600℃之间质量下降明显,并伴有吸热峰,600℃以上质量不变,表明反应到600℃完全停止。
对比图1(a)、(b)mass 曲线,相同的升温速度下,加入硝酸锂后,反应区间明显缩短,反应提前结束,表明固相反应速率得到提高。因此,可以推断出硝酸锂具有较碳酸锂更高的反应活性和反应速率。
2.1.2 XRD 分析 分别将改性前后的离子筛以及离子筛前体进行XRD 分析,用Jade 6.0 处理后得到图2。图2 中a、b、c、d 四条曲线分别为改性前离子筛、改性后离子筛、改性前离子筛前体、改性后离子筛前体的XRD 图。通过比对Li2TiO3的标准卡片(ICDD PDF #33-0831)可以得出,合成的离子筛为层状的Li2TiO3晶体。同时,在2θ为27.5°和54.3°处,a、c 两条线相比于b、d 两条线有明显的锐钛型TiO2(ICDD PDF #21-1276)的晶面峰。这表明,经过改性,TiO2被基本反应完全,离子筛中不再含有杂质TiO2。此外,对比b、d 两条曲线可以看出,经过酸洗,(-133)和(-206)峰明显消失,(002)和(-131)峰有略微向右偏移的趋势,峰强度因为插入H+而减小,Li2TiO3已成功转变成了H2TiO3[24]。
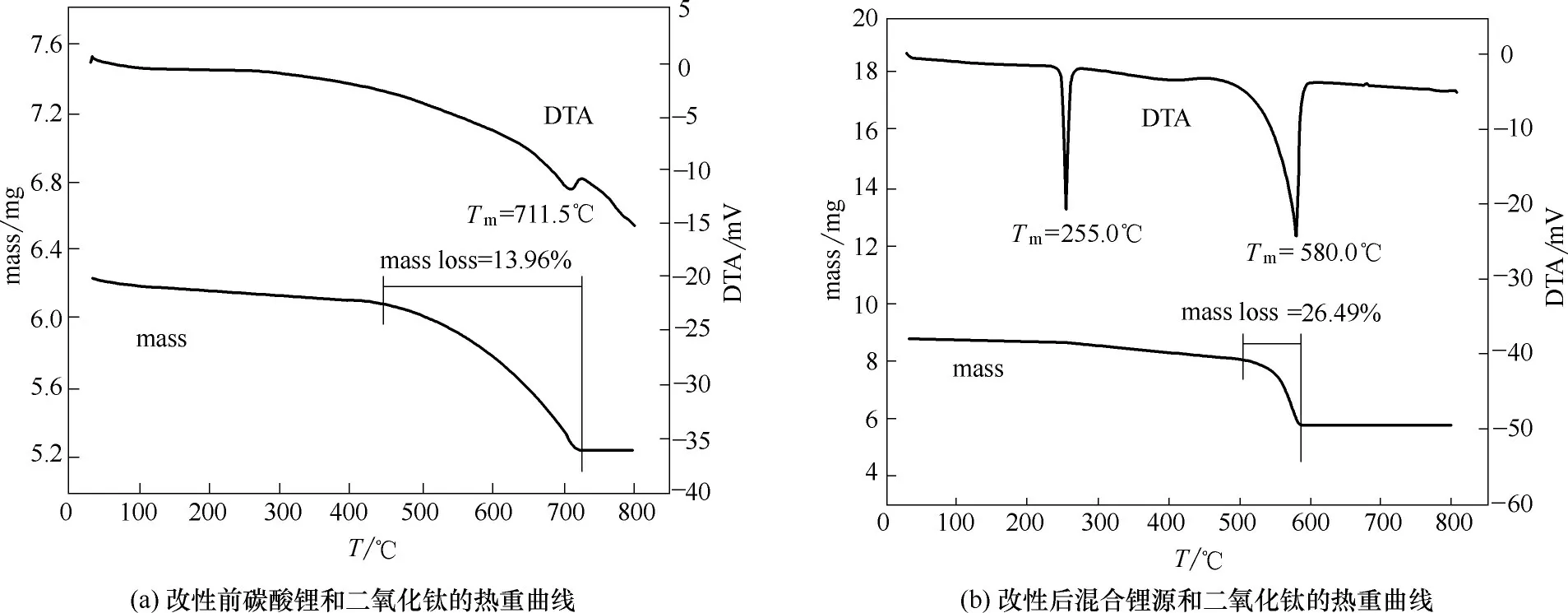
图1 改性前后原料的热重曲线Fig.1 TG-DTA curves of material before and after modification
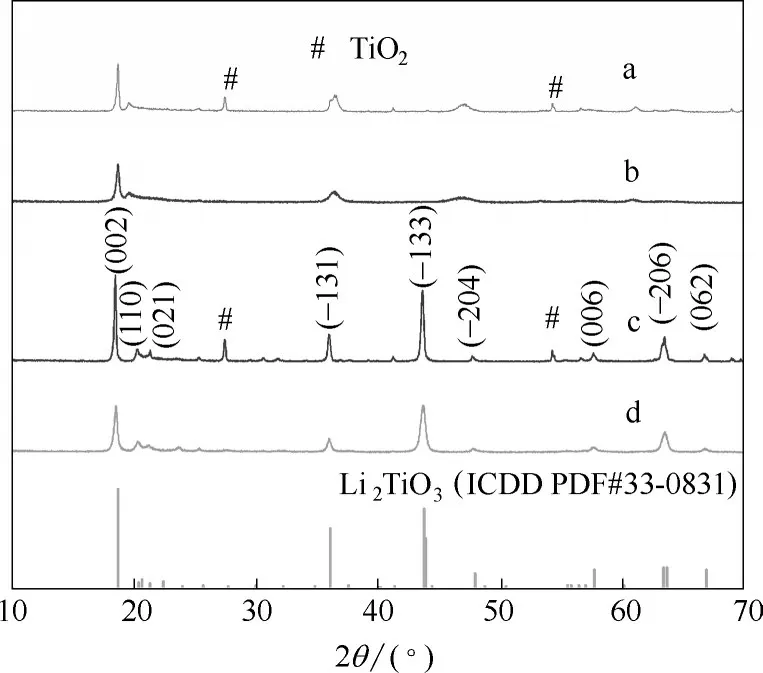
图2 离子筛和前体的XRD谱图Fig.2 XRD patterns of ion sieves and ion sieve precursors
2.1.3 SEM 分析 图3为改性前后的离子筛扫描电镜图,放大倍数为5万倍。可以看出,图3(a)中颗粒团聚严重,且粒径较图3(b)中的普遍更大。这是因为固相反应温度由700℃降低至500℃,减少了高温下煅烧引起的颗粒团聚[25]。
2.1.4 粒度分析 用Zeta 电位分析仪分析改性前后离子筛粒径分布,结果如图4所示。可以看出,因为固相反应温度降低,颗粒粒径在整体上有一定的下降,这与SEM 分析得出的结论一致。通过对曲线积分计算,可得改性前离子筛体积平均粒径为718.3 nm,经过改性体积平均粒径降到434.5 nm。同时,改性后离子筛中的小部分颗粒粒径急剧下降,达到了100 nm左右。
2.1.5 BET 分析 图5 为改性前后离子筛的N2吸附-脱附等温线和孔径分布曲线,根据IUPAC 分类可得图5(a)中的两条等温线属于Ⅳ型,回滞环属于H3 型[15]。改性后离子筛的吸附等温线相比于改性前有明显的上升,表明其比表面积显著增大。截取改性前后离子筛在P/P0为0.05~0.30 之间的吸附量,用BET 方程分析,可得离子筛的比表面积由27.8041 m²·g-1上升到49.1483 m²·g-1。通过对改性前后离子筛脱附等温线进行BJH 分析得到图5(b)的孔径分布曲线。可以看出,改性后曲线的峰高明显高于改性前,且峰位置更靠近零点。这说明改性后离子筛的孔体积有明显增加,且出现了很多的介孔,以30 nm左右孔径的介孔居多。
其成因可能是由于硝酸锂的反应速率大于碳酸锂。在硝酸锂刚反应完时,此时前体主体已经形成,但碳酸锂仍未完全反应,被包裹在前体主体中。随着时间的推移,碳酸锂逐渐被完全反应,产生了一些新的细小粒径的颗粒,而其之前在主体中占据的位置将变成空穴留在主体中。细小的颗粒和大量的空穴增加了离子筛前体的比表面积。粒度分析和BET 分析得出的粒径为100 nm 左右的颗粒和30 nm左右的介孔,可以很好地给予解释。
2.1.6 离子筛前体酸洗时锂的脱出率和钛的溶损率 图6 为不同酸浓度对离子筛前体酸洗的影响。可以看出,随着酸浓度的上升,离子筛的Ti4+溶损率逐渐上升,而Li+的脱出率随酸浓度上升至0.2 mol·L-1后,几乎保持不变。Li+的脱出可以增大离子筛的吸附容量,而Ti4+的溶损则会破坏离子筛骨架结构,减少离子筛的吸附容量。因此,需要选择合适的酸浓度,使Li+脱出率最大,Ti4+溶损率最小。同时,盐酸浓度如果超过0.25 mol·L-1,则会在离子筛中产生金红石型的二氧化钛,不利于吸附[26]。综合考虑,选取0.2 mol·L-1的盐酸,作为前体酸洗液和吸附后离子筛再生酸溶液。

图3 改性前后离子筛SEM图Fig.3 SEM images of ion sieves before and after modification
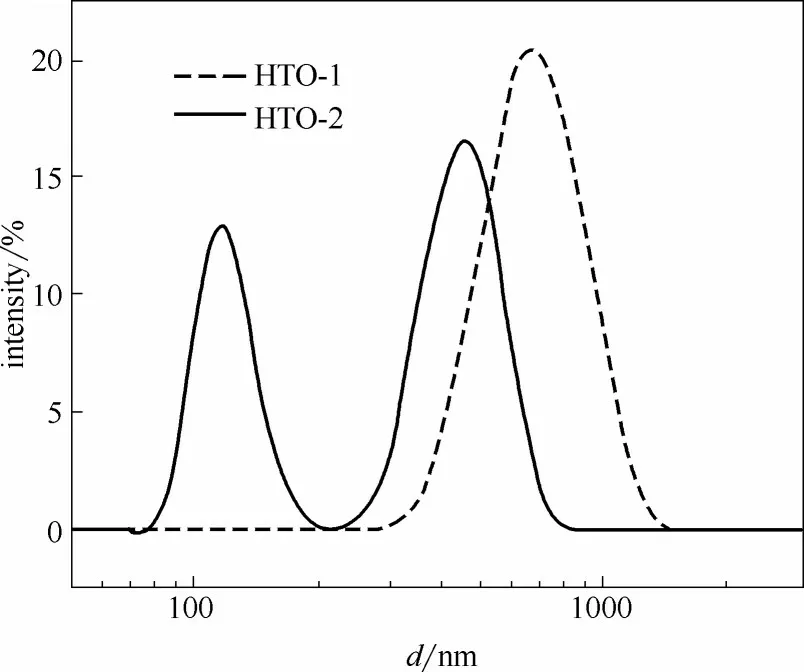
图4 改性前后离子筛粒径分布Fig.4 Particle size distribution of ion sieves before and after modification
2.1.7 硝酸锂添加比例的选择 将不同硝酸锂添加比例条件下合成的离子筛前体,在相同条件下酸洗和吸附,其吸附量结果如图7 所示。添加比例定义为硝酸锂添加量占总锂元素量的摩尔比。添加比例为0时,锂源中只有碳酸锂,吸附量最少。添加比例上升,未反应完的二氧化钛越来越少,得到的H2TiO3更纯净,吸附量开始上升。当添加比例上升到0.9 左右时,由XRD 分析得出前体中已无二氧化钛,此时吸附量达到峰值。随着添加比例继续上升到1,锂源为单一硝酸锂时,合成出的离子筛前体没有多孔结构,吸附量反而有所下降。
2.2 钛系锂离子筛的吸附性能
2.2.1 吸附动力学 将改性前后的离子筛放入Li+初始浓度为70 mg·L-1的氨缓冲溶液中,0.1~48 h的吸附量结果如图8(a)所示。可以看出,无论是改性前或是改性后的离子筛,吸附在4 h 几乎达到平衡,吸附时间延长到48 h 对吸附量影响不大。但改性使吸附量上升,从而吸附速率也有一定程度的上升。常用的吸附动力学模型主要有准一级动力学、准二级动力学和颗粒内扩散模型,其公式分别为式(2)~式(4)[27-28]。
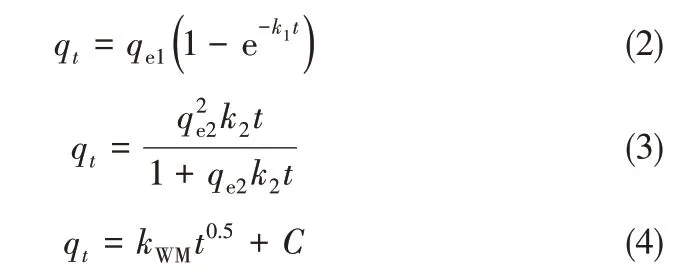
式中,t为吸附时间;qt为离子筛在t时刻的吸附量;k1、k2、kWM分别为准一级、准二级、颗粒内扩散常数,代表吸附速率的大小;qe1、qe2分别为准一级、二级动力学模型下的平衡吸附量;C为常数,与边界层厚度呈正比。
将qt对t0.5作图得到图8(b),可以看出,改性前后离子筛的线性关系均良好,表示颗粒内扩散是影响吸附的重要因素。吸附过程分为初始吸附和平衡两个阶段[29],在初始吸附阶段,改性后离子筛拟合线经过原点,表示其吸附速率仅受颗粒内扩散控制,而改性前离子筛拟合线不经过原点,吸附速率受颗粒内扩散和外表面扩散同时控制[30];改性后离子筛拟合直线的斜率较之改性前更大,这是由于其多孔结构使颗粒内扩散的阻力减小所致。在平衡阶段,吸附活性中心近似饱和,吸附速率下降,颗粒内扩散变得更加困难。
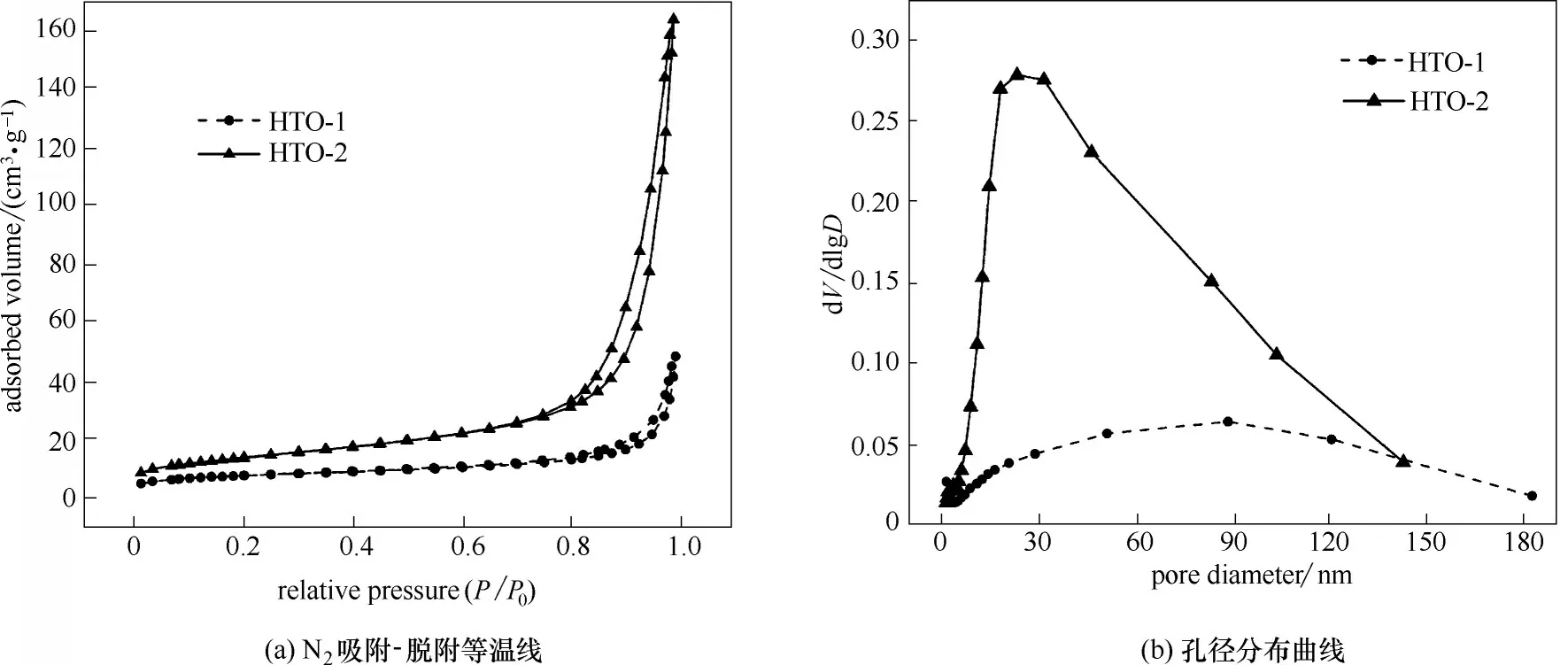
图5 改性前后离子筛的N2吸附-脱附等温线和孔径分布曲线Fig.5 N2 adsorption-desorption isotherms and pore size distribution curves of ion sieves before and after modification
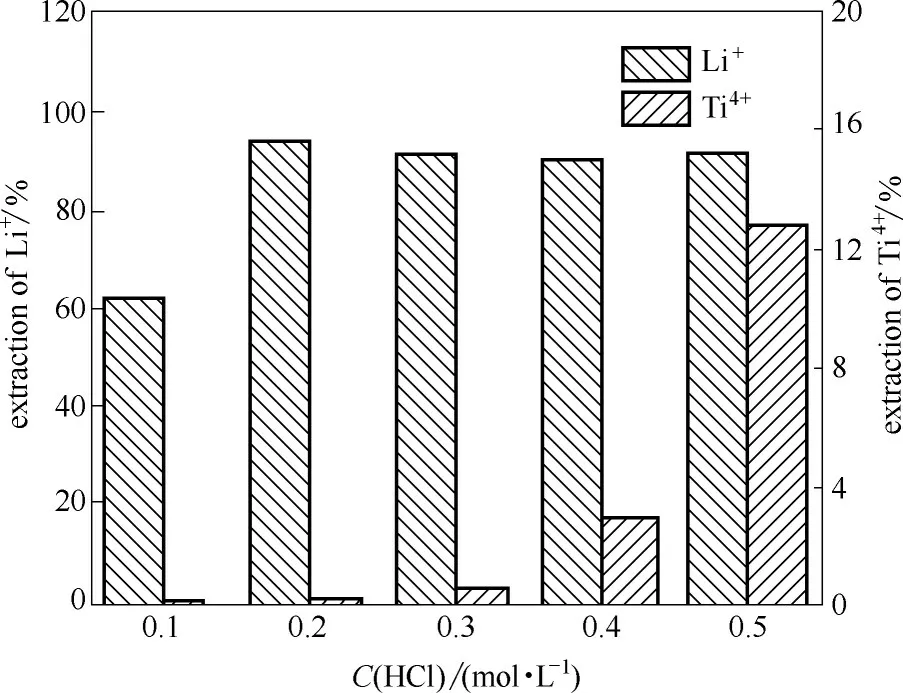
图6 锂钛的洗脱率随酸浓度的变化Fig.6 Li+uptake and Ti4+loss in pickling solution with different acid concentrations
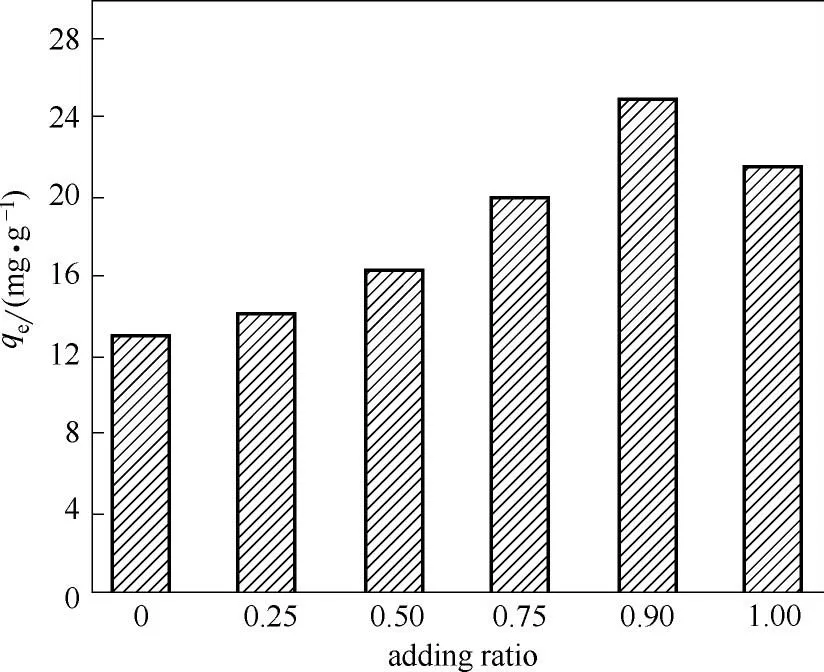
图7 硝酸锂添加比例对锂离子筛吸附量的影响Fig.7 Lithium adsorption capacity of ion sieves varies with adding ratio of lithium nitrate
表1中的动力学参数由实验数据分别对准一级和准二级动力学模型非线性拟合得到。其中R2值在0~1 之间,越接近于1 表示实验值与该拟合曲线越接近。图8(a)中的拟合曲线为准二级动力学模型拟合曲线。可以从表1 中的R2值看出,准二级动力学模型更满足改性前后离子筛的吸附模型,表示吸附更接近于化学吸附过程[31],这符合离子筛的H+与Li+离子交换的吸附机理。表1 中改性前后离子筛的吸附速率常数k2分别为0.1787 g·(mg·h)-1和0.2762 g·(mg·h)-1,即改性使离子筛吸附速率上升了54.56%。同时,硝酸锂改性离子筛的吸附速率常数也远大于醋酸锂改性离子筛的0.0508 g·(mg·h)-1[17]和氧化铁掺杂离子筛的0.024 g·(mg·h)-1[18],表明在吸附速率的提高上,硝酸锂的改性效果明显优于其他固相合成的改性效果。
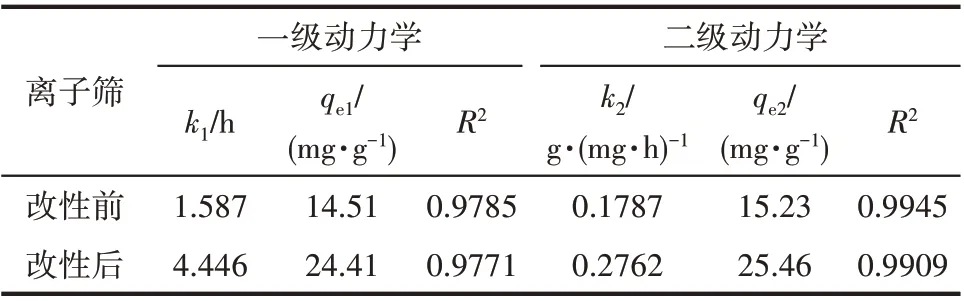
表1 改性前后离子筛动力学参数Table 1 Kinetics parameters of ion sieves before and after modification
2.2.2 吸附等温线 将改性前和改性后离子筛都分别放入不同Li+浓度的缓冲溶液中,Li+的初始浓度从11.6 mg·L-1逐渐增加到190 mg·L-1,实验结果如图9 所示。平衡吸附量qe随平衡浓度Ce的上升而上升,且趋势越来越平缓。对比改性前后的吸附性能曲线可以发现,吸附量约升高10 mg·g-1。原因主要是离子筛改性后较之改性前,有较大的比表面积,因此,具有较多的吸附活性点位,增加了吸附量。此外,改性前后离子筛分别放入11.6 mg·L-1的Li+缓冲溶液吸附,溶液的平衡浓度为1.12 mg·L-1和0.026 mg·L-1。即经过改性,离子筛对低浓度锂溶液的Li+去除率由90.34%提高为99.77%,表示改性后离子筛对低浓度锂溶液具有更优良的锂去除能力。
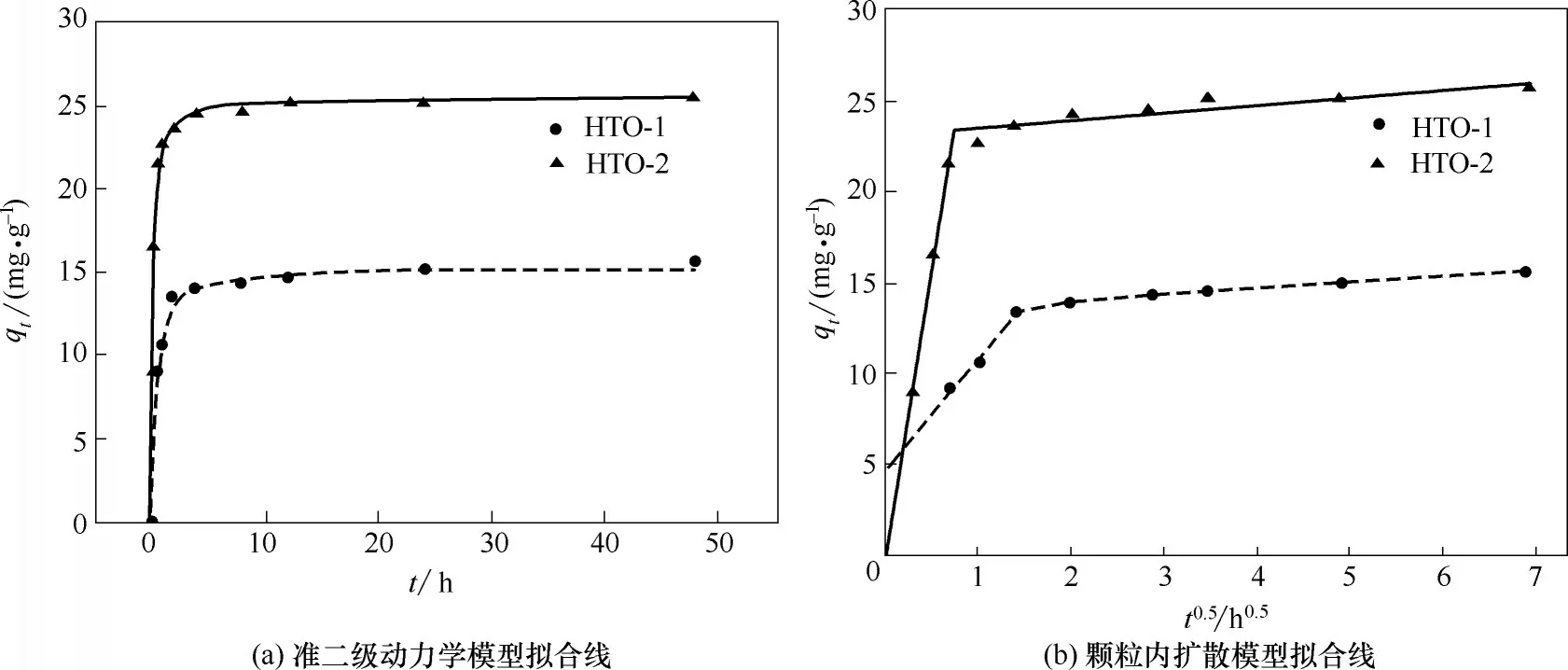
图8 改性前后离子筛吸附量随吸附时间的变化Fig.8 Lithium adsorption capacity of ion sieves varies with adsorption time

图9 吸附量随平衡浓度的变化Fig.9 Adsorption capacity of ion sieves varies with equilibrium concentration
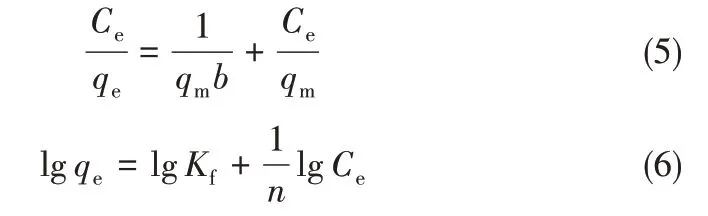
吸附平衡通常可以用吸附等温线来描述。常用的吸附模型有Langmuir 和Freundlich 两种,其线性形式分别为式(5)和式(6)[32]。将改性前后的吸附结果分别对两式线性拟合,得表2。可以看出,改性前后两种离子筛均更符合吸附Langmuir 模型,表明吸附为单分子层吸附[33]。且改性后离子筛的R2相较于改性前更接近于1,可能因为通过改性,离子筛颗粒粒径变得更加细小,致使吸附过程更加接近单分子层吸附。
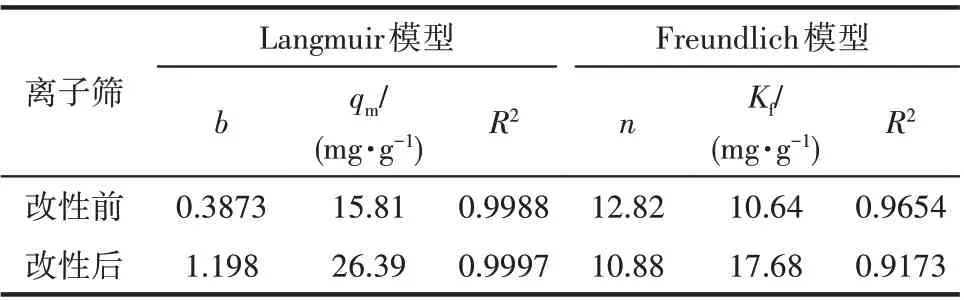
表2 改性前后离子筛吸附等温线参数Table 2 Adsorption isotherms parameters of ion sieves before and after modification
2.2.3 吸附选择性 将改性后离子筛加入多种阳离子共存的氨缓冲溶液中吸附,得到图10 的结果。改性后离子筛对Li+的吸附量为23.46 mg·g-1,远大于对其他阳离子的吸附量。该离子筛对Li+具有较高的选择性,这是由于离子半径和水合能的差异所致。Na+(0.102 nm)、K+(0.138 nm)、Ca2+(0.100 nm)的半径大于Li+(0.074 nm)的半径,使得其他阳离子很难克服空间位阻效应进入层状离子筛的夹层中[11]。而Mg2+半径(0.072 nm)虽然很接近Li+半径(0.074 nm),但Mg2+的水合自由能(ΔG0h= -1980 kJ·mol-1)是Li+水合自由能(ΔG0h= - 475 kJ·mol-1)的四倍以上[34],因此,Mg2+很难脱水而进入层状离子筛的夹层中,与H+离子交换。
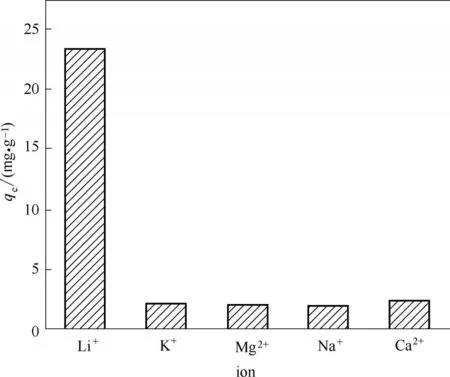
图10 改性后离子筛在多种阳离子共存时的吸附选择性Fig.10 Adsorption selectivity of modified ion sieves in presence of other cations
2.3 钛系锂离子筛的吸附循环性能
将改性后离子筛前体酸洗、吸附反复进行5次,得到图11 的结果。第一次循环为初始的离子筛。可以看出,经过多次循环之后,吸附量仍然保持较高的水平,大于22.5 mg·g-1。从第二次开始之后的吸附量相较于第一次的吸附量有所下降,主要因为第一次是将离子筛前体酸洗,其成分主要为Li2TiO3,而第二次之后是将吸附后的离子筛酸洗,其中H2TiO3和Li2TiO3共同存在,且H2TiO3偏多。这导致了之后几次酸洗结束时,酸洗液中的H+浓度比第一次有所提高,可以理解为酸洗时酸洗液浓度有所提高,使离子筛的钛溶损变高,影响了吸附量。对比多次吸附循环后离子筛的XRD 图[图11(b)]和SEM 图[图11(c)]可以看出,离子筛在经历多次循环后,仍然保持着相同的晶体结构和形貌。
2.4 层状钛系锂离子筛的结构
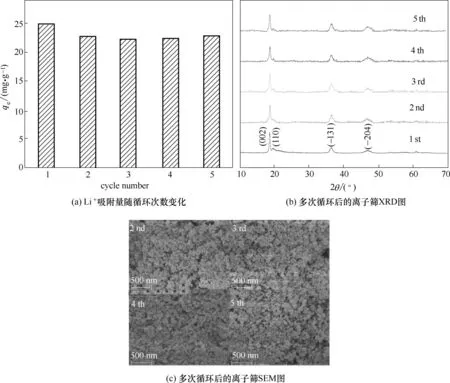
图11 改性后离子筛的循环性能Fig.11 Cycle performance of modified ion sieves
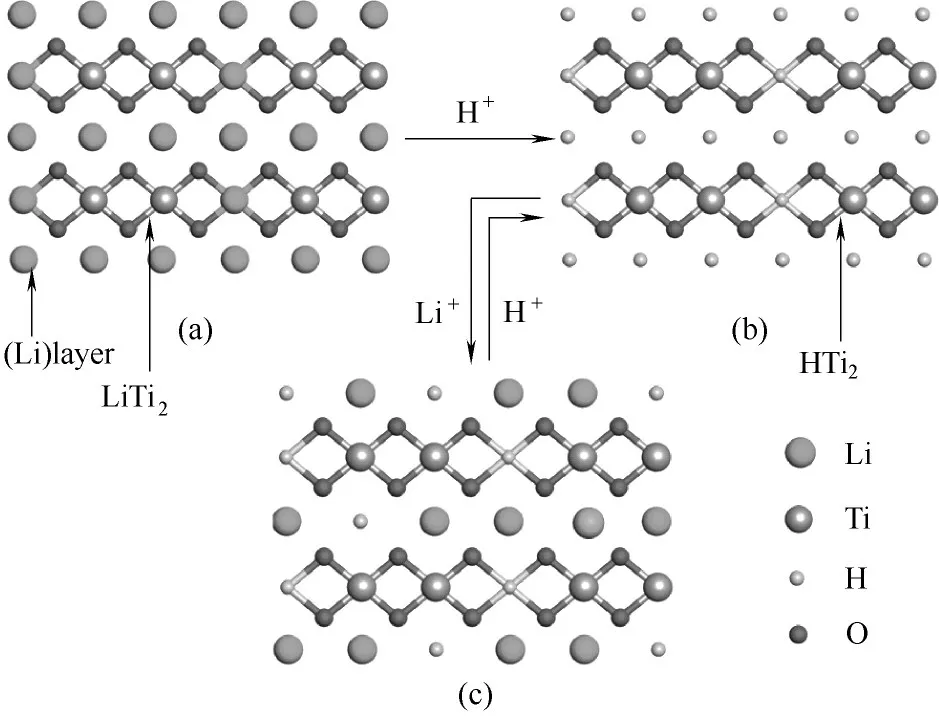
图12 离子筛前体(a)、离子筛(b)、吸附后的离子筛(c)的晶体结构示意图Fig.12 Crystal structure of ion sieve precursors(a),ion sieves(b)and ion sieves after adsorption(c)
离子筛前体Li2TiO3为层状结构,将分子式变为Li[Li1/3Ti2/3]O2可以很好地表达出这种结构。Li 和Ti在结构中形成了Li 层和LiTi2层两种类型的层[11]。如图12(a)所示,Li层只能被Li占据,而LiTi2层由1/3的Li 和2/3 的Ti 构成。加入酸之后,前体中的Li 层和LiTi2层Li都会被H+置换出来成为图12(b)所示的离子筛。图12(c)为吸附后的离子筛,He 等[25]指出了溶液中的Li+只能将Li层中的H+交换出来,很难将离子筛HTi2层中的H+交换出来。Li 层中的Li 元素占总量的3/4,这使得的钛系离子筛无论在何种吸附条件下,其吸附量都超过不了理论最大吸附量(126 mg·g-1)的3/4(94.5 mg·g-1)[13]。酸洗和吸附过程的反应方程式如式(7)~式(8)
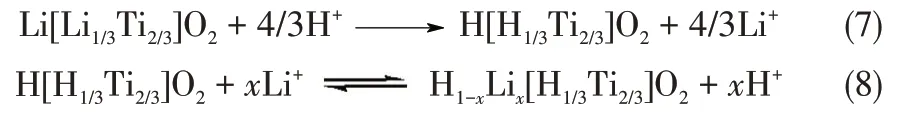
3 结 论
(1)热重分析、XRD、SEM、BET 分析和粒度分析的结果表明,硝酸锂和二氧化钛能成功合成钛酸锂,且离子筛经过硝酸锂添加改性后具有更小的粒径和更大的比表面积。
(2)酸洗、添加比例和循环性能的实验结果显示,固相反应在硝酸锂添加比例为0.9 时最佳;前体在0.2 mol·L-1盐酸中酸洗最优;酸洗得到的改性后离子筛在Li+初始浓度为70 mg·L-1的弱碱性氨缓冲溶液中,吸附量达到25.01 mg·g-1,具有良好的吸附性能和再生性能。
(3)吸附动力学和吸附等温线的测试结果表明,改性后离子筛具有较高的吸附速率,吸附过程符合准二级动力学模型和Langmuir 方程,为单分子层化学吸附,且在吸附初始阶段满足颗粒内扩散模型。准二级动力学方程拟合出的速率常数高达0.2762 g·(mg·h)-1,该改性后离子筛对11.6 mg·L-1低浓度锂溶液的Li+去除率高达99.77%,表明其具有较快的吸附速率和优良的锂去除能力。
(4)虽然颗粒的细小有助于提高吸附速率和吸附容量,但是却不利于工业化应用。因此如何高效地将细小颗粒负载在多孔的介质上,是一个有价值的研究方向。
符 号 说 明
b,n——分别为Langmuir 和Freundlich 模型表示吸附强度的常数
C——表示边界层厚度的常数,mg·g-1
C0,Ct,Ce——分别为初始、吸附结束后、吸附平衡时溶液Li+浓度,mg·L-1
kWM——颗粒内扩散常数,mg·(g·h0.5)-1
k1——准一级动力学方程拟合出的速率常数,h
k2——准二级动力学方程拟合出的速率常数,g·(mg·h)-1
m——吸附剂加入的量,g
qe,qe1,qe2——分别为实验数据计算得出、准一级、准二级动力学方程拟合出的平衡吸附量,mg·g-1
qm,Kf——分别为Langmuir 和Freundlich 模型拟合出的最大平衡吸附量,mg·g-1
R2——线性相关系数
T——差热分析的温度,℃
t——吸附时间,h
