煤颗粒燃烧过程氧化机理及有机氮转化的分子模拟:以宁东红石湾煤为例
2020-04-06杨慧芳关海莲李平夏英王凤徐文静白红存郭庆杰
杨慧芳,关海莲,李平,夏英,王凤,徐文静,白红存,郭庆杰
(省部共建煤炭高效利用与绿色化工国家重点实验室,化学国家级实验教学示范中心,宁夏大学化学化工学院,宁夏银川750021)
引 言
煤炭作为基础能源,在我国一次能源的生产与消费之中长期居于主导地位。2018 年全国能源消费总量46.4 亿吨标准煤, 原煤产量36.8 亿吨, 煤炭消费量占能源消费总量的59.0%[1]。煤炭利用中的重大科学问题是与煤炭的主要利用方式联系在一起的,热解和燃烧现在乃至今后几十年中仍将是煤的主要利用方式,其具有反应历程复杂、非均相反应等特点。煤的热解和燃烧反应的过程和机理研究是煤化学和煤化工领域重要的科学问题。
近年来,国内外学者对于不同条件下的煤燃烧特性做了大量实验研究,在煤粉燃烧机理方面取得了重要进展[2-8]。但是,目前研究缺乏原子分子水平上煤燃烧过程机理的精准识别,对于反应机理及燃烧规律缺乏系统性认识。因此,有必要对煤颗粒在不同燃烧条件下的反应机理进行研究。研究煤燃烧反应机理的基础和前提是了解煤炭的大分子结构特征,研究煤化学结构的重要方法是建立煤的结构模型。由于煤结构具有高度复杂性,且不同的煤具有不同的分子结构[9],因此有必要针对所研究煤样从分子尺度进行研究。其中近年来发展的反应分子动力学模拟(reactive force field molecular dynamics, ReaxFF MD)方法在煤的热解、气化和燃烧机理研究方面取得了良好的应用效果[10-14],国内尤其是中国科学院过程工程研究所李晓霞团队[15-17]研究较为全面。Castro-Marcano 等[18]建立了美国伊利诺斯州6 号煤焦的大分子结构模型,并用该模型进行ReaxFF 模拟煤焦的燃烧过程,结果证明了ReaxFF MD 方法在煤燃烧中的适用性。林蔚[19]基于ReaxFF MD 方法研究了煤炭热解等过程,将实验结果与量子化学结果进行了对比,验证了ReaxFF MD方法在煤的热解研究中具有可靠性。
然而,煤炭的利用正面临着一些严峻的环境挑战。煤中的氮元素是煤在燃烧过程中环境污染物NOx释放的主要来源。普遍认为氮元素在煤中主要以有机形式存在,含量为0.5%~3.0%[20]。燃烧过程中释放NOx的问题需要详细了解氮的转化机制后进行探究,因此,研究煤燃烧机理、掌握氮的转化机制对于燃煤过程中NOx的减排问题具有重要意义。目前,针对煤粉燃烧过程中氮的转化机理已开展了大量的ReaxFF MD 模拟研究。李莹莹等[21]通过ReaxFF MD 方法模拟褐煤热解中氮转化的过程,结果证明加氧体系中有大量氮氧化物生成,氮氧化物主要为NO。由于煤中的氮元素一般以吡啶、吡咯等形式存在,Liu 等[22-24]基于ReaxFF MD 方法利用吡咯、吡啶作为模型化合物模拟煤中氮的热解燃烧转化过程,模拟定性预测了产物的演化特征。
宁夏宁东能源化工基地作为中国14 个亿吨级煤炭生产基地之一,人均煤炭资源占有量位居全国第一[25]。目前研究宁东煤的相关文献[26-27]有限,对宁东煤结构及反应性的研究较为缺乏,也没有相关煤燃烧机理及氮转化的深入研究。本研究团队前期以宁东红石湾煤(其工业分析、元素分析和表征数据的结果见文献[26])为代表,构建了煤的大分子模型,对其原子分子尺度的组成、结构、形态和化学键信息进行了研究。但是,对该煤样的燃烧机理和氮转化过程的认识尚不明确,还需要进一步研究。本文在前期研究的基础上构建煤的多分子聚集态模型,使用ReaxFF MD 方法对宁东红石湾煤的燃烧过程进行模拟,考察不同条件对煤燃烧产物和NOx的影响,并总结煤中氮的转化路径,力求在分子水平上探究煤燃烧反应产物分布特征及氮转化规律。
1 煤模型和模拟方法
研究选用反应分子动力学计算方法,使用阿姆斯特丹密度泛函(ADF)计算平台中的ReaxFF 反应力场。通过数据处理对热反应中产生的自由基进行监测、捕获,进而获得众多产物的分布和基元反应[28]。Zhang 等[29]和Chen 等[30]验 证 了ReaxFF MD 方法在煤-气相互作用系统中的适用性。本研究选用C/H/O/N/S/B 力场、正则系综(NVT)进行红石湾煤的燃烧模拟,设置时间步长为0.25 fs,升温速率为100 K/ps。
本团队前期经过多次模型修正、退火计算和几何构型优化获得了红石湾煤大分子结构模型(C221H148O28N2)[26],将全电子量子化学计算给出的FT-IR 与13C NMR 模拟谱图与实验谱图进行对比,可以发现从峰形和峰强度上都有较好的对应关系,验证了所构建模型的合理性,说明此模型能够代表红石湾煤的结构特征。本研究以已有的红石湾煤模型为基础,利用ADF 程序进行分子动力学模拟,进一步构建红石湾煤的多分子聚集态结构模型。将10 个单分子结构置于100 Å×100 Å×100 Å(1 Å=0.1 nm)的空间网格中,对模型进行NVT 系综的退火处理,进行两个退火循环,对几何构型进行优化之后再进行100 ps 的NPT 退火处理。最终将NPTMD 模拟得到的煤多分子聚集态平衡结构作为后续模拟的初始模型。NPT退火过程中煤聚集态模型的能量和密度随着退火的进行逐渐趋于稳定,说明所构建模型的稳定性。最终,获得平衡的红石湾煤模型盒子(C2210H1480O280N20)大小为37.94 Å × 36.13 Å ×37.60 Å,密度为1.1 g/cm3,与实际煤的密度1.3 g/cm3相当。本文所构建煤多分子聚集态模型虽然是由10 个单分子结构退火后得到,但在聚集态的模拟过程中10个单分子还是保持了完整的分子结构,只是彼此之间组装形成一个聚集状态的分子结构。因此它的化学键环境、原子种类和基本结构单元并未发生改变,与单分子的NMR、13C NMR 光谱实验仍然是吻合的。同时,Castro-Marcano 等[18]的研究方法与本文类似,说明本研究系统可以进行煤炭燃烧模拟,并且可以用来表征煤炭的宏观燃烧特征。
本研究基于煤分子聚集态模型进行燃烧过程的ReaxFF MD 模拟,观察化学当量比和温度对煤燃烧机理的影响。首先,分别建立含有煤分子聚集态模型与1250、2500 和5000 个氧气分子混合的周期性盒子,其化学当量比分别为0.5、1 和2,反应体系盒子的密度均为0.5 g/cm3。随后,为了得到最优化的模型,选取NVE-MD 系综,在10 K 的较低温度下进行能量最小化模拟。最后,在3000、3500 和4000 K 温度下,对每个周期性盒子进行100 ps 的煤燃烧模拟,所需升温时长分别为27、32 和37 ps。本文将煤燃烧模拟设定在较高的温度下进行,一方面是为了减少模拟时间[31-32],另一方面为了使化学反应能够在合理的时间尺度内发生(在ps 范围内),让模拟过程能显示出与实验类似的引发机制。因此,本文所构建的多分子煤聚集态结构模型需要在高温下进行反应模拟,才能使煤结构在100 ps内完全燃烧。Castro-Marcano 等[18]在以往的研究内容中选用3000、3500 和4000 K 作为伊利诺斯州6 号煤焦的燃烧温度,贺红坡等[23]也选用该温度区间进行吡咯类氮在空气中燃烧的分子动力学模拟。在研究者们以往的工作中表示,通过高温ReaxFF模拟燃料热解过程的反应机理和动力学与实验数据定性是一致的[33-35]。说明本文所设燃烧模拟的温度是合理的,此温度条件可以解释实际锅炉燃烧过程。
2 结果与讨论
2.1 化学当量比对红石湾煤燃烧机理的影响
2.1.1 不同化学当量比的可视化过程 为探究煤大分子结构在燃烧过程中不同化学当量比对燃烧的影响,设定目标温度为4000 K,选取化学当量比为0.5、1 和2 进行煤燃烧的过程模拟,如图1 所示。起始状态为0 ps,模拟体系升温至目标温度需要37 ps,然后进行100 ps 的燃烧模拟,总模拟时间为137 ps,同时考察两个中间状态(62和87 ps)。
从图1(a)可见,煤分子聚集颗粒与1250 个O2分子混合在大小为78 Å×78 Å×78 Å 的煤盒子中。0 ps后升温使得煤聚集态结构开始产生振动,进而发生化学键的弛豫、解离和复合等;反应进行至37 ps时,煤聚集态结构呈现明显“打开”状态,断裂成大分子片段分布在煤盒子中;反应进行至62 ps 时,片段裂解成较小的分子片段;待反应进行至87 和137 ps时,几乎完成分子裂解,反应结束。燃烧过程中,伴随着煤颗粒和大分子片段裂解,释放出小分子碎片和自由基,也会发生小分子的重组整合等。
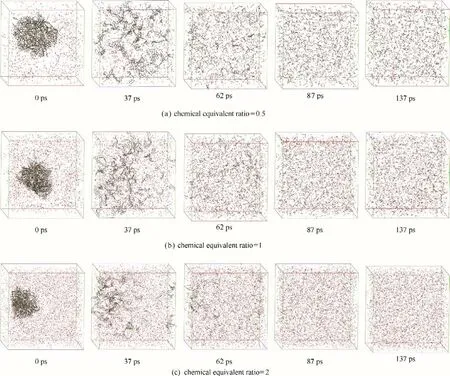
图1 不同化学当量比下煤燃烧的可视化过程Fig.1 Visualization process of coal combustion under different stoichiometric ratios
图1(b)、(c)分别描述了化学当量比1 和2 时煤颗粒燃烧体系状态随时间的演化。随着化学当量比加大,反应体系中O2分子数量增多,煤颗粒状态随着反应的进行所呈现的演变行为与图1(a)类似。但升温结束时,化学当量比为0.5时,37 ps对应大分子片段最长,数量最多;化学当量比为2 时,37 ps 对应大分子片段数量较少,煤大分子结构的裂解最显著,说明反应进行得更完全。研究发现,随着化学当量比的增加,煤结构更易断裂成小分子碎片,促进反应的进行。
2.1.2 化学当量比对O2和主要产物分子数量的影响 模拟结果显示,煤燃烧生成的主要气体产物有O2、CO2、CO 和H2O 等。为探究化学当量比对煤燃烧主要产物生成机制的影响,考察了各产物随模拟时间的变化,如图2 所示。由图2(a)可见,随着反应的进行,体系中O2分子数量均呈下降趋势。并且随着化学当量比的增加,曲线变陡,说明化学当量比越大氧气消耗的速度也越快。
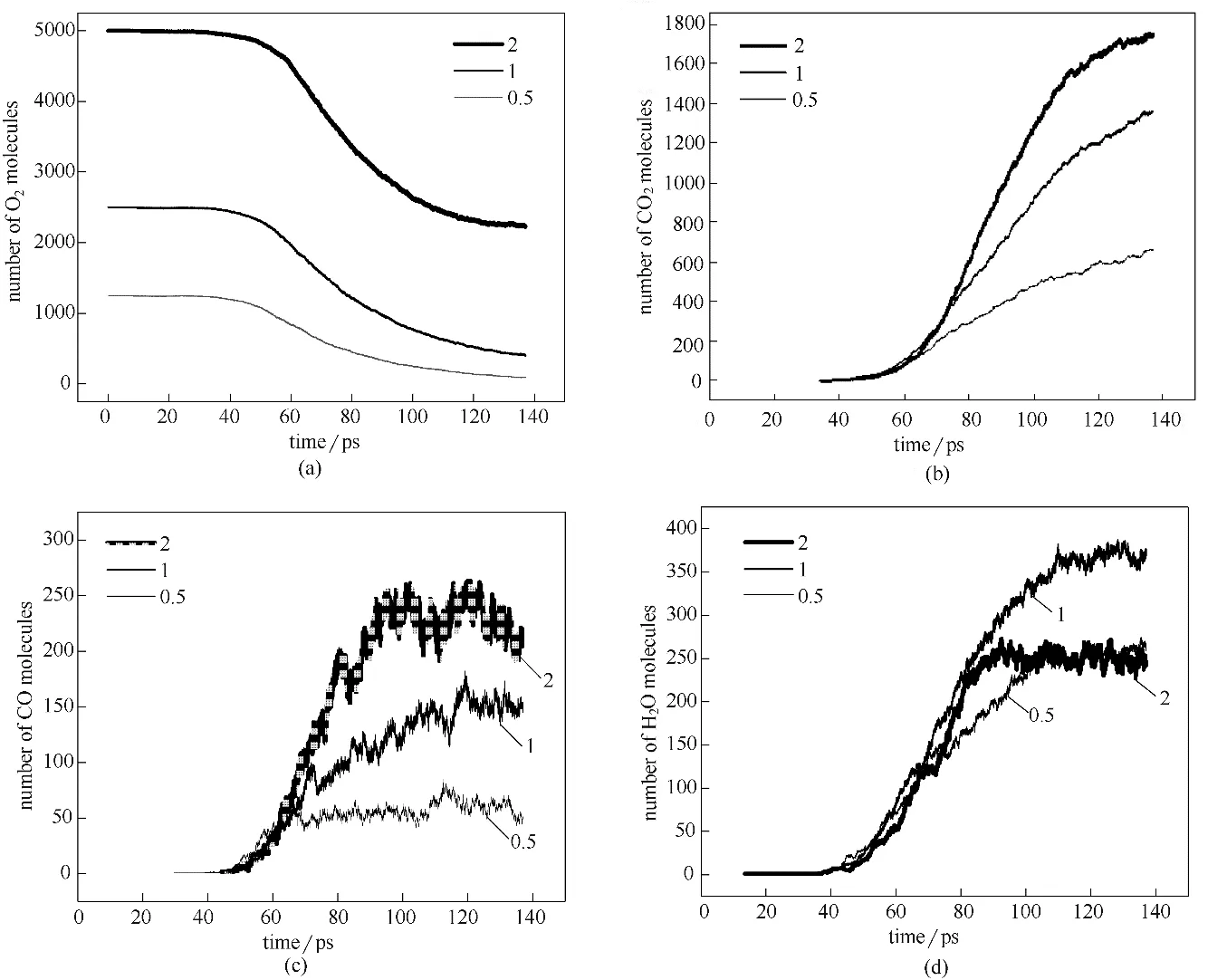
图2 不同化学当量比下O2(a)、CO2(b)、CO(c)以及H2O(d)分子数量随时间变化Fig.2 Time evolution of O2(a),CO2(b),CO(c)and H2O(d)with different stoichiometric ratios
从图2(b)可见,CO2的含量随着时间的变化不断增加。随着氧气浓度的升高,CO2的含量明显升高。化学当量比越大,CO2生成量越多。从图2(c)可见,CO 的含量经过一段时间的持续增加后呈现稳定趋势,但随着化学当量比的增加,CO 的生成量也越来越高,在化学当量比为2 时,CO 的含量达到最高值后又下降。Castro-Marcano 等[18]在模拟伊利诺斯州6 号煤焦的燃烧过程时,也发现CO 的含量随着氧浓度和温度的增加而增加,本研究所得结论与其相似。Liu 等[36]和Glarborg 等[37]认为富氧燃烧条件下会生成大量的CO2,以及大量的H 自由基,产物CO2和大量的H 自由基发生反应是CO 生成的主要来源。也可能与ReaxFF 模拟中使用的短时间尺度有关[24]。富氧时CO 含量后段有下降趋势,可能是因为一部分CO 发生缓慢氧化反应生成CO2。胡帆等[38]研究富氧燃烧机理过程中同样表明,富氧燃烧下CO2会引起CO 浓度的变化。从图2(d)可见,H2O 的含量随着反应的进行不断增加,化学当量比为1 时,H2O 的生成量高于化学当量比为0.5和2时的量。
2.1.3 化学当量比对含氮气体产物的影响 煤燃烧生成的含氮气体主要包括HCN、NO、NO2等。图3显示了不同化学当量比下燃烧后含氮气体产物的变化。其中,图3(d)中NOx的含量是NO 和NO2随时间变化的含量之和。从图3(a)可见,随着反应时间的增加,HCN 的含量先增加后减少,最终全部被转化;并且,氧浓度越高,HCN 减少得越快,越早被耗尽。氧浓度最高时,HCN 在90 ps 前已经全部转化,这说明化学当量比越大,HCN 越容易被转化为NOx。这与贺红坡等[23]使用分子动力学方法研究煤中含氮官能团燃烧过程时得到的结论相似。
由图3(b)可见,NO 的含量随氧浓度的增加而增加。其原因在于,富氧条件下CO2浓度最高,而高浓度CO2对燃煤过程NO 生成具有很大影响[39]。由图3(c)可见,NO2的含量随氧浓度的增加而增加,其规律与NO 的趋势类似。对比图3(b)和图3(c)发现,同一氧当量情况下NO 和NO2曲线的多处出峰时间并不吻合。这是由于NO2主要是由NO氧化生成所致,与之前相关研究学者的结论一致[40]。从图3(d)可见,随着氧浓度的升高,NOx的释放峰值向后移动。富氧燃烧时NOx的含量增加最明显,这与雷鸣等[41]的实验结论一致。Zheng 等[17]同样强调了O2浓度在N转化过程中起着重要作用。以上研究表明,化学当量比越大,HCN越容易转化为NOx。

图3 不同化学当量比下HCN(a)、NO(b)、NO2(c)以及NOx(d)随时间的变化Fig.3 Time evolution of HCN(a),NO(b),NO2(c)and NOx(d)with different stoichiometric ratio
2.2 温度对红石湾煤燃烧机理的影响
2.2.1 不同温度的可视化过程 选取温度为3000、3500和4000 K 时进行煤燃烧的过程模拟(化学当量比为2),如图4 所示。0 ps 为起始状态,模拟体系升温至目标温度所需时长分别为27、32、37 ps,升温结束后进行100 ps 的煤燃烧模拟,总模拟结束时间分别为127、132 和137 ps。故模拟可视化过程选取起始状态(0 ps)、升温结束状态(27、32 和37 ps)、模拟结束状态(127、132 和137 ps)以及升温过程两个中间状态(52/77、57/82以及62/87 ps)进行研究。
从图4(a)可见,从0 ps 升温使得煤聚集态结构开始产生振动,进而发生化学键的弛豫、离解和复合等。反应进行至27 ps时,煤聚集态结构呈现明显“打开”状态。反应进行至52 和77 ps 时,煤聚集态结构断裂成大分子片段,片段裂解成较小的分子片段,较均匀地分布在煤盒子中。待反应进行至127 ps 时,煤盒子中仍有很多未断开的小分子结构。从图4(b)可见,32 ps时完成升温,煤聚集态结构断裂成大分子片段,待反应进行至132 ps时,几乎没有较大片段。从图4(c)可见,反应进行至62 ps 时,煤聚集态结构断裂成小分子片段,明显比图4(a)和(b)中分子片段更小,分布更均匀。待87 ps 时反应基本完全,与模拟结束时137 ps状态几乎没有区别。
煤结构断裂成分子片段数量在一定程度上可以反映燃烧反应进行的程度。当达到目标温度继续燃烧50 ps 后,终温3000 K(77 ps)大分子片段较长,数量最多,反应不完全;终温为3500 K(82 ps)仍存在大分子片段,反应不完全;终温为4000 K(87 ps)基本无大分子片段,小分子碎片均匀分布,反应完全。随着温度的增加,煤颗粒更易断裂成小分子碎片,高温促进反应的进行。
2.2.2 温度对O2和主要产物分子数量的影响 为探究温度对煤燃烧主要产物生成机制的影响,考察了O2和主要产物随时间的变化。由图5(a)可见,随着反应的进行体系中O2分子数量随着时间和温度的增加而减少。随着温度的增加,O2减少的速度加快。这说明温度越高,氧气参与的反应越多。这与前期相关研究学者[25,27]得到的结论一致。

图4 不同温度下煤燃烧的可视化过程Fig.4 Visualization process of coal combustion at different temperatures
从图5(b)可见,CO2的含量随着时间的增加逐渐增大,并且随着温度的升高,CO2的含量也明显升高,在3000 K 时含量很少。从图5(c)可见,CO 的含量随着时间的增加,先增加后基本稳定。反应温度越高,CO生成量越大。4000 K时,CO的生成量先增加,到达峰值后呈现下降趋势,由于CO 曲线后段下降不明显,本研究考虑了更大模拟时间,模拟后结果显示CO 含量确实先增加后有小幅度下降。这与前人研究结论[24,42-43]相似。韩健等[43]研究燃煤炉发现,煤在高温氧化条件下充分燃烧,可以有效地降低CO 的排放浓度。从图5(d)观察到,H2O 的含量随着时间的增加而增加;随着温度的升高,H2O 分子生成速度加快;当温度为4000 K 时,90 ps 之前H2O 的含量随着时间和温度的增加而增加,在90 ps后达到稳定平衡状态。综合来看,高温有助于燃烧反应的进行。
2.2.3 温度对含氮气体产物的影响 图6模拟了不同温度下煤燃烧过程中含氮气体产物随时间的变化(化学当量比为2)。由图6(a)可见,随着反应时间的增加,HCN 的含量先增加后减少。且温度越高,HCN减少得越快,越早被耗尽;在4000 K时,HCN在90 ps 前已经全部转化。Liu 等[22]对吡啶热解燃烧进行了模拟,研究表明,HCN 的含量随着时间的变化到达峰值,而后HCN 总数量开始减少,即HCN 是一种初级产物,HCN 中的氮更容易转化为NOx。这些结论与本研究结果一致。
由图6(b)和图6(c)可见,NO 和NO2的含量随着温度的增加而增加。同一温度下对比发现,NO 和NO2曲线的多处出峰时间不吻合[40]。由图6(d)可知,NOx的含量随温度升高而显著增加。并且,随着温度的升高,NOx的释放峰值会向前移动。说明温度越高,HCN 越早转化为NOx和其他含氮产物。以上研究表明,较高的温度会加速煤颗粒的燃烧[42,44],但同时促进NOx的生成。
2.3 有机氮的转化机理
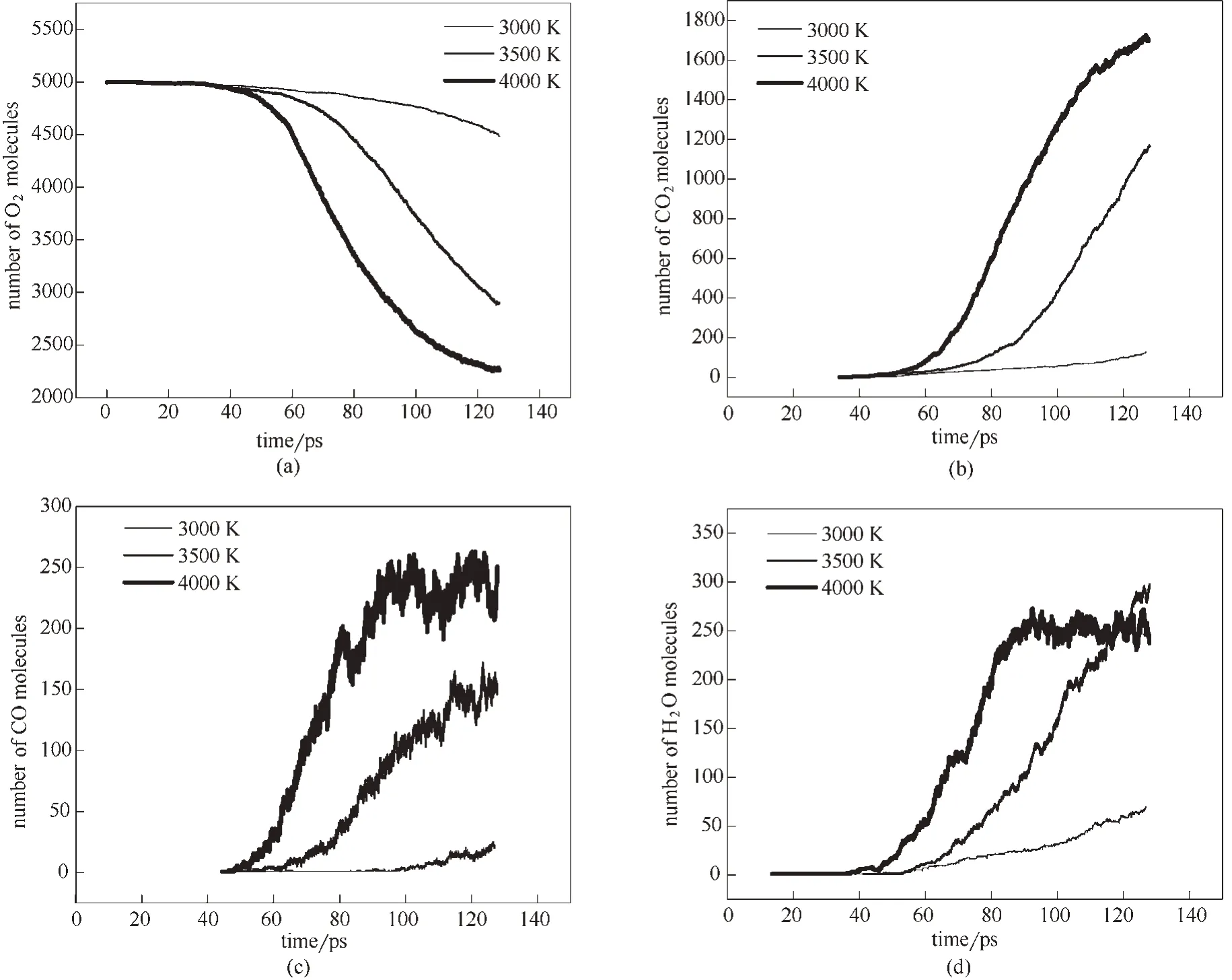
图5 不同温度下O2(a)、CO2(b)、CO(c)以及H2O(d)随时间变化Fig.5 Time evolution of O2(a),CO2(b),CO(c)and H2O(d)at different temperature
氮在煤中的赋存形态多样且结构非常复杂,受热迁移后的存在形态及反应途径繁多[40]。为探究煤中氮的化学反应转变历程,通过模拟温度为4000 K、化学当量比为1 的红石湾煤的燃烧过程,追踪其演变规律。煤燃烧过程中的主要产物包括NOx(包括NO 和NO2)和N2O,其中NO 占90%以上,NO2占5%~10%,N2O 只占1%左右[45]。研究学者们认为,燃煤过程中NOx是分两步进行,首先燃料中的杂环氮化物受热分解,产生NH3或HCN,随挥发物释放出来,氧化生成NOx;然后残留在煤焦中的氮在煤焦燃烧时生成NOx。本研究所用煤模型中氮原子数量很少,产物中无NH3。因此,本研究重点考察HCN、NO和NO2的生成机理,如图7所示。
2.3.1 HCN 的生成机理 HCN 是NOx转化的主要中间产物。如图7(a)所示,起初一个氧自由基攻击一个含氮五元环,导致C—H 键断裂(a-1)。而后在O2气氛下,经过一段时间的伸缩振动,导致两个C—C键断裂,五元环开环(a-2)。此后H 自由基连接到C上,同时发生内部氢转移(a-3)。然后,由于C—N键的断裂,生成一个HCNH(a-4)。最后O2分子夺走一个H 原子,生成含氮产物HCN 和O2H 自由基(a-4和a-5)。
2.3.2 NO 的生成机理 Zheng 等[17]研究表明,煤燃烧模拟过程中NO 的排放有多种来源,如NH 自由基的氧化、NCO和HNO中间体的进一步反应以及大分子碎片的直接裂解。其中NCO 中间体转化为NO 的途径占50%以上。本研究重点考察HCN 转化为中间体NCO,从而生成NO 的过程,如图7(b)所示。起初HCN在振动一段时间后被OH自由基夺走了H原子(b-1),导致C—O 键的断裂(b-2),生成CN 自由基和H2O分子(b-3)。随后O2在转化中为CN提供O原子生成中间体NCO(中间体b-4、b-5),之后发生内部氧转移得到CNO(b-6)。然后振动过程中O 游离基连接到了C 原子,由于分子伸缩振动发生了内部氧转移和C—N 键的断裂,转化成了NOCO(b-7、b-8)。此后发生N—O 键的断裂(b-9),生成CO2和游离N 原子。接下来,N 原子和O2H 自由基反应(b-10),发生O—O 键的断裂(b-11),最终生成NO 和OH 自由基(b-12)。这与Zheng 等[17]研究结果中HCN 转化生成CN 自由基,通过CN 自由基生成的NCO中间体来促进NO的排放相符合。
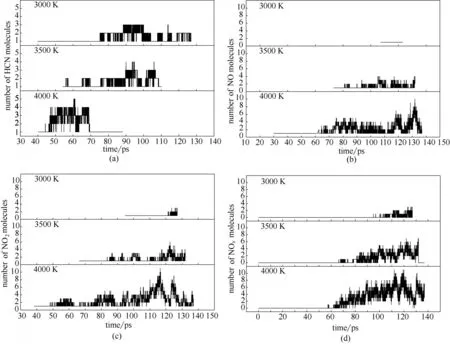
图6 不同温度下HCN(a)、NO(b)、NO2(c)以及NOx(d)随时间的变化Fig.6 Time evolution of HCN(a),NO(b),NO2(c)and NOx(d)at different temperature
2.3.3 NO2的生成机理 NO2产生是来源于NO 与O2、OH 和O2H 自由基发生的反应[42]。如图7(c)所示,煤燃烧过程中O2与煤燃烧过程中所生成的NO 反应,生成NOO(c-1、c-2)。然后可借助内部氧转移生成NO2(c-3)。
综合以上有机氮转化的过程发现,有机氮的转移是一个逐步脱氢/氧化的过程。这与Li 等[46]对褐煤氧化过程中氮迁移的研究所得结论一致。反应路径能够重现和解释红石湾煤燃烧过程中的演变结果。
3 结 论
本研究采用ReaxFF MD 方法对红石湾煤大分子结构聚集态模型进行燃烧反应模拟,考察不同化学当量比和反应温度对燃烧过程中的结构演变、燃烧反应物和产物的影响,重点阐明有机氮燃烧的转化路径,主要结论如下。
(1)根据煤燃烧的ReaxFF 模拟可视化分析结果,随着反应不断进行,煤结构的断裂变化非常明显。燃烧过程中,伴随着煤颗粒和大分子片段裂解释放出小分子碎片和自由基等。富氧和高温条件下煤颗粒的分解更显著,反应进行更完全。
(2)不同化学当量比和不同温度下煤燃烧的结果表明,化学当量比越大、燃烧温度越高时,O2分子消耗速度也越快,CO2的生成量越多。随着反应的进行,CO分子数量在不断增加后基本趋于稳定。
(3)对燃煤过程中含氮气体分子数量的分析表明,HCN 是重要的含氮中间产物。随着反应的进行,HCN 分子数量先增加后减少,且当化学当量比/温度越高时,HCN 被耗尽得越快,主要被转化为NOx和其他含氮产物。
(4)建立了煤燃烧过程中有机氮的转化路径,重点考察HCN、NO 和NO2的演变过程。结果发现,含氮五元环经开环后逐步形成重要初级产物HCN,后经过CN 自由基转化生成NCO,从而最终生成NO和NO2来促进NOx的排放。这为追踪煤燃烧过程中有机氮转化路径以及控制NOx的排放提供一定的理论参考。
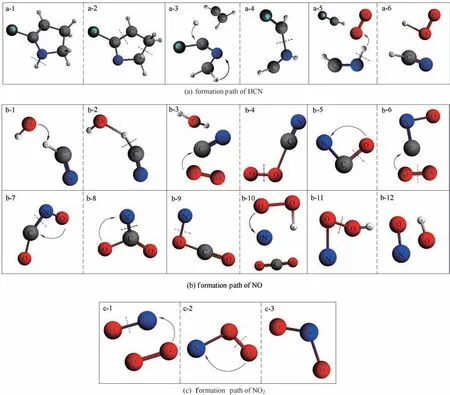
图7 煤燃烧过程中氮的转化路径Fig.7 Transformation path way of nitrogen during coal combustion
