甲状腺结节微波消融术后体温及炎性指标变化规律及其意义
2020-04-03霍胜男彭丽丽于明安赵朕龙
霍胜男,尹 琳,彭丽丽,于明安*,赵朕龙
(1.邯郸钢铁集团有限责任公司职工医院甲状腺科,河北 邯郸 056001;2.中日友好医院介入超声医学科,北京 100029)
甲状腺结节是临床常见病。高分辨率彩色超声对成人甲状腺结节的检出率为20%~76%,其中7%~15%甲状腺结节为恶性病变[1]。既往对甲状腺结节和甲状腺癌多采用手术治疗[2],创伤较大。超声引导下热消融具有微创、安全、疗效确切等优点[2-4],其基本原理是利用高温使肿瘤组织发生凝固性坏死,进而促使肿瘤失活。既往研究[5]发现,热消融治疗肝癌所致病灶局部热损伤及术后坏死物吸收可诱导病灶周围发生无菌性炎症反应,引起吸收热,不利于患者预后。热消融治疗甲状腺结节的原理与治疗肝脏相同,但目前对于甲状腺结节消融后是否也存在吸收热等问题尚不明确。本研究分析微波消融(microwave ablation, MWA)治疗甲状腺结节后患者体温及炎性指标变化,探讨其规律,以期为临床诊疗提供参考。
1 资料与方法
1.1 一般资料 选取2018年11月—2019年1月93例于中日友好医院及邯郸钢铁集团有限责任公司职工医院接受超声引导下经皮MWA治疗的甲状腺结节患者(160枚结节),男23例,女70例,年龄18~87岁,平均(49.4±14.7)岁;术前均接受甲状腺结节细针穿刺活检,病理结果示良性结节76例(140枚结节),乳头状癌17例(20枚结节)。160枚结节中,67枚位于甲状腺左叶,右叶86枚,峡部7枚;结节最大径0.30~9.90 cm,平均(2.06±1.57)cm,其中良性结节最大径0.70~9.90 cm、平均(2.44±1.55)cm,恶性结节(乳头状癌)最大径0.30~1.00 cm、平均(0.62±0.18)cm。
纳入标准:①甲状腺结节经病理证实诊断;②乳头状癌,病变结节≤2枚,最大径≤1.0 cm且未突破包膜,无淋巴结或远处转移;③血常规、凝血功能正常;④患者术前签署知情同意书。排除标准:①遗传性疾病和/或口服促炎性介质释放类药物;②3个月内曾接受其他手术;③肺炎、胃肠炎等感染性疾病,心肺功能障碍、2型糖尿病、免疫缺陷、风湿等影响机体炎症反应的疾病;④心源性休克或急性脑血管病变或长期器官灌注异常疾病。
1.2 仪器与方法 采用Toshiba Aplio500彩色多普勒超声诊断仪,康友(南京)KY-2000型及T3型甲状腺专用水冷微波天线。嘱患者仰卧,以常规超声扫查了解结节位置、大小及周围邻近重要结构,确定进针路径(图1A)。常规消毒铺巾后,行CEUS观察结节血流灌注情况(图1B)。以1%利多卡因进行局部麻醉,将60 ml生理盐水注射入结节与周围重要结构之间,使二者分离,形成宽约0.5 cm的间隙。于超声引导下将微波针穿刺入结节,微波功率30~35 W,对体积较大结节采用移动消融方法,体积较小者采用固定消融方法,直至消融区呈高回声,完全覆盖拟定范围(图1C)。术后再次行CEUS,明确结节消融是否完全(图1D)。局部按压30 min,患者留院观察24 h。
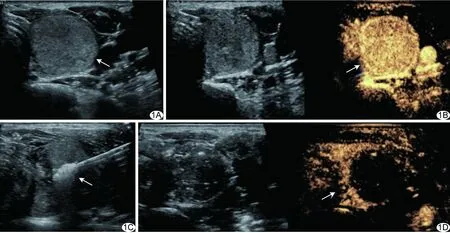
图1 患者男,42岁,甲状腺右叶良性结节,行MWA A.术前超声声像图示甲状腺右叶实性结节(箭); B.术前CEUS示结节呈高增强(箭); C.超声引导下微波针插入结节行消融治疗,强回声(箭)代表热场覆盖范围; D.术后CEUS示结节呈持续无增强(箭)
表1 消融前后WBC、NEU%、ESR及CRP水平比较(±s,n=93)
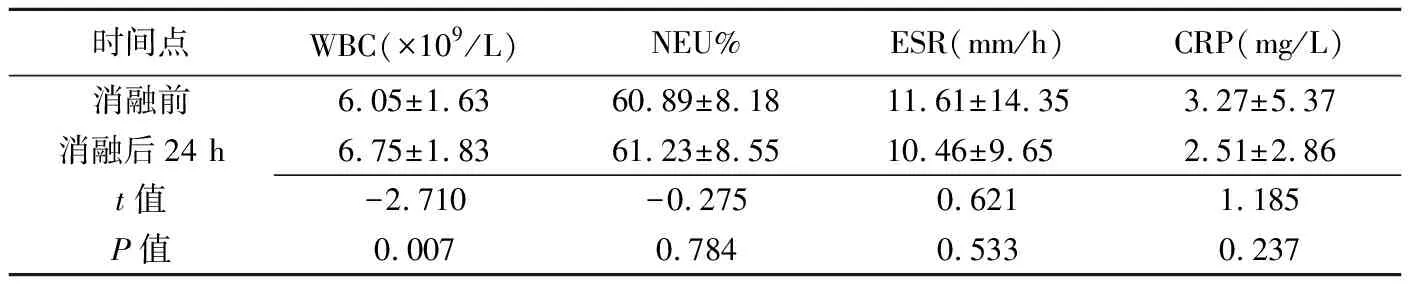
表1 消融前后WBC、NEU%、ESR及CRP水平比较(±s,n=93)
时间点WBC(×109/L)NEU%ESR(mm/h)CRP(mg/L)消融前6.05±1.6360.89±8.1811.61±14.353.27±5.37消融后24 h6.75±1.8361.23±8.5510.46±9.652.51±2.86t值-2.710-0.2750.6211.185P值0.0070.7840.5330.237
表2 消融前后血清IL-1、IL-2、IL-6、IL-8及TNF水平比较(±s,n=93)
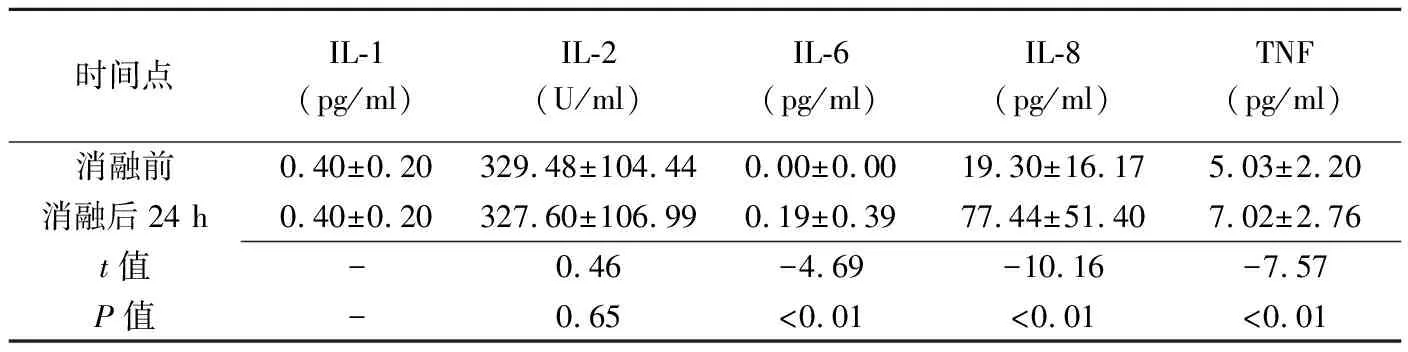
表2 消融前后血清IL-1、IL-2、IL-6、IL-8及TNF水平比较(±s,n=93)
时间点IL-1(pg/ml)IL-2(U/ml)IL-6(pg/ml)IL-8(pg/ml)TNF(pg/ml)消融前0.40±0.20329.48±104.440.00±0.0019.30±16.175.03±2.20消融后24 h0.40±0.20327.60±106.990.19±0.3977.44±51.407.02±2.76t值-0.46-4.69-10.16-7.57P值-0.65<0.01<0.01<0.01
注:—:数据相同,未进行比较
1.3 相关指标观察 记录消融时间;于消融前及消融后 30 min、12 h、24 h及48 h测量腋下体温;消融前及消融后24 h检测白细胞(white blood cell, WBC)、中性粒细胞百分比(neutrophile percentage, NEU%)、红细胞沉降率(erythrocyte sedimentation rate, ESR)以及血清C反应蛋白(C-reactive protein, CRP)、白细胞介素-1(interleukin-1, IL-1)、IL-2、IL-6、IL-8和肿瘤坏死因子(tumor necrosis factor, TNF)水平。
1.4 统计学分析 采用SPSS 25.0统计分析软件。以±s表示计量资料,采用方差分析比较各时间点体温,t检验比较消融前后炎性因子水平;对计数资料采用χ2检验进行比较。P<0.05为差异有统计学意义。
2 结果
93例(160枚结节)均一次性完全消融,消融时间60~862 s,平均(259.11±209.85)s。
消融前及消融后30 min、12 h、24 h及48 h,患者平均腋下体温分别为(36.49±0.16)℃、(36.51±0.22)℃、(36.53±0.54)℃、(36.48±0.17)℃及(36.50±0.20)℃,总体差异无统计学意义(F=0.384,P=0.820)。消融后24 h WBC、IL-6、IL-8及TNF水平均较消融前升高(P均<0.05),见表1。消融前后NEU%、ESR、CRP、 IL-1及IL-2水平差异无统计学意义(P均>0.05),见表2。
3 讨论
吸收热是热消融治疗肝癌后常见不良反应之一,为热消融术后1~3天内患者发热的主要原因,系无菌性抗原抗体复合物及热刺激应激导致下丘脑体温调节中枢调定点上移引起的非感染性发热。另有研究[6]显示吸收热是消融引发的组织细胞坏死、蛋白分解及坏死产物吸收,形成内源性致热源而导致的体温调节曲线整体变化。吸收热引起的体温升高一般在38℃以下,术后3~4天逐渐降至正常范围。既往研究[7-8]表明,消融治疗肝癌后,约50%~75%患者于术后1~3天出现发热,约64.67%患者于术后第1天开始发热,约92.66%发热始于术后1~2天,可持续3~7天,约15%患者体温超过38.5℃。如术后发热时间超过3天,可结合WBC、NEU%、ESR及CRP水平变化判断是否合并细菌感染。目前对于MWA治疗甲状腺结节术后是否出现吸收热少见报道。
本研究结果表明,MWA治疗甲状腺结节后短时间内患者体温在正常范围内略有变化,但相比术前差异无统计学意义。WBC、NEU%、ESR、CRP、IL-1、IL-2、IL-6、IL-8及TNF均为评价炎症反应的重要指标,在创伤及手术后均可出现一定程度的变化。本研究中,消融后24 h, WBC、IL-6、IL-8及TNF均较消融前升高。炎症反应及损伤均诱发组织分泌TNF,刺激细胞产生IL-6、IL-8等炎性因子,进一步促进中性粒细胞活化、聚集,使WBC升高。本研究中消融前后NEU%、ESR、CRP、IL-1及IL-2水平虽有波动,但差异均无统计学意义,可能与入组例数较少有关。本研究结果提示,MWA治疗甲状腺结节后热损伤导致以中性粒细胞、特别是WBC升高为主的轻度炎症反应,但不引起严重炎症反应所致的级联效应[9-13],亦未触发体温调定点,故体温无明显改变;由此间接提示MWA治疗甲状腺结节所致机体相应炎症反应较轻,安全性高。
本组MWA术后48 h患者体温始终维持在正常范围内。分析原因:①MWA术后发热程度与肿瘤灭活范围有关,甲状腺结节体积一般小于肝脏肿瘤,所用能量较小[14];②肝脏肿瘤患者常有乙肝、丙肝等炎症背景,在此基础上热消融可导致局部发生明显炎症反应,而甲状腺结节一般无明显炎症背景,消融引起的炎症程度较轻;③甲状腺结节受到热刺激后,消融灶周围过渡区滤泡上皮细胞内热休克蛋白70表达增加,保护周围组织,并参与免疫调节,减轻炎症反应[15]。MWA术后吸收热有其自身的演变过程,吸收热持续时间随治疗过程及病种不同而有所差别[16-17]。掌握吸收热的变化规律,有利于正确处理并控制吸收热。
综上所述,MWA治疗甲状腺结节可引起部分炎性因子改变,但程度较轻,术后患者体温在正常范围内轻微波动。
