人参果浆中人参皂苷Re的提取和生物转化
2020-04-01,*
,*
(1.大连工业大学生物工程学院,辽宁大连 116034;2.大连大学生命科学与技术学院,辽宁大连 116622)
人参(PanaxginsengC.A.Mayer)是传统的名贵中药,通常入药部位是人参根部(地下部位),茎叶、花蕾以及果实等,地上部位的利用还欠缺,有待于进一步开发。人参中主要活性成分是三萜类人参皂苷,广泛存在于人参属植物的根、茎叶、花蕾以及果实中[1-2]。迄今为止,人们所熟知的人参皂苷多达60多种[1-2]。但是,人参中含量高的Rb1、Rb2、Rb3、Rc、Rd、Re等原型皂苷,由于带多个糖基,生理活性和生物利用度都较低,口服后在肠道中可以转化为低糖基的稀有皂苷,例如C-K,经肠道吸收后起药效。研究表明,人参原型皂苷在肠道中的转化非常微弱,大部分很难被利用[3-5]。而低糖基的人参皂苷Rg2、C-K、Rg3、Rh2、Rh1等,在肠道中的吸收率高[3-5],具有抗癌、抗血栓、抗炎症、抗皮肤老化以及治疗神经系统疾病的功效。其中人参皂苷Rg2具有强心作用,可用于治疗失血性休克、心源性休克等疾病[6-7],对医药、保健食品、化妆品的研发有重要意义[8-11]。
目前,在我国现有条件下,种植四年以上的人参果一般用于取人参籽作为人参种子,剩余的人参果浆少部分用于人参果酒、饮料等的制作,大部分废弃,总体利用率很低。人参果浆中人参皂苷Re的含量很高[2,12],但Re属于人参原型皂苷,分子结构中的6-O-位置带有2个糖基、20-O-位置带有1个糖基,共三个糖基,分子量较大,生理活性和生物利用度偏低[3-4]。关于将Re等三醇类人参皂苷,转化为高活性、低糖基的人参稀有皂苷方面的研究,本实验室曾报道过人参皂苷酶4型水解法[13]以及Rg2组四种异构体的分离方法[14],可以有效实现人参原型皂苷向人参稀有皂苷的转化;李亨等将复合菌(枯草芽孢杆菌、黑曲霉、米曲霉)加入到人参须粉末培养基中,60 ℃发酵培养10 d,转化制备得到Rg2[15]。包海鹰等采用黑根霉Rhizopussp,在其菌种发酵中加入人参皂苷Re,从发酵产物中制备得到人参皂苷Rg2,得率为10.1%[16]。
为了充分利用人参加工厂废弃的果浆,本文实地考察了吉林抚松地区的人参地,采集了新鲜的人参果实,分析其组成成分;收集了当地人参加工厂废弃的人参果浆,并将其喷雾干燥制成干品,对干品进行组成成分分析,提取其中的人参皂苷Re,并以Re为底物生物转化为人参皂苷Rg2组(包含20(S)-Rg2、20(R)-Rg2、Rg4和Rg6),此为人参加工厂废弃果浆的综合利用提供了理论依据,为人参皂苷Re提取与转化的工业化生产提供了新的思路。
1 材料与方法
1.1 材料与仪器
人参果实 4年生,8月初到吉林省抚松参地采摘;人参果浆干粉 取抚松人参加工厂去籽后的果浆,喷雾干燥得到的干粉;人参皂苷对照品Re、Rb1、Rc、Rb2、Rb3、Rd、20(S)-Rg2、20(R)-Rg2 由天津天宿光华健康科技公司提供;AB-8大孔吸附树脂、D-280离子交换树脂 天津南开大学试剂生产;薄层层析板Silica gel 60-F254 德国Merck公司;乙腈(色谱纯)、甲酸(色谱纯) Tedia公司。
高效液相色谱系统2695,配有2996二极管阵列检测器及Empower色谱工作站 美国Waters公司;超高效液相-四级杆飞行时间串联质谱联用仪(UHPLC-H-CLASS/XEVO G2-XS Q-TOF),配有电喷雾离子源(ESI)及Xcalibur4.1数据处理系统 美国Waters公司。
1.2 实验方法
1.2.1 人参果实中人参籽和人参果肉及水分占比测定 取一定量的新鲜人参果实称重,于60 ℃烘箱内烘干至恒重、称重,可计算出水分含量。将烘干的人参果实加蒸馏水浸泡、捣碎、分离人参籽和果浆,分别烘干至恒重、称重,得到人参籽和人参果实的果肉质量。
1.2.2 人参果浆中总皂苷的提取 于60 ℃条件下,分别取1.2.1干燥后的人参果实干粉和收集于人参加工厂经喷雾干燥得到的人参果浆干粉10 g,加入100 mL 75%(V/V)乙醇、搅拌均匀,提取48 h,分离上清液,重复三次;合并上清,减压浓缩至30 mL,石油醚脱脂,加入预先处理好的柱体积为30 mL的AB-8柱、反复上样,直到皂苷被完全吸附,用240 mL去离子水洗脱糖类等杂质,以180 mL 84%(V/V)乙醇洗脱皂苷[17]。洗脱液再经柱体积为30 mL的D-280脱色树脂柱脱色[18],再减压浓缩至30 mL,于50 ℃烘箱中恒温干燥得到皂苷干品,并采用HPLC法测定总皂苷的组成。
1.2.3 人参皂苷Re的提取 于60 ℃条件下,取1000 g人参果浆干粉,加入10000 mL 75%(V/V)乙醇、搅拌均匀,提取48 h,分离上清液,重复3次,合并上清,减压浓缩至3000~5000 mL,加入预先处理好的柱体积为3000 mL的AB-8柱、反复上样,直到皂苷被完全吸附,用24000 mL去离子水洗脱糖类等杂质,18000 mL的84%(V/V)乙醇洗脱皂苷[17]。洗脱液再经柱体积为3000 mL的D-280脱色树脂柱脱色[18],再减压浓缩至3000 mL,浓缩液静置20 h,经结晶、过滤后(滤液回收待用),于50 ℃烘箱中恒温干燥得到人参皂苷Re,并采用HPLC法进行检测,计算其纯度。
1.2.4 人参皂苷Re的生物转化 本研究采用人参自身酶的粗酶液,将人参皂苷Re转化为人参稀有皂苷Rg2组。
1.2.4.1 人参自身酶粗酶液的提取 选取新鲜的人参根,提取皂苷,取剩余的人参根残渣10 g,加入800 mL去离子水,在75 ℃条件下提取6 h,重复3次,合并提取液,减压浓缩至60°Bé,离心除渣,在室温下设定转速为8000 r/min,时间是15 min,得到200 mL人参自身酶的粗酶液[19-20]。
1.2.4.2 人参皂苷Rg2组的制备 取10 g人参皂苷Re,加入20 mL上述人参自身酶的粗酶液,再加入20 mL乳酸,60 mL去离子水,在70 ℃条件下反应2 h[19-20]。反应结束后,用600 mL去离子水稀释,以200 mL的大孔树脂柱吸附皂苷,反复上样,直到皂苷全部被树脂吸附,用水洗净渣滓,再用800 mL的70%(V/V)乙醇洗脱,减压浓缩后,于50 ℃烘箱中恒温干燥[17],得到人参皂苷Rg2组,并采用HPLC法对人参皂苷Rg2组的组成进行分析。
1.2.5 皂苷组成分析
1.2.5.1 皂苷样品的制备 精密称取人参皂苷对照品Re、Rb1、Rc、Rb2、Rb3、Rd、20(S)-Rg2、20(R)-Rg2、人参果浆中提取的人参总皂苷、分离纯化后的人参皂苷Re和生物转化得到的人参皂苷Rg2组样品各2 mg,溶于1 mL色谱甲醇中,经0.22 μm滤膜过滤,待测。
1.2.5.2 高效液相色谱(HPLC)分析 采用高效液相色谱分析仪,二极管阵列检测器。色谱条件:Knauer C18色谱柱(5 μm,Φ 4.6 mm×250 mm);流动相为乙腈(A)-水(B):0~20 min,20% A等度;20~31 min,20% A~32% A线性梯度;31~40 min,32% A~43% A线性梯度;40~70 min,43% A~100% A线性梯度。进样量10 μL;柱温35 ℃;流速1 mL/min;检测波长203 nm[21]。
1.2.5.3 对照品溶液的制备及线性关系考察 精密称取人参皂苷Re对照品4 mg溶于2 mL色谱甲醇中,配成浓度为2 mg/mL的对照品溶液。取对照品溶液加入色谱甲醇,分别稀释成浓度为1.5、1.0、0.5、0.25 mg/mL的对照品溶液,经0.22 μm滤膜过滤,待测。分别取上述制备的不同浓度对照品溶液按1.2.5.2的色谱条件进样分析,以测得的峰面积为Y轴对照品浓度为X轴绘制标准曲线,用最小二乘法进行线性回归[22],得到人参皂苷Re的回归方程:y=636672x-115207(R2=0.9992)。
人参皂苷Re的定量计算
式(1)
式中,Re表示人参皂苷Re的质量百分比,%;A:表示样品中人参皂苷Re的峰面积;W样:表示样品的浓度,mg/mL。
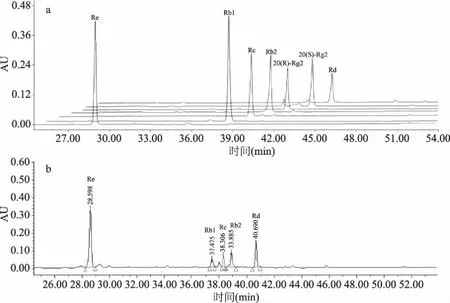
图2 人参皂苷的HPLC图谱Fig.2 HPLC chromatogram of ginsenosides注:a.人参皂苷对照品;b.人参果浆干粉中的人参总皂苷。
1.2.5.4 超高效液相色谱-四级杆飞行时间串联质谱(UPLC-Q-TOF-MS)分析 色谱条件:BEH shield RP18色谱柱(2.1 mm×100 mm,1.7 μm,Waters);流动相为(A)0.1%甲酸-乙腈、(B)0.1%甲酸-水;梯度洗脱:0~5 min,5% A~95% A线性梯度,5~10 min,95% A等度;进样量10 μL;流速0.5 mL/min;柱温30 ℃。质谱条件:电喷雾离子化源(ESI),负离子检测模式,毛细管电压2.5 kV;样品孔电压35 V;离子源温度100 ℃;脱溶剂气温度350 ℃;锥孔气流速50 L/hr,脱溶剂气流速1000 L/hr;质量扫描范围m/z 100-1000。
1.3 数据处理
超高效液相色谱-四级杆飞行时间串联质谱法(UPLC-Q-TOF-MS)数据分析采用Xcalibur4.1数据处理系统采集、处理数据,Microsoft Excel 2003统计分析。
2 结果与分析
2.1 人参果浆中皂苷组成分析
2.1.1 人参果实中籽、果肉以及水分的占比 实验发现,36.3 g人参果实的干重为12.11 g,水分含量为66.63%(W/W);人参籽的重量为9.86 g,果肉的重量2.15 g,分别占人参果实干重的82.09%(W/W)、17.90%(W/W)。
2.1.2 人参果浆中总皂苷的提取 以实验方法1.2.2提取总皂苷,干燥后的人参果浆干粉和收集于人参加工厂经喷雾干燥得到的人参果实干粉总皂苷含量分别为6.93%、6.21%(W/W)。由此可见,人参果浆干品中的总皂苷含量与上述实验室测得的新鲜人参果实果肉干品中的总皂苷含量相近,人参加工厂中人参果的去籽处理过程,损失的皂苷相对较少,以下实验将以收集于人参加工厂经喷雾干燥得到的人参果浆干粉为研究对象。
对人参果浆干品中制备得到的人参总皂苷,采用HPLC方法测定其皂苷组成,结果如图2b所示。
通过与人参皂苷Re、Rb1、Rc、Rb2、Rd对照品的保留时间比对,可以确定人参果浆制备的人参总皂苷主要含有Re、Rb1、Rc、Rb2、Rd五种皂苷,并采用式(1)计算得到其中人参皂苷Re的含量为55.1%(W/W)。由此得知,人参果浆是提取Re的理想原料。
2.2 人参皂苷Re的分离纯化
1.2.3制备得到的人参皂苷Re HPLC检测图谱如图3所示。图3中纯化得到的人参皂苷Re,采用式(1)计算得到纯度为90%(W/W)。将1.2.3中回收的滤液再减压浓缩至2000 mL,冷却结晶,重复2 次,干燥后共得到14 g,经HPLC检测纯度为80%(W/W)。综上,从1000 g人参果浆干粉中共得到24 g不同纯度的人参皂苷Re得率约为2.4%(W/W)。

图3 人参果浆干粉中人参皂苷Re的HPLC图谱Fig.3 HPLC chromatogram of ginsenoside Re in dry powder of ginseng fruit pulp
2.3 人参皂苷Rg2组的组成分析
人参根中含有人参皂苷酶,作用于人参皂苷Re可以发生生物转化,将其转化为Rg2组,按照实验方法1.2.4.2生物转化制备得到6.5 g的人参皂苷Rg2组,得率为65%(W/W)。对产物人参皂苷Rg2组进行HPLC分析,结果如图4所示。

图4 人参皂苷Rg2组的HPLC图谱Fig.4 HPLC chromatogram of ginsenosides Rg2 group
由图4中可知,Rg2组中含有四种人参皂苷,通过与上述图2a人参皂苷对照品保留时间的比对,初步判断含有人参皂苷20(S)-Rg2、20(R)-Rg2,另外两种未知皂苷初步判断为Rg4、Rg6,四种皂苷保留时间(min)依次为39.650、40.029、47.005、47.657 min。

图6 20(S)-Rg2(a),20(R)-Rg2(b)在ESI负离子模式下的一级质谱图Fig.6 MS of 20(S)-Rg2 and 20(R)-Rg2 in ESI negative ion mode
2.4 超高效液相色谱-四级杆飞行时间串联质谱(UPLC-Q-TOF-MS)验证Rg2组中四种异构体
1.2.4.2制备的Rg2组样品,采用UPLC-Q-TOF-MS,分别在ESI源的正、负离子模式下检测,样品的总离子流图如图5所示。
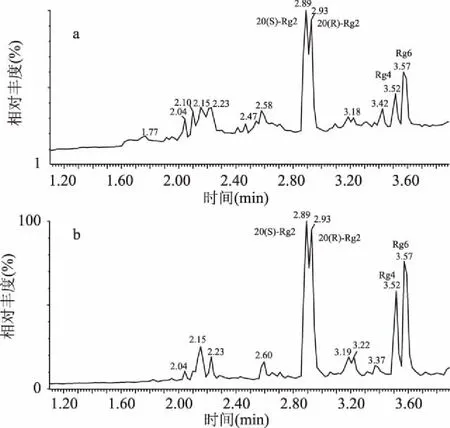
图5 Rg2组样品总离子流图谱Fig.5 Total ion chromatogram of Rg2 group注:a.ESI正模式下Rg2组;b.ESI负模式下Rg2组。
从图5中可以看出,ESI正、负离子模式下总离子流图中的20(S)-Rg2、20(R)-Rg2、Rg4、Rg6的保留时间(min)依次为2.89、2.93、3.52、3.59 min,与UPLC检测图谱中各组分、标准品的保留时间相匹配,证明Rg2组确系含有的四种异构体组分。ESI正、负离子模式下总离子流图比较发现,负离子模式下Rg2组检测的干扰性较小,且灵敏度较高,因此选择负离子模式进行分析检测。

图7 Rg4(a)、Rg6(b)在ESI负离子模式下的一级质谱图Fig.7 MS of Rg4 and Rg6 in ESI negative ion mode

图8 Rg2组中四种异构体皂苷的化学结构Fig.8 Chemical structures of four ginsenoside isomers in Rg2 group
首先对Rg2组人参稀有皂苷中20(S)-Rg2、20(R)-Rg2的离子峰在ESI负离子模式下进行一级质谱分析,结果如图6所示。
从图6a中可以看出,保留时间2.89 min出现的m/z 829和m/z 783分别是[Rg2-H+HCOOH]-和[Rg2-H]-峰,得出其相对分子量为784,与文献比对确认其为20(S)-Rg2[23]。同理,由图6b分析出其手性异构体20(R)-Rg2,相对分子量也是784。
从图7a和图7b中可以看出,保留时间3.52和3.57 min出现的[M-H+HCOOH]-和[M-H]-峰均相同,分别是m/z 811和m/z 765,表明两种化合物的分子量均为766,经与参考文献比对定性为Rg6和Rg4[24]。
综上,Rg2组中含有四种异构体人参稀有皂苷:分子量为784的20(S)-Rg2和20(R)-Rg2,分子量为766的Rg4和Rg6,其结构图如图8所示。
3 讨论与结论
人参加工厂在人参果实取籽后,残余的果浆大部分被废弃。本研究发现废弃的人参果浆中还富含人参皂苷Re,含量高达55.1%(W/W)。可以利用废弃的人参果浆,分离提取人参皂苷Re,再经生物转化进一步制备高附加值的20(S)-Rg2、20(R)-Rg2、Rg4和Rg6等稀有皂苷。人参皂苷20(S)-Rg2和20(R)-Rg2有抗神经毒性和增强记忆的功能,且在体内和体外均有显著的促进腺苷酸活化蛋白激酶的作用,可以抑制脂肪的生成[25];还具有抗抑郁、缓解创伤后应激障碍的作用[26];与虾青素联合作用可以上调脱氧核糖核酸水平以此来降低细胞毒性和遗传毒性[27];能减轻缺血时心肌细胞线粒体的损伤,对急性心源性休克犬心肌细胞线粒体具有一定的保护作用[28]。Rg6对人体淋巴细胞瘤的生长有抑制和诱导凋亡的作用[29]。Rg4对颗粒物诱导的炎症性肺损伤和血管通透性增高具有保护作用[30]。
本研究利用废弃人参果浆生产人参稀有皂苷,生物转化产物为Rg2组,由20(S)-Rg2、20(R)-Rg2、Rg4和Rg6等异构体皂苷组成,产率达到65%(W/W),为废弃人参果浆的综合利用提供理论依据,也为医药、保健食品、化妆品的研发,提供了新的原料生产途径。
