一个导致Allan-Herndon-Dudley综合征的SLC16A2基因新突变
2020-04-01辛庆刚赵澎蔡春泉陈静陈淑娟盛倩倩
辛庆刚,赵澎△,蔡春泉,陈静,陈淑娟,盛倩倩
Allan-Herndon-Dudley 综合征(Allan-Herndon-Dudley,AHDS)系罕见遗传性疾病,可导致神经系统及甲状腺功能损害,我国对此病报道较少,此病有特异性的临床及甲状腺功能特点。通过仔细询问病史、查体及甲状腺功能检查,发现异常多能与其他类似疾病鉴别。本文介绍1例确诊AHDS患儿,详细阐述此病临床表现,为临床中鉴别此病提供帮助。同时,对近年来治疗的研究进展进行总结。
1 病例报告
患儿 男,17 月龄。主因至今竖头不稳,于2018 年3 月10日入院。患儿母亲孕1产1,孕41+3周顺产,急产。患儿出生体质量3.68 kg,胎膜早破,否认宫内窘迫及生后窒息史,Apgar 评分不详。自幼精神运动发育落后,生后不久即出现四肢乱动,常双侧肢体姿势不对称,好“打挺”,致使家长不容易抱住患儿。自幼长期行康复治疗,精神运动发育迟缓无明显改善。否认抽搐史,否认发育倒退史。患儿自幼进食量尚可,体质量增长较慢,睡眠尚可,常大便干燥,需用开塞露助便。家族史:患儿母亲曾患“甲状腺疾病”,曾行甲状腺核素扫描未见异常,甲状腺功能正常。父母非近亲婚育。否认其他相关疾病家族史。体格检查:体质量8.0 kg,身长84 cm,心率 126 次/min,呼吸 28 次/min,血压 95/65 mmHg(1 mmHg=0.133 kPa)。消瘦,神志清,追视尚可,与人对视尚可,仅能发少数元音,头围44.0 cm,前囟闭合,下颌小,心肺腹内科查体未见阳性体征。常呈角弓反张姿势,肌张力障碍,可见张口及四肢“划船样”不自主运动,双膝腱反射(+++),双巴氏征阳性。俯卧位可抬头45°,不稳定,仰卧位常呈非对称性紧张性颈反射(ATNR)姿势,拉起时头极度后仰(图1),双侧腘窝角90°,股角80°,双足背屈角30°。辅助检查:患儿自幼多次甲状腺功能检查均提示总三碘甲状腺原氨酸(TT3)、游离三碘甲状腺原氨酸(FT3)增高,总四碘甲状腺原氨酸(TT4)、游离四碘甲状腺原氨酸(FT4)降低,促甲状腺激素(TSH)升高或正常。患儿母亲及外祖母甲状腺功能正常,见表1。患儿4个月时甲状腺超声检查、眼底镜检查、动态脑电图、尿代谢病筛查未见异常。视觉诱发电位(visual evoked potential,VEP)4 个月和12 个月时均提示双侧P100 缺失。4 个月时脑干听觉诱发电位(brainstem auditory evoked potential,BAEP):双侧外周段异常,右耳听力中轻度下降及左耳听力中度下降。Gesell发育诊断量表评估(7个月时)适应性重度发育迟缓,大运动极重度发育迟缓,精细动作重度发育迟缓,语言重度发育迟缓,个人-社交重度发育迟缓。患儿4个月、12个月时两次头磁共振成像(MRI)提示额顶叶白质异常信号,脑室脑外间隙增宽,见图2。患儿12个月时右侧内囊区单体素磁共振波谱分析提示在回波时间35 ms N-乙酰天冬氨酸(NAA)峰相对较低,胆碱(Cho)峰相对较高,见图3。

Fig.1 The child with abnormal posture图1 患儿异常姿势

Tab.1 Thyroid function of the child and his mother and grandmother表1 患儿及其母亲、外祖母甲状腺功能检查
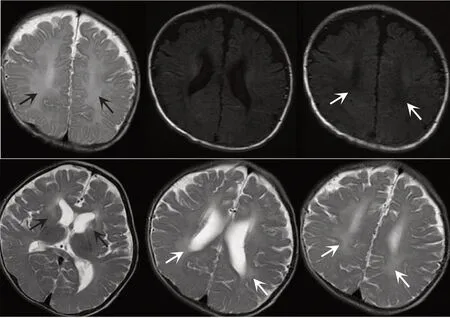
Fig.2 The brain MRI at 4 and 12 months of the child图2 患儿4个月和12个月时头MRI

Fig.3 Single-voxel proton magnetic resonance spectroscopy(Singlevoxel MRS)of the right internal capsule图3 患儿右侧内囊区单体素磁共振波谱
2 二代测序及数据分析
2.1 二代测序结果 对测序结果进行筛选,发现位于 ChrX:73745729(GRCh37 / hg19)的SLC16A2(Solute carrier family 16,member 2)基因4 号内含子c.1170+1G>A 半合子突变,可能是导致患儿表型的致病突变。通过Sanger验证该突变来自母亲(图4)。在 ESP(Exome Variant Server)数 据 库 ,HGMD(Human Gene Mutation Database)数据库、千人数据库未检索到该变异的报道。
2.2 生物信息学分析 对上述突变应用MutationTaster 中的phyloP/phastCons 方法进行保守分析,得分分别为5.64(范围:-14~+6,分值越高,保守程度越高)、1(越接近1,保守程度越高),说明突变位点高度保守;剪切位点分析示该突变可导致剪切位点改变,使表达的氨基酸自改变的剪切位点下游丢失,改变蛋白质特征。Human Splicing Finder 预测该突变使得剪切供体位点CV(consensus values)从突变前的98.84 降至72.01,预测其可能破坏原剪切位点,使下游的隐蔽剪切位点活化,使SLC16A2的4 号外显子长度由 144 增至 153。MaxEntScan 分析c.1170+1G>A 突变使最大熵模型评分由10.67 降至2.49(-76.66%),可能影响pre-mRNA 的剪切。根据遗传变异分类标准与指南[1],c.1170+1G>A突变符合致病变异分级标准中1个非常强、1个中等和1个支持证据,综合分析该突变为致病性突变。
3 讨论
甲状腺素(TH)对体格、神经系统发育、能量及物质代谢有重要作用。甲状腺素为亲脂类激素,主要由核内甲状腺素受体介导发挥作用,而TH需要甲状腺素膜转运蛋白转运至细胞内才可与受体结合,故转运蛋白对TH 在核内的可用性至关重要[2]。MCT-8(Monocarboxylate transporter 8)是最特异性的TH 转运体,由SLC16A2编码,可介导 T4、T3 转运通过细胞膜[3]。
SLC16A2基因致病变异使甲状腺素向神经元内转运障碍导致AHDS,系X 染色体相关的罕见遗传病,发病者为男性。大多数女性携带者由于X 染色体的非随机失活可无症状或仅表现出轻度的甲状腺功能异常,但无神经系统受损症状,所以SLC16A2更像是一个候选基因[2]。目前仅见1例女性患者报道,可能与不利的X染色体非随机失活有关[4]。该患儿SLC16A2第 4 号内含子 c.1170+1G>A 点突变可能影响生物体mRNA 剪切异常导致MCT8 蛋白缺陷,既往未见此位点突变报道,这也是少数的内含子突变致病的报道。
本病临床表现可存在较大差异,轻者可具备一定的运动、语言能力,但仍存在严重的认知障碍,重者可表现为严重的精神运动发育迟缓、无言语能力或言语能力严重受损、先天性肌张力低下、肌张力障碍和锥体束征阳性,对头控制极差,不能维持抗重力姿势[5]。
AHDS 患者存在特异性甲状腺功能改变,表现为 FT3 增高,FT4 下降,TSH 可正常或轻度异常[6]。这种甲状腺功能紊乱原因尚不明确,可能与MCT8作用减低或缺失引起的对甲状腺素(T3/T4)转运率的差异有关[2]。Dumitrescu 等[2]通过动物实验证实AHDS模型鼠脑处于甲低状态,而其他不依赖MCT8的组织是甲亢的。研究表明患者肝脏、肌肉组织处于甲亢状态[7-8],且高T3 可过度消耗骨骼肌导致AHDS患者肌肉容积减少[9],这可能是患者体质量减轻的主要原因。

Fig.4 Sanger sequencing of the mutation sites in the child and his mother图4 患儿及母亲突变位点Sanger测序图
多数AHDS 患儿脑髓鞘化延迟或减低,对人脑组织切片对比及免疫组化研究提示AHDS患儿脑存在广泛的持续性低髓鞘化,且证实这种损害与MCT8缺陷所致甲状腺素转运障碍相关[10]。本例患儿2次头MRI 均可提示髓鞘化延迟,脑容积小。MRS 示相对较高的Cho 峰和相对较低的NAA 峰,结果与既往对AHDS 患者影像学研究相符,虽然不能绝对量化代谢产物,但可能提示髓鞘化形成或成熟延迟[11]。
另外,本例患儿自幼反复便秘,需考虑肠道可能处于甲状腺功能减低状态,但目前负责人肠道甲状腺素转运的特异性蛋白尚未见研究报道,故解释这一症状尚需进一步研究。对动物SLC16A2基因敲除实验研究表明,MCT8表达对眼底的发育过程至关重要[12],故推测MCT8 缺陷可能引起眼底发育不良。患儿两次VEP 未能引出P100,不能除外与MCT8 缺陷有关。患儿4 个月时曾行眼底镜检查正常,分析原因为眼底镜检查可能对轻微的眼底异常检出率不高,眼底发育不良可能处于早期,表现不典型。
AHDS 尚无有效治疗,但有学者进行了以下探索。AHDS中枢神经系统处于甲低状态,但因TH转运障碍,长期激素替代疗法并不能改善神经系统损害症状[13]。故有学者应用不依赖MCT8转运的甲状腺素类似物对AHDS 进行治疗并长期观察,发现二碘代丙酸(Diiodothyropropionic Acid,DITPA)可纠正的外周甲状腺功能异常及外周甲亢症状,而不产生不良反应,但不能改善患儿神经系统损害症状[14]。AHDS神经系统损害可能在胎儿期即开始出现[10,15],在这个神经系统发育关键期对TH 的剥夺对神经系统损害可能是不可逆的,DITPA 的治疗为时已晚。这也可解释AHDS患儿要比未经治疗的先天性甲状腺功能减低的患儿临床表现严重得多,特别是在运动发育方面。目前对AHDS基因治疗也取得初步成果,应用前景值得期待[16]。
综上所述,SLC16A2基因 c.1170+1G>A 半合子突变可能导致男性AHDS。AHDS存在甲状腺功能、神经系统多系统损害。如果能熟悉该综合征的典型临床表现及甲状腺功能的特异性改变,多能临床诊断。治疗上除了对症支持治疗,对于甲状腺素类似物的应用及应用时机的把握、基因治疗可能是未来研究的主要方向。
