春季低温对小麦颖果发育的影响
2020-04-01余徐润顾清钦倪爱淳夏敏洁
余徐润,郝 朵,顾清钦,倪爱淳,夏敏洁,臧 勇,熊 飞
(江苏省作物遗传生理国家重点实验室培育点/粮食作物现代产业技术协同创新中心/扬州大学教育部农业与农场品安全国际合作联合实验室,江苏扬州 225009)
初春气温回升较快,而在春季后期气温偏低的天气现象称为倒春寒,此时,小麦的穗正处于对低温极其敏感的雌雄蕊分化期至药隔期之间。低温会导致小麦营养生长、生殖生长均受到抑制,在一定程度上使小麦减产。研究表明,小麦籽粒的品质与产量是由基因型和环境因素共同决定的[1],但小麦籽粒的品质受到环境因素的影响更大[2]。小麦生长发育过程中,低温使小麦的穗生长量减少、千粒重下降[3],同时还会减缓小麦的发芽速度,阻碍幼苗的生长[4]。晋鹏宇等[5]研究表明,春季低温阴雨,会导致小麦在穗分化中后期可孕小花数及籽粒结实数减少,最终造成产量下降。而这些产量下降的原因一方面可能在于碳水化合物的代谢过程受到了低温的影响[6];另一方面,在生理水平上,低温胁迫降低了能量利用的能力,从而抑制了光合作用的进程[7]。而小麦为适应低温环境的影响,其内源激素含量也会发生相应的变化[8],在低温胁迫下,氮同化能力也会发生一定的改变,从而使籽粒中蛋白质的积累发生变化[9]。
前人研究都集中在探究低温胁迫对小麦籽粒品质、产量以及物质能量代谢等方面的影响,有关春季低温条件下小麦籽粒形态结构发育的研究较少。本研究以扬麦15为材料,在雌雄蕊分化期至药隔期之间设置-3 ℃低温处理,从显微和超微结构水平观察低温处理下小麦颖果果皮消亡、胚乳储藏物质积累以及养分运输组织微观结构的变化,以期解析小麦颖果发育过程中的结构变化对春季低温的响应机制,为培育抗寒小麦品种提供理论参考。
1 材料与方法
1.1 试验材料
本研究所选用的小麦品种为扬麦15,由江苏里下河地区农业科学研究所提供,于2018-2019年种植于扬州大学江苏省作物栽培重点实验室试验棚内。使用盆栽方式种植,每盆播种20粒种子,通过体式显微镜剥离幼穗,确定小麦幼穗处于雌雄蕊分化期至药隔期时,于扬州市农科所低温室进行低温处理。湿度设定为75%RH,CO2设置为500 ppm。对照组温度为0 ℃,低温处理组白天0 ℃处理14 h,夜间-3 ℃处理10 h,处理 3 d后搬回试验棚内继续进行正常温度生长,后续管理均一致。低温处理组与对照组均选取3盆盆栽作为试验材料。在小麦开花时,用记号标注穗中部小穗基部的第二朵小花并挂记号牌准确记录开花时间。
1.2 颖果组织结构的半薄切片观察
将不同发育时期的颖果中部进行横切,厚约2 mm,参照熊 飞等[10]的方法制作树脂样品块,采用超薄切片机将样品切为1 μm厚的薄片,用 0.5%甲基紫以及甲苯胺蓝溶液对切片进行染色,然后在光学显微镜下观察并拍照。每组随机挑选3个颖果作为重复,每个颖果均来自不同麦穗。
1.3 细胞数目和果皮厚度观测
使用Image-Pro Plus图像分析软件对拍摄的显微图像进行处理,将标尺设定后利用软件中的长度和距离快捷工具测量颖果长度、宽度等。利用软件中计数功能,对果皮细胞层数等进行统计。每组样品均选取3粒颖果作为重复,并将每粒颖果拍摄3张显微图片,后续进行数据统计。
1.4 细胞及细胞内含物面积统计
参考余徐润等[11]的方法,用Image-Pro Plus和Photoshop软件对腹部胚乳中淀粉体和蛋白体的相对面积、养分运输途径中韧皮部及珠心突起传递细胞面积。每组样品均选取3粒颖果作为重复,并将每粒颖果拍摄3张显微图片,后续进行数据统计。
1.5 数据统计与分析
使用Excel处理数据,采用SPSS 19.0进行t检验。图表制作采用Photoshop CS6图像处理软件和Origin 8.5函数绘图软件。
2 结果与分析
2.1 春季低温对颖果外观形态的影响
颖果发育早期呈乳白色,发育至花后15 d左右时,其纵向生长基本固定,其后进行横向生长,与对照组相比,低温处理组颖果果皮颜色更绿(图1A)。花后20 d,颖果形态基本成型,果皮颜色从绿色向黄色转变。花后30 d,与对照组相比,低温处理组果皮颜色更深。通过对颖果的长度和宽度进行统计,发现花后5~20 d,低温处理组的颖果长度均大于对照组,而在花后25~30 d时,对照组的颖果长度均大于低温处理组(图1B)。而在发育过程中颖果的宽度,对照组均宽于低温处理组(图1C)。

A图下方的数字表示花后天数(d);*表示对照和处理组间差异显著(P<0.05);CK为对照组;LTT为低温处理。Numbers in figure A indicate the days(d) after flowering. * indicates significant difference between control and treatment groups (P<0.05). CK is the control; LTT is the low temperature treatment.图1 低温处理下颖果形态发育过程(A)及其长度(B)和宽度(C)的变化Fig.1 Changes of caryopsis morphological development(A) and its length(B) and width(C) under low temperature treatment
以上结果表明,在颖果发育早期,低温促进了颖果的长度生长、抑制了宽度生长;与对照相比,低温处理组小麦颖果发育时期缩短。
2.2 春季低温对颖果果皮发育及消亡的影响
花后5 d,中果皮细胞开始凋亡,大量游离淀粉粒充斥在中果皮和内果皮的空隙间(图2A、D、A1、D1),对照组的果皮细胞层数多于低温处理组。花后10 d,可以观察到低温处理组小麦颖果果皮细胞进一步降解,其果皮细胞层数少于对照组,且出现凋亡空腔(图2B、E)。花后15 d,中果皮细胞基本降解完全,此后果皮细胞的层数不发生变化,两者之间无明显差异(图2C、F)。花后20~30 d之间,果皮中淀粉粒完全降解,果皮细胞层数保持不变(图2G~L)。

A、B、C、G、H、I 分别为正常温度下小麦花后5、10、15、20、25、30 d的颖果果皮显微结构;D、E、F、J、K、L 分别为低温处理下小麦花后5、 10、15、20、25、30 d的颖果果皮显微结构;A1、B1、D1、E1均为相应时期完整结构图;SG:淀粉体;Ex:外果皮; Me:中果皮。A,B,C,G,H and I are the pericarp microstructures of wheat caryopsis at normal temperature at 5,10,15,20,25 and 30 d after flowering; D,E,F,J,K and L are the microstructure of the pericarp in wheat caryopsis at 5,10,15,20,25 and 30 d under low temperature treatment; A1,B1,D1 and E1 are complete structural diagrams of the corresponding periods; SG:Starch granule; Ex:Exocarp ; Me:Mesocarp.图2 低温处理对小麦果皮发育的影响Fig.2 Effect of low temperature treatment on the development of wheat pericarp
上述结果表明,在颖果发育5~10 d时,对照组果皮细胞层数均多于低温处理组,且果皮中含有较多淀粉,说明对照组发育较迟缓,且果皮降解时间晚。但随着生长发育的进行,果皮淀粉粒发生降解,发育后期,中果皮细胞逐步凋亡。
2.3 春季低温对颖果胚乳发育的影响
从图4可以看出,花后5 d,腹部胚乳细胞刚开始分化(图3A、D,图4A、D),只有少量的物质积累。花后10 d,细胞开始生长分化,此时,腹部胚乳细胞中出现淀粉体,且大多聚集在细胞壁周围,同时细胞中也开始积累蛋白体。通过显微和超微结构观察及统计分析(图3B、E,图4B、E,表1),发现该阶段中低温处理组淀粉体含量高于对照组,但蛋白体含量少于对照组。花后15 d,蛋白体的积累量持续增加,淀粉体的数量也不断增多,此时对照组蛋白体的含量多于低温处理组,而淀粉体数量低温处理组较多(图3C、F,图4C、F,表1)。花后20 d,蛋白体之间相互靠近,使得蛋白体体积增大,且细胞中聚集了一些小淀粉体(图3G、J,图4G、J)。花后25 d,蛋白体相互聚集,此时,对照组蛋白体数量持续多于低温处理组,淀粉体含量仍然较少(图3H、K,图4H、K,表1),但对照组腹部充实度高于低温处理组。花后30 d,大量淀粉体和蛋白体充实于细胞内,且在对照组中较多蛋白体聚集在一起,低温处理组蛋白体数量低于对照组,且胚乳充实度仍然小于对照组(图3I、L,表1)。
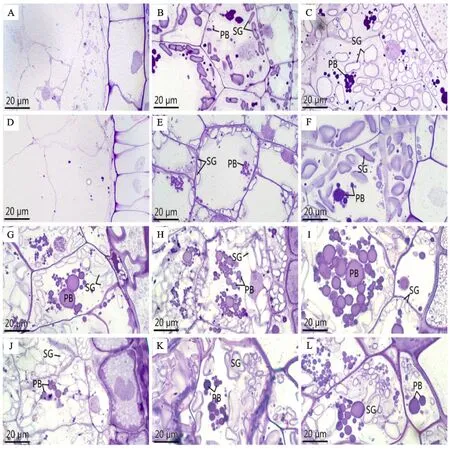
A、B、C、G、H、I 分别为正常温度下小麦颖果花后5、10、15、20、25、30 d的腹部胚乳细胞;D、E、F、J、K、L 分别为低温处理下小麦颖果花后5、10、15、20、25、30 d的腹部胚乳细胞;SG:淀粉体;PB:蛋白体。A,B,C,G,H and I are abdominal endosperm cells at 5,10,15,20,25 and 30 d after flowering of wheat caryopsis at normal temperature; D,E,F,J,K and L are the abdominal endosperm cells at 5,10,15,20,25 and 30 d after anthesis of wheat caryopsis under low temperature treatment; SG:Starch granule; PB:Protein body.图3 低温处理对小麦颖果腹部胚乳细胞发育的影响Fig.3 Effect of low temperature treatment on the development of abdominal endosperm cells in wheat caryopsis

A、B、C、G、H、I 分别为正常温度下小麦颖果花后5、10、15、20、25、30 d的腹部胚乳细胞(×3 000);D、E、F、J、K、L 分别为低温处理下小麦颖果花后5、10、15、20、25、30 d的腹部胚乳细胞(×3 000);SG:淀粉体。A,B,C,G,H,I are abdominal endosperm cells(× 3 000) at 5,10,15,20,25 and 30 d after flowering of wheat caryopsis at normal temperature; D,E,F,J,K and L are abdominal endosperm cells(× 3 000) at 5,10,15,20,25 and 30 d after flowering of wheat caryopsis under low temperature treatment,respectively. SG:Starch granule.图4 低温处理下小麦颖果腹部胚乳细胞的扫描电镜图片Fig.4 Scanning electron microscopy images of abdominal endosperm cells in wheat caryopsis under low temperature treatment
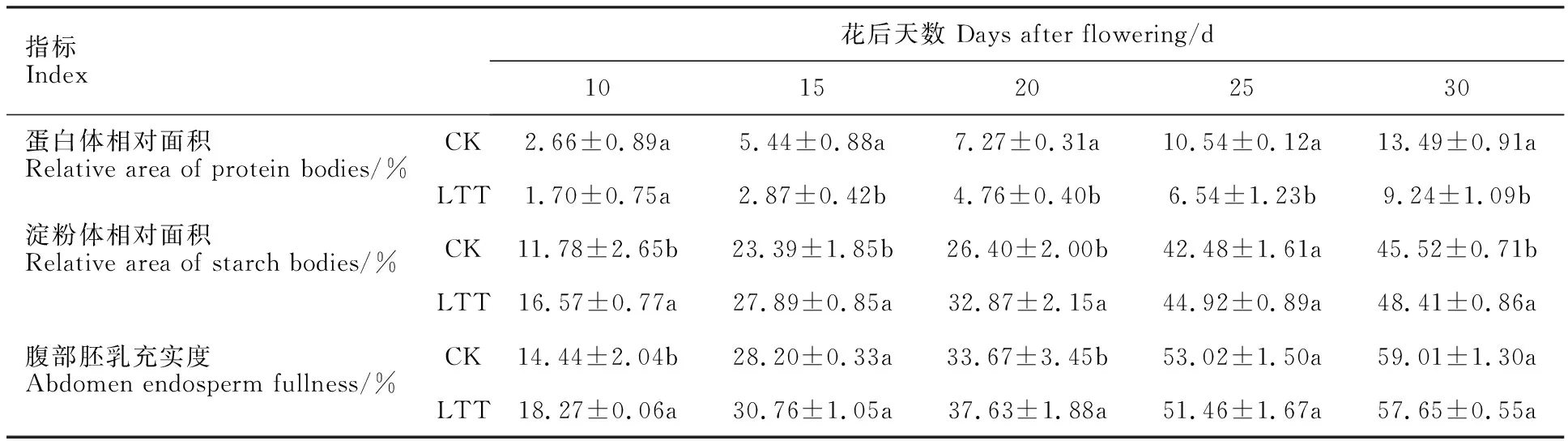
表1 低温处理对小麦颖果腹部胚乳蛋白体和淀粉体面积以及充实度的影响Table 1 Effect of low temperature treatment on the area of protein body and starch granule and the plumpness of abdominal endosperm in wheat caryopsis
以上结果表明,颖果发育早期低温处理组淀粉体发育较快,腹部胚乳充实度显著高于对照组,因此,低温处理在颖果发育的早期促进了腹部胚乳的分化,加速了胚乳的发育。但随着发育进行,腹部胚乳发育渐缓,蛋白体含量以及腹部胚乳充实度均低于对照组。
2.4 低温处理对颖果养分运输组织发育的影响
通常情况下,小麦韧皮部是用来运输光合产物等有机物质,在小麦维管束的发育过程中,主要依赖于韧皮部的发育,从而进行同化物的运输。花后5 d,韧皮部中的薄壁细胞出现,具有明显的细胞核(图5A、D),此时低温处理组的韧皮部面积大于对照组(表2)。花后10 d,维管薄壁中细胞核数量均减少(图5B、E),但对照组韧皮部面积小于低温处理组。花后15 d,筛管细胞数均明显增加,维管薄壁细胞中细胞核数量均有所减少(图5C、F)。花后20 d,维管薄壁细胞变得不规则,且开始凋亡(图5G、J)。花后25~30 d,韧皮部面积持续增加且低温处理组面积较大(图5H、I、K、L,表2)。
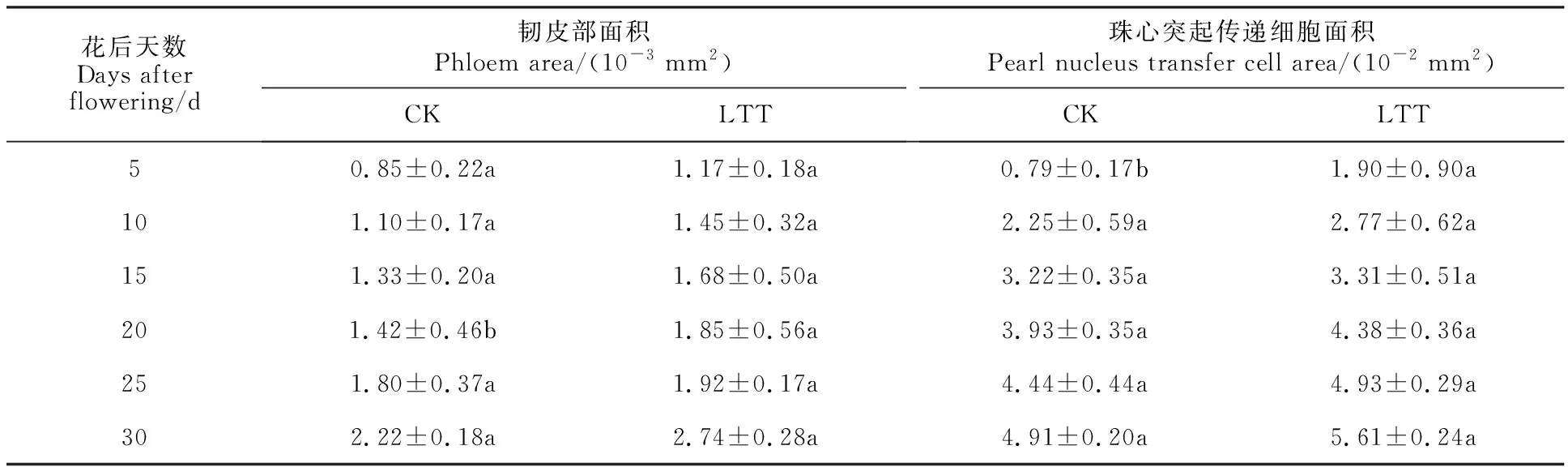
表2 低温处理对颖果维管束中韧皮部面积及珠心突起传递细胞面积的影响Table 2 Effect of low temperature treatment on phloem area and the area of nucellar projection transfer cells in caryopsis vascular bundle

A、B、C、G、H、I 分别为正常温度下小麦颖果花后5、10、15、20、25、30 d的韧皮部细胞;D、E、F、J、K、L 分别为低温处理下小麦颖果花后5、10、15、20、25、30 d的韧皮部细胞;Nu:细胞核; ST:筛管;SG:淀粉体。A,B,C,G,H and I are phloem cells at 5,10,15,20,25 and 30 d after flowering of wheat caryopsis under normal temperature; D,E,F,J,K and L are the phloem cells at 5,10,15,20,25 and 30 d after flowering in wheat caryopsis under low temperature treatment; Nu:Nucleus; ST:Sieve tube; SG:Starch granule.图5 低温处理对颖果韧皮部发育的影响Fig.5 Effect of low temperature treatment on the development of phloem in caryopsis
以上结果表明,低温处理使韧皮部面积增大,物质的运输效率更高,更有利于养分的输送。
花后5 d,小麦颖果具有较大的珠心突起细胞,细胞内有大的细胞核,且最外层的细胞出现加厚(图6A、D),低温处理组珠心突起细胞厚度大于对照组。花后10 d,珠心突起细胞加厚转变为珠心突起传递细胞(图6B、E)。花后15~20 d,绝大部分珠心突起细胞分化为珠心突起传递细胞,细胞壁进一步加厚(图6C、F、G、J),此时低温处理组珠心突起传递细胞面积大于对照组(表2)。花后25~30 d,珠心突起传递细胞已经具有较厚的细胞壁,此时部分外层细胞出现皱缩,可以清楚地观察到细胞残体(图6H、I、K、L),此时低温处理组珠心突起传递细胞面积大于对照组。

A、B、C、G、H、I 分别为正常温度下小麦颖果花后5、10、15、20、25、30 d的珠心突起传递细胞;D、E、F、J、K、L 分别为低温处理下小麦颖果花后5、10、15、20、25、30 d的珠心突起传递细胞;NP:珠心突起;NPTC:珠心突起传递细胞。A,B,C,G,H,and I are the nucellar projection transfer cells at 5,10,15,20,25 and 30 d after flowering of wheat caryopsis under normal temperature,respectively; D,E,F,J,K and L are the nucellar projection transfer cells at 5,10,15,20,25 and 30 d after flowering in wheat caryopsis under low temperature treatment; NP:Nucellar projection; NPTC:Nucellar projection transfer cells.图6 低温处理对小麦颖果珠心突起传递细胞发育的影响Fig.6 Effect of low temperature treatment on the development of nucellar projection transfer cells in wheat caryopsis
以上结果表明,低温处理组珠心突起传递细胞细胞壁较厚于对照组,且珠心突起传递细胞面积也较对照组更大。因此,低温处理组具有较高效的养分卸载能力。
3 讨 论
3.1 春季低温对颖果形态发育的影响
在小麦生长发育过程中一旦出现春季低温胁迫,小麦的单株产量会明显下降,同时籽粒的品质也会发生改变[2]。此时小麦正处于拔节期至孕穗期,低温会使由茎秆传输至叶片的同化物含量减少,从而导致干物质的积累量减少,最终降低产量[12]。路玉彦[13]发现,大麦经低温处理后,其花器官生长受到负面影响,花药变小,可育小花数下降,不育花粉数增加,穗部结实率降低;低温处理在颖果发育后期也具有影响,当营养组织中的物质大量消耗之后,营养物质的运输速率开始减缓,最终导致籽粒粒重低于正常处理。李玉刚等[14]研究发现,孕穗期低温会导致冬小麦籽粒看起来干瘪,粒宽减少,千粒重降低,这也与本研究结果相一致。
3.2 春季低温对果皮消亡及胚乳发育的影响
果皮中淀粉主要贮藏在中果皮,随着小麦颖果的生长发育,中果皮发生细胞程序性死亡,大量的细胞出现变形和破裂现象,同时释放出淀粉粒[15]。在小麦发育过程中如遭遇到低温胁迫等环境因素均会对果皮的发育造成一定的影响。本研究发现,在颖果发育前期,低温处理组小麦颖果果皮细胞层数少于对照组,这可能是由于早期小麦为应对低温环境,加速其生长发育,从而使得果皮凋亡速度提前,加快了果皮的发育进程。陈思思等[16]研究表明,低温胁迫下叶片的净光合速率、气孔导度、蒸腾速率均下降,此时小麦果皮中的叶绿素合成也会受到影响,从而抑制果皮的发育进程。
胚乳的发育包含细胞数目的增加、细胞体积的扩大、淀粉体和蛋白体的充实等过程。淀粉体和蛋白体的发育状况直接影响小麦产量和品质[17]。韦存虚等[18]研究表明,小麦胚乳中蛋白体大概于花后第8~9天开始出现。随着胚乳细胞的发育,蛋白体不断充实与积累,多个小蛋白融合形成一些较大的蛋白体。熊 飞等[19]认为,花后7 d,小麦胚乳中大淀粉的数量增长减慢,大约花后14 d开始出现小淀粉粒,且在籽粒成熟之前,小淀粉粒的数量以及大小都不断增加。在本研究中,遭受低温胁迫的小麦胚乳在花后10 d淀粉体数量显著多于对照组,而腹部胚乳中的蛋白体数量低于对照组。但小麦胚乳细胞充实是一个动态变化过程,因此低温胁迫对胚乳发育的影响可以用胚乳细胞中胚乳充实度所衡量。本研究结果表明,在发育早期,低温对胚乳发育具有促进作用,但随着对胚乳发育的减缓,低温处理组的胚乳充实度低于对照组。
3.3 春季低温对颖果养分运输组织的影响
养分的输送主要依靠腹部维管组织进行,叶片中合成的光合产物,需通过筛分子输送到贮藏库[20]。刘大同等[21]发现,维管束越发达,筛管面积就越大,韧皮部的卸载能力就越强。养分通过合点输送至珠心突起细胞,珠心突起细胞间隙较大,有利于养分质外体的输送[20],且珠心突起传递细胞质膜表面积的增加对颖果干物质的积累具有促进作用[22]。本研究通过切片观察发现,在颖果早期发育过程中,低温处理组珠心突起传递细胞壁较厚,细胞层数多且面积较大,因此能够更高效地将来自维管束的养分运输至胚乳腔中,最终进入籽粒。
