小麦茎基腐病和赤霉病抗源筛选及关联SNP位点分析
2020-04-01蒲乐凡欧杨晨任慧莉曾庆东胡小平李春莲韩德俊
蒲乐凡,任 慧,欧杨晨,任慧莉,曾庆东,胡小平,李春莲,韩德俊
(1.西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
小麦茎基腐病(crown rot,CR)和赤霉病(Fusarium head blight,FHB)是由镰孢菌引起的两种主要的小麦病害。这两种病害会造成小麦严重的产量损失和品质下降,而且病粒中会产生和积累以脱氧雪腐镰刀菌烯醇(DON)为主的真菌毒素,食用后可引起人畜中毒[1-2]。CR最早被发现于澳大利亚[3],目前在澳大利亚、欧洲、南美、北美、西亚、北非和南非等地小麦种植区危害尤为严重[4-5]。FHB在世界范围内的小麦种植区广泛发生。我国是全球小麦赤霉病受害面积最大的国家之一,发病区域主要集中在长江中下游冬麦区和东北东部春麦区,近年来已经蔓延至黄淮麦区。由于引起CR和FHB的病原菌均为镰孢菌,而且该致病菌能引起多种禾谷类作物相似的病害,因而造成一些稻—麦轮作区和小麦—玉米轮作区病原菌生活的周年循环,加之秸秆还田和免耕等耕作措施的推广应用,使得菌源量逐年增加,从而加重了这些地区的病害流行。近年来,黄淮麦区包括河北、河南、安徽、山东、江苏及陕西,CR和FHB已成为小麦生产上的重大病害,严重威胁着小麦的安全生产[6-8]。
种植抗病品种是控制小麦病害流行最经济有效的途径,鉴定和筛选优异抗源是进行小麦抗病育种的基础。由于小麦对CR和FHB的抗性属于数量性状,遗传基础复杂,易受环境影响,因而在抗源的鉴定、筛选和利用上存在一定的困难。国内外的科学家很早就开展了小麦赤霉病抗源鉴定和筛选工作,筛选出了一批抗性稳定的抗源,如来自日本的Shinchunaga和Nobeokabouzu,巴西的Frontana和Encruzilhada,美国的Ernie和Freedom,欧洲的Praa 8和Novkrumka,以及中国的望水白、苏麦3号和宁7840[9-13]。其中,苏麦3号目前仍然是世界公认抗性最好的抗源,而且已被广泛运用于育种实践。然而,苏麦3号广泛使用所带来的抗源单一问题及其在育种中存在的很多负效应,促使育种家去寻找新的抗源[14]。截止目前还没有发现对CR免疫的材料,高抗的种质资源也极为稀少[15]。国内外有关不同小麦品种(系)对茎基腐病抗性研究已有一些报道,但发现的抗性品种(系)数量较少,而且多表现中抗,缺乏高抗品种[16-18]。生产上急需筛选并创制新的抗病材料,以提高小麦抗CR和FHB水平。
目前,已在不同小麦抗源材料中定位了数百个与FHB相关的QTL,分布在除1D、3D、5B和5D外的染色体上。明确的抗病基因有7个(Fhb1~Fhb7),其中Fhb1位于3BS染色体上,是国内外公认的抗性稳定且效应最大的位点,已在育种中得到广泛的应用,目前育成抗赤霉病品种大多携带Fhb1基因[20]。已定位与CR相关的QTL涉及小麦的13条染色体[15]。Wallwork等[21]在4B染色体上矮秆基因Rht1附近定位了一个CR成株抗性QTL,来源于抗性品种Kukri;Ma等[26]在3B和4B染色体上各定位了一个QTL(Qcrs.cpi-3B和Qcrs.cpi-4B),分别来源于两个亲本,且具有较强的互作效应。Bovill等[27]利用抗源Sunco的两个双单倍体(DH)群体在染色体1B、1D、2B、3B、4B、5B、5D、6B和7A上均定位到了CR苗期抗性QTL;Poole等[28]利用Sunco/Macon和Sunco/Otis重组自交系(RIL)群体在染色体1A、1D、2B、3B、4B、4D和7A上定位到了与CR相关的QTL,其中位于3BL染色体上的QTL(Qcrs.wsu-3BL)效应最显著且在两个群体和多个环境中均能检测到,该QTL位于SSR标记Xgwm247和Xgwm299区间,遗传距离为1.8 cM,且Qcrs.wsu-3BL与Qcrs.cpi-3B[26]和Qcr.usq-3B.1[27]可能为同一位点。Zheng等[29]分别在2D、4B和5D染色体上定位了4个与CR抗性相关的QTL,其中两个主效QTL分别位于5DS (Qcrs.cpi-5D)和2DL(Qcrs.cpi-2D)上。Zheng等[30]对Qcrs.cpi-3B进行了精细定位,将其定位在遗传距离为0.7 cM、物理距离为1.5 Mb区间内,并开发了7个共分离标记,筛选了63个编码序列,其中6个编码抗病蛋白。Yang等[25]利用GWAS技术鉴定出与CR抗性相关的286个SNP位于小麦第6同源群,其中6A上有266个SNP位于7.0 Mb区间,包含51个注释基因,并将抗性QTL定位在小麦6A、2D、2A染色体上,其中位于6A染色体上的QTL为主效位点,与标记AX-111106634紧密连锁,与GWAS结果相互印证。本研究1 000多个来自世界各地的小麦种质中筛选311个核心种质为供试材料,对其同时进行CR苗期和成株期抗性及FHB抗性鉴定,并利用全基因组关联分析(GWAS)鉴定与CR和FHB抗性相关的SNP位点,以期筛选出对CR和FHB具有抗性或兼抗两种病害的小麦种质,为小麦兼抗CR和FHB基因的定位和育种奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
禾谷镰孢菌FHB001菌株,由西北农林科技大学植物保护学院土传病害课题组提供。
假禾谷镰孢菌CX-46菌株,由西北农林科技大学植物保护学院土传病害课题组从陕西富平县小麦茎基腐病株上分离得到,是具有强致病性的菌株。
1.1.2 供试小麦种质
已完成660K芯片基因分型的311份小麦核心种质,由西北农林科技大学旱区作物逆境生物学国家重点实验室提供。抗赤霉病对照品种苏麦3号,由南京农业大学贾海燕教授提供。
1.2 试验方法
1.2.1 接种病麦粒制备
纯化的茎基腐病菌株CX-46接种到PDA培养基上,于25 ℃下活化培养3~4 d,则PDA培养基上长满菌丝。小麦籽粒在清水中浸泡过夜,在开水锅中煮30 min,晾干表面水分后分装至500 mL组培瓶中,121 ℃下灭菌30 min后,于烘箱中烘干3~5 h,即为麦粒培养基。将活化培养的菌饼混入麦粒培养基中,置于22 ± 1 ℃培养14~21 d,每天摇动培养瓶,使菌丝充分生长,菌丝量一致。
1.2.2 病原菌孢子悬浮液的制备
绿豆液体培养基制备:称取绿豆60 g,洗净后加入1 000 mL蒸馏水,加热煮沸10 min,滤液分装至100 mL三角瓶中,121 ℃灭菌30 min,冷却后即为绿豆液体培养基。
挑取活化的禾谷镰孢菌FHB001菌丝接种到绿豆液体培养基中,于25 ℃下振荡培养,转速为150 r·min-1。4~5 d后取少量培养液用血球计数板计数孢子悬浮液浓度,当浓度大于1×106个·mL-1时,用无菌细纱布过滤,滤液即为病原菌孢子悬浮液,将其于4 ℃冰箱保存备用。
1.2.3 茎基腐病苗期抗性鉴定
试验在西北农林科技大学温室内进行。将无菌基质土装入7 cm×7 cm×8 cm的方形小花盆中,表面经过消毒的小麦种子播种于花盆中,播种深度2~3 cm,每盆10粒。待小麦出苗长至二叶期,在每株小麦基部放置2粒经CX-46菌株扩繁的病麦粒,然后覆盖一层基质。接种后浇水保湿3 d,其后减少浇水量,以小麦不因缺水致死为宜。温室温度白天为22 ± 2 ℃,夜间温度为15 ± 2 ℃,自然光照。3个重复,随机排列。接种后 35 d左右调查发病情况。采用0~6级分级标准[19]进行病害严重度划分。
1.2.4 茎基腐病成株期抗性鉴定
CR成株期抗性鉴定在西北农林科技大学北校区试验地进行。于当年10月初播种,行长 1.0 m,行宽0.25 m,每行播种30粒,每材料播种2行。3个重复,随机区组排列。翌年小麦拔节期,地面浇水以保证接种时土壤有一定的湿度。将吸有1 mL浓度为1×106个·mL-1的CX-46孢子悬浮液无菌脱脂棉缠绕在离地面1.0 cm高的茎基部,每材料每重复选择1行接种10株。后期同正常小麦生长田间管理,乳熟期调查发病情况。采用0~4级反应分级标准[19]进行病情严重度划分。
1.2.5 赤霉病抗性鉴定
试验地点和栽培方式同1.2.4。于小麦扬花初期采用单花滴注法接种:选取麦穗中部小穗的第一朵小花,轻剥开颖壳,用1 mL医用注射器,将20 μL浓度为1×106个·mL-1的FHB001孢子悬浮液注射至小花雌蕊上,然后将喷淋蒸馏水的黑色塑料袋套住麦穗保湿48 h左右,并挂牌标记。每材料重复接种10穗。接种后21 d左右进行病情调查。苏麦3号为抗病对照,病害分级标准采用国家标准(GB/T15976-2011): 0级:未发病;1级:发病小穗数占全部小穗数的<25%以下;2级:25%<发病小穗数≦50%;3级:50%<发病小穗数≦75%;4级:发病小穗数>75%。
1.2.6 小麦茎基腐病和赤霉病抗性全基因组关联分析
采用TASSEL 5.0软件中的混合线性模型(mixed linear model,MLM),以Structure运算后的Q值和亲缘关系K值作为协变量,结合SNP芯片基因型数据,进行性状与标记的关联分析,确定关联位点。与性状显著关联的SNP位点阈值设为P<0.000 01。
1.2.7 数据统计方法
根据以下公式计算病情指数(diseases index,DI):
病情指数=[∑(各级病株数×病级代表数值)]/(调查总株数×发病最重级的代表数值)×100
依据DI范围将参试种质的抗性水平分为4级:抗病(R,DI<25)、中抗(MR, 25≤DI<40)、感病(S,40≤DI<55)和高感(HS,DI>55)。
采用QTL IciMapping 4.2软件中的AOV对不同小麦种质的病情指数进行方差分析。
2 结果与分析
2.1 311份小麦种质对茎基腐病和赤霉病抗性的方差分析
由表1可知,基因型对小麦茎基腐病和赤霉病DI指数的影响达到显著水平(P<0.000 1),而重复间差异不显著,说明小麦种质间对CR和FHB的抗性具有显著或不显著差异,对种质进行抗性筛选是可行的。由图1可以看出,311份小麦种质对CR和FHB的抗性呈连续分布,表明小麦对CR和FHB抗性是受多基因控制的。苗期和成株期CR的DI多集中在0~50之间,FHB的DI分布在20~100之间。

图1 病情指数在311个种质中的分布Fig.1 Distribution of DI in 311 germplasms
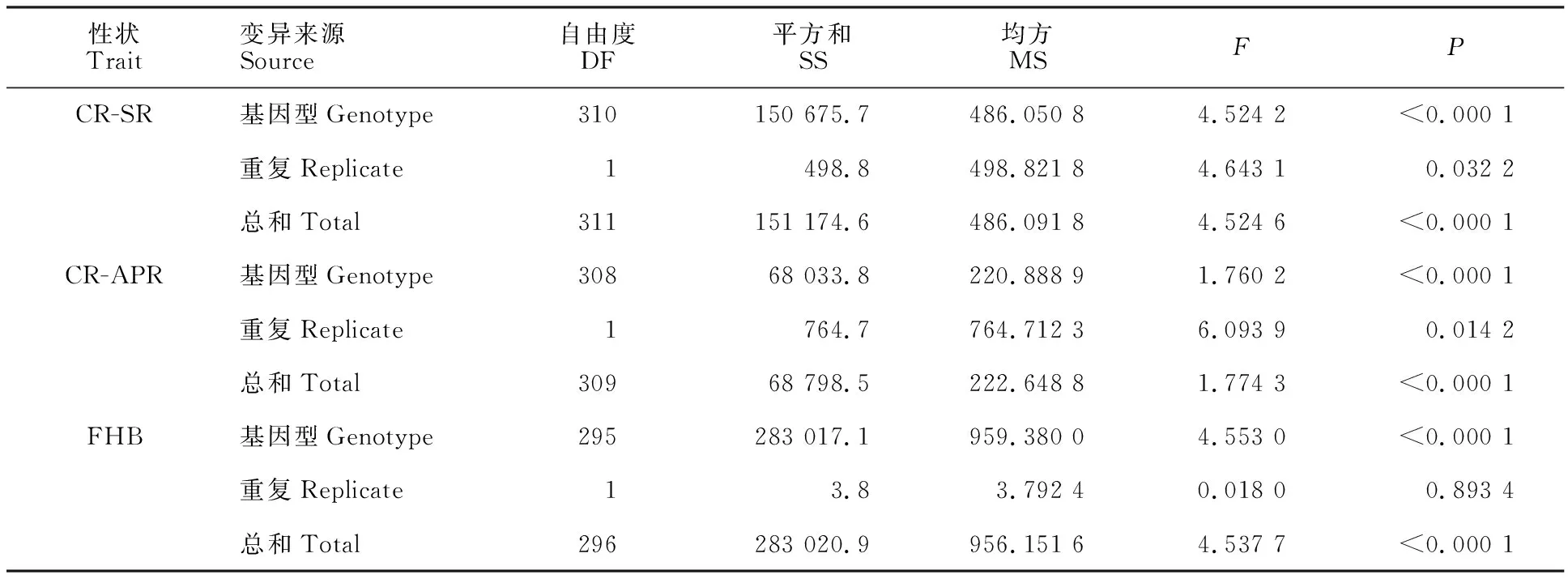
表1 311个小麦种质对茎基腐病和赤霉病抗性指数的方差分析Table 1 Analysis of DI of variety to CR and FHB resistance in 311 wheat germplasms
2.2 311份小麦种质对茎基腐病和赤霉病的抗性分析
由表2可知,CR苗期(CR-SR)、成株期(CR-APR)和FHB的DI范围分别为4.3~74.3、0~60.0和25.0~100.0。 CR苗期抗性表现为抗病(R)、中抗(MR)、感病(S)和高感(HS)的种质分别占8.4%、27.6%、23.2%和40.8%;CR成株期抗性表现为抗病(R)、中抗(MR)、感病(S)和高感(HS)的种质占比分别为17.2%、32.0%、32.0%和18.1%;FHB抗性表现为抗病(R)、中抗(MR)、感病(S)和高感(HS)的种质占比分别为4.6%,14.5%、25.7%和55.2%。 由表3可知,Cimrmanova、济南13、GHABAGHEB、秃芒麦共4个种质对CR的苗期抗性和成株期抗性均达到R级以上,表明这4个种质具有优良的CR抗性。陇春8号、中麦175、鲁麦5号、潍麦6号、皖麦50、Reeves、石家庄8号、西农928、山麦、SAFI-1/ZEMAMRA-1、平阳181和石家庄54共12个种质对FHB的抗性达到R级水平,表明这些种质具有优良的FHB抗性。山前麦、陇春8号、内江31、聊麦16和淮麦22共5个种质对CR和FHB均表现一定的抗性,且陇春8号对CR成株期抗性和FHB抗性均达到R级,表明该种质对这两种病害兼具优良抗性,对其抗性基因的深入挖掘及遗传研究将有益于小麦兼抗CR和FHB品种的创制及选育。

表2 茎基腐病和赤霉病不同抗性水平在小麦种质中的占比Table 2 Percentage of CR and FHB resistance level in wheat germplasms %

表3 对茎基腐病和赤霉病抗性水平为抗病(R)和中抗(MR)的小麦种质Table 3 Germplasms with resistance(R) or moderate resistance(MR) to CR and FHB
2.3 小麦茎基腐病和赤霉病关联SNP位点分析
利用全基因组关联分析(GWAS)对311份种质资源中的CR和FHB相关位点进行了初步分析,结果(表4)表明,有6个SNPs (AX-111698714、AX-110930956、AX110374888、AX-108758442、AX-108950785、AX-108823788)与CR-SR抗性显著相关,分别位于1A和6B染色体上;有9个SNPs(AX-110709299、AX-109031990、AX-111174283、AX-94737605、AX-110376668、AX-110372139、AX-108788482、AX-111765606、AX-94641684)与CR-APR抗性显著相关,分别位于1A、1B、3A、3B、6A、6B和6D染色体上;有13个SNPs (AX-109640275、AX-110416806、AX-111087746、AX-108737654、AX-109875876、AX-108780881、AX-109287222、AX-109859497、AX-109585867、AX-109850910、AX-108817303、AX-111233024、AX-109942609)与FHB抗性显著相关,分别位于5A、7A、7B染色体上。
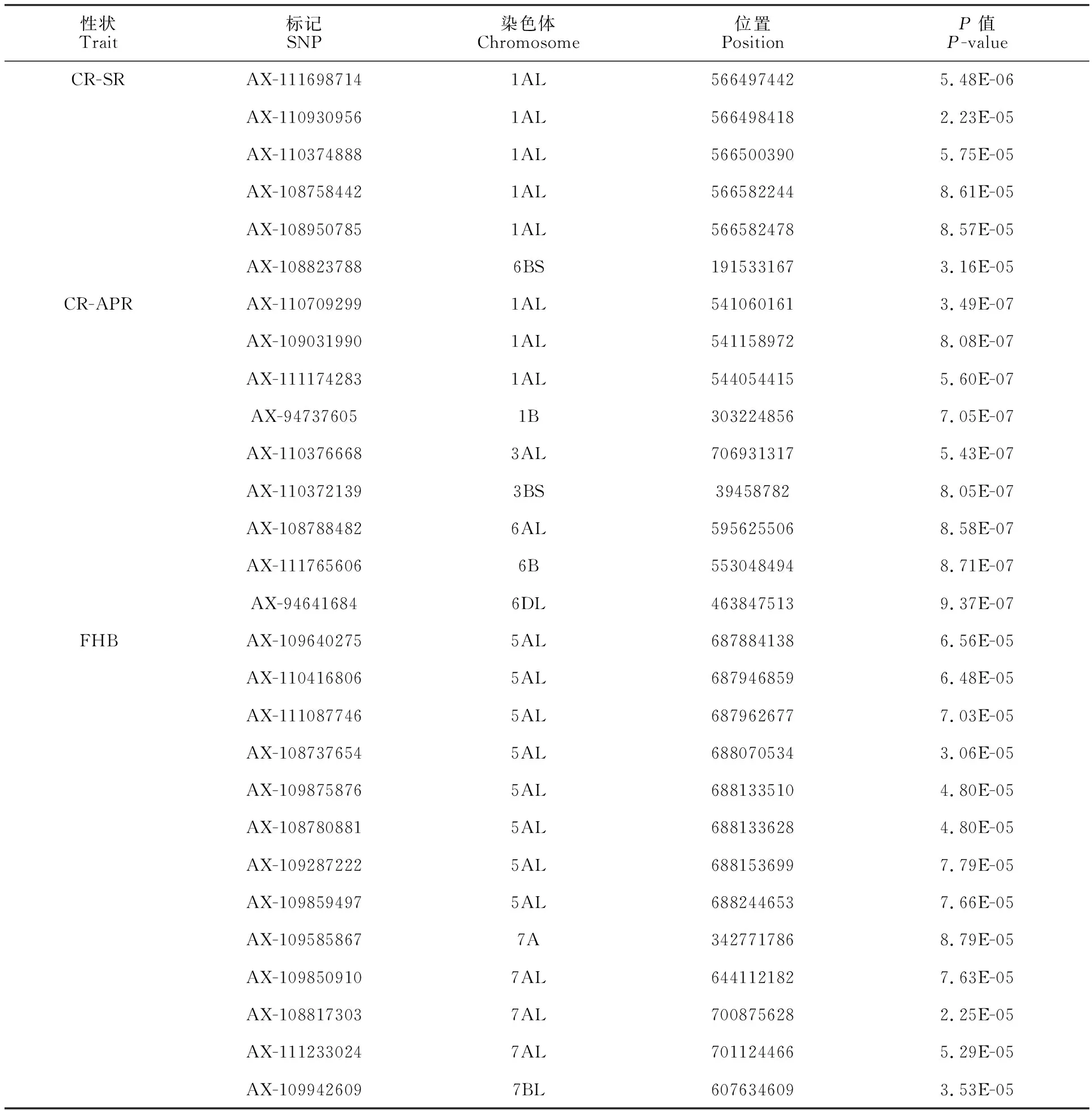
表4 茎基腐和赤霉病抗性关联位点Table 4 The locis associated with resistance to CR and FHB
3 讨 论
种质资源是抗病育种工作的基础。小麦FHB的抗源鉴定和筛选工作开展较早,目前在世界范围内进行过抗FHB鉴定的小麦材料在5万份以上。我国小麦赤霉病研究协作组对23 434份国内小麦资源材料、9 184份国外引进材料、 1 557份小麦属其他稀有资源材料、26份山羊草属材料和170份小黑麦材料进行了鉴定,筛选出抗或中抗材料1 796份,其中来自我国的材料占92.2%,育成品种占抗源的70%以上,表明我国小麦材料中具有丰富的FHB抗源且具有育种应用价值[20]。对于CR抗性基因及抗源筛选方面的研究,尽管国内外有关不同小麦品种(系)对茎基腐病抗性研究已有一些报道,但未发现免疫或高抗的抗源[16-18]。Wallwork等[21]筛选出了4个小麦品种(Gluyas Early、2-49、Sunco、Kukri)对CR具有成株抗性,并将来源于Kukri的抗性QTL定位于小麦4B染色体上的矮化基因Rht1附近;Mitter等[22]采用高通量苗期温室鉴定对澳大利亚1 400多份小麦种质资源进行了茎基腐病抗性评价,筛选到了3个对CR具有稳定抗性的品种(Sunco、Kennedy和Wollaroi)。张 鹏等[23]对我国82份小麦种质进行了苗期接种鉴定,没有发现高抗材料,筛选出中抗的材料13份,包括CI12633、红蚰子、FHB143、Tiszataj和紫秆子等。杨 云等[24]对黄淮麦区小麦主推品种进行了苗期盆栽接种和田间成株期接种抗性鉴定,均未发现免疫和高抗品种,仅有兰考198、许科718等10个品种表现为中抗;Yang等[25]对234个我国黄淮麦区的小麦品种进行了温室苗期鉴定,仅有7个品种对CR表现一定的抗性;石善党[19]对近两年黄淮麦区的国审品种同时进行了CR和FHB鉴定,发现仅有LS4607和存麦633表现对CR苗期抗性,LS4607和中育1526表现对CR成株期抗性和赤霉病抗性,大多数品种对CR和FHB表现感病。表明了目前生产上小麦品种对CR抗性整体较差。本研究对311个种质进行了CR和FHB抗性评价,结果发现,Cimrmanova、济南13、GHABAGHEB、秃芒麦对CR的苗期抗性和成株期抗性水平均达到R级以上,表明这4个种质具有优良的CR抗性。陇春8号、中麦175、鲁麦5号、潍麦6号、皖麦50、Reeves、石家庄8号、西农928、山麦、SAFI-1/ZEMAMRA-1、平阳181和石家庄54对FHB达到R级抗性水平,表明这12个种质具有优良的FHB抗性。山前麦、陇春8号、内江31、聊麦16和淮麦22对CR和FHB均表现一定的抗性。
到目前为止,已在不同的抗源材料中定位了数百个与FHB相关的QTL,分布在除1D、3D、5B和5D外的小麦染色体上。明确的抗病基因有7个(Fhb1~Fhb7),其中Fhb1位于3BS染色体上,是国内外公认的抗性稳定且效应最大的位点,并已在育种中得到广泛的应用,目前育成抗赤霉病品种大多携带Fhb1基因[20]。目前已定位与CR相关的QTL涉及小麦的13条染色体[15]。本研究利用GWAS技术鉴定出与CR相关的SNP分布在1A、1B、3A、3B、6A、6B和6D染色体上,进一步表明了小麦茎基腐病抗性为数量性状,抗性位点涉及多条染色体。目前,本课题组正在利用前期构建的相关连锁群体对这些位点进行验证和精细定位,以期为抗病基因的克隆和抗病品种选育奠定基础。
CR和FHB均为镰孢菌引起的,从CR和FHB病株中也可分离出相同的致病菌[31-32],且人工接种下,引起CR的多数致病菌同样能引起FHB[8,33],因此有学者认为控制CR和FHB抗性的基因可能是一致的。但是,两种病害在发生时间、发生条件及流行规律等方面存在很大差异,表明控制两种病害的基因位点可能不同。Li等[34]研究证明,控制CR和FHB的QTL在不同的染色体上,也就是说CR和FHB是由不同的基因控制的。本研究同样发现,CR和FHB抗源种质不一致,例如,对CR苗期表现抗病(R)和成株期表现高抗(HR)的种质Cimrmanova,对FHB表现高感(HS);而西农928对FHB表现抗性(R),而对CR苗期和成株期均表现高感(HS)。本研究还发现,与CR和FHB关联SNP并不在同一染色体上,说明控制CR和FHB的基因位点是不同的,已有的FHB抗性基因及种质并不能作为CR抗源。此外,有4份种质对两种病害均表现出一定的抗性,说明控制CR和FHB的基因也可能存在于同一种质中,筛选这样的兼抗种质,可为小麦兼抗CR和FHB基因的定位和育种应用奠定材料基础。
