不同LED光色对家兔繁殖性能的影响及其分子调控机制
2020-03-27潘孝青王杏龙杨杰秦枫邵乐李健张霞翟频
潘孝青 王杏龙 杨杰 秦枫 邵乐 李健 张霞 翟频


摘要:為探讨不同LED光色影响母兔繁殖效率的分子机制,将单笼饲养的300只后备母兔随机分成5组进行不同LED光色处理,每组3个重复,每个重复20只。在4个不同LED光色处理组兔笼上方60 cm处向下分别投射LED红光(660 nm)、LED绿光(540 nm)、LED蓝光(480 nm)和LED白光(400~760 nm),对照组投射白炽灯光(400~1 050 nm)。母兔每周接受3次补光(LED光处理),即每周的周五至周日下午18∶00至次日上午6∶00,时长为12 h,预试验7 d,正试期90 d。LED灯及白炽灯的光照度均设置为100 lx。结果显示:LED红光组母兔同期发情率与白炽灯光对照组及LED白光组相比,分别提高20.89个百分点和10.51个百分点,差异显著(P<0.05);与绿光组及蓝光组相比,分别提高4.66个百分点和7.33个百分点,差异不显著(P>0.05)。LED红光组母兔卵巢红色大卵泡数量有增加趋势,但各试验组间卵巢红色大卵泡数量差异不显著(P>0.05)。与白炽灯光、LED白光、绿光、蓝光相比,LED红光能促进母兔垂体GnRHR mRNA表达,但差异不显著(P>0.05);与LED白光、绿光、蓝光相比,LED红光显著提高了卵巢组织中FSHR、LHR 基因mRNA的表达(P<0.05);与白炽灯光对照相比,LED红光有提高卵巢组织中FSHR、LHR 基因mRNA表达水平的趋势,但差异不显著(P>0.05)。在原始卵泡(PrF)阶段与初级卵泡(PF)阶段,不同LED光色处理的卵泡数量差异不显著(P>0.05);与原始卵泡(PrF)及初级卵泡(PF)相比,由于卵泡逐级闭锁,次级卵泡(SF)数量显著降低,不同组间开始出现差异,与LED绿光组及LED蓝光组相比,LED红光组、LED白光组及白炽灯光对照组次级卵泡(SF)数量显著增加(P<0.05);由于卵泡进一步闭锁,与原始卵泡(PrF)、初级卵泡(PF)以及次级卵泡(SF)相比,三级卵泡(TF)数量显著减少,不同组间三级卵泡(TF)数量也呈现不同差异,与LED绿光组、LED蓝光组及白炽灯光对照组相比,LED红光组三级卵泡(TF)数量显著增加(P<0.05),但与LED白光组相比,差异不显著(P>0.05)。与LED绿光相比,LED红光及白炽灯光能显著抑制母兔卵巢FoxO1 mRNA表达(P<0.05);与LED白光及LED蓝光相比,LED红光及白炽灯光有抑制母兔卵巢FoxO1 mRNA表达的趋势,但差异不显著(P>0.05)。Bcl-2/Bax mRNA两个凋亡相关基因在兔卵巢中均有表达,但两者的相对表达量显著差异(P<0.05),Bax mRNA表达量显著高于Bcl-2 mRNA表达量;不同LED光色对兔卵巢Bcl-2/Bax mRNA表达的影响也存在差异,与LED绿光、蓝光及白炽灯光相比,LED红光显著提高Bcl-2 mRNA的表达量(P<0.05),但与LED白光相比差异不显著(P>0.05),Bcl-2基因表达量受到不同光色的影响呈现红光>白光>白炽灯光>绿光>蓝光;不同LED光色对Bax mRNA表达的影响呈现绿光>蓝光>白光>白炽灯光>红光,但各组间差异不显著(P>0.05)。总之,规模兔场短日照季节周期化繁殖生产中,每周连续3 d于晚间18∶00至次日凌晨6∶00之间,采用100 lx的LED红光进行补光,可提高母兔同期发情率;HPG轴上繁殖调控关键受体基因转录水平、卵巢次级卵泡和三级卵泡数量以及与卵泡闭锁和氧化应激相关基因转录水平均受到LED不同光色的影响。
关键词:LED光;兔;繁殖性能;分子调控
中图分类号:S829.14+6文献标识码:A文章编号:1000-4440(2020)01-0136-11
Abstract:To explore the molecular mechanism of different LED light colors affecting the reproductive efficiency of female rabbits, three hundred female rabbits reared in a single cage were randomly divided into five groups for different LED light colors treatments. LED red light (660 nm), LED green light (540 nm), LED blue light (480 nm) and LED white light (400-760 nm) were projected downwards at 60 cm above the rabbit cage. The control group was incandescent lamp (400-1 050 nm). Female rabbits received the treatment with supplementary light three times a week, the duration was 12 hours (12D∶12L), the pre-experiment was seven days, and the standard test was 90 days. The light intensity of LED lamp and incandescent lamp was set as 100 lx. Compared with incandescent lamp group and LED white light group, the estrus rate of female rabbits in LED red light group increased by 20.89 percentage points and 10.51 percentage points(P<0.05). Compared with LED green light group and LED blue light group, the estrus rate of female rabbits in LED red light group increased by 4.66 percentage points and 7.33 percentage points(P>0.05). The number of large red follicles in the ovaries of the female rabbits in the LED red light group increased, but there was no significant difference between the experimental groups (P>0.05). Compared with incondescent light, LED white light, LED green light and LED blue light, LED red light could promote the mRNA expression of GnRHR in the pituitary gland of female rabbits, but the difference was not significant (P>0.05). Compared with LED white light, LED green light and LED blue light, LED red light significantly increased the expression of FSHR and LHR in ovarian tissue (P<0.05). Compared with the incandescent light, LED red light could increase mRNA expression of FSHR and LHR gene in ovarian tissue, but the difference was not significant (P>0.05). In the primordial follicles (PrF) stage and the primary follicles (PF) stage, the effect of different LED light colors on the number of follicles was not significant(P>0.05). Compared with PrF and PF, the number of secondary follicles (SF) was significantly reduced due to the stepwise blocking of follicles, and differences began to appear between different groups. Compared with that in LED green light group and the LED blue light group, the number of SF in LED red light group, LED white light group and incandescent light group increased significantly (P<0.05). Due to further atresia of follicles, the number of tertiary follicles (TF) decreased significantly. Compared with that in the LED green light group, LED blue light group and incandescent light group, the number of TF in the LED red light group was significantly increased (P<0.05), but there was no significant difference in the number of TF between the LED red light group and the LED white light group(P>0.05). Compared with the LED green light, LED red light and incandescent light could significantly inhibit mRNA expression of FoxO1 in female rabbit ovaries (P<0.05). Compared with LED white light and LED blue light, LED red light and incandescent light could inhibit mRNA expression of FoxO1 in female rabbit ovary, but the difference was not significant (P>0.05). Both apoptosis-related genes of Bcl-2/Bax mRNA were expressed in rabbit ovary, but the relative expression levels of them were significantly different (P<0.05). The expression level of Bax mRNA was significantly higher than that of Bcl-2 mRNA. The effects of different LED light colors on Bcl-2/Bax mRNA expression in rabbit ovaries were also different. Compared with the LED green light, LED blue light and incandescent light, LED red light significantly increased the expression of Bcl-2 mRNA (P<0.05), but there was no significant difference in the expression of Bcl-2 mRNA between the LED red light group and LED white light group(P>0.05). The expression of Bcl-2 gene was affected by different light colors, showing a trend of red light> white light> incandescent light> green light> blue light. The effect of LED light color on Bax mRNA expression showed a trend of green light> blue light> white light> incandescent light> red light, but there was no significant difference (P>0.05). In conclusion, during the periodical breeding and production of large-scale rabbit farms in short-day season, the estrus rate of female rabbits can be improved by using 100 lx LED red light to supplement light from 18∶00 in the evening to 6∶00 in the morning of the next day for three days in a week. The transcription levels of key receptor genes on the HPG axis for regulation of reproduction, the number of secondary follicles, the number of tertiary follicles, and the transcription levels of genes related to follicular atresia and oxidative stress were affected by different LED light colors.
Key words:LED light color;rabbit;reproductive performance;molecular regulation
母兔周期化繁殖效率是规模兔场生产水平和经济效益的重要指标,生产中常采用外源性激素如孕马血清促性腺激素(PMSG)、促卵泡素(FSH)调整母兔生理周期,以实现同期发情,提高周期化繁殖效率。但生产实践中对母兔群体进行同期发情处理时存在激素耐受现象,母兔常出现对性激素响应的同期发情效果差异大、整齐度差、长期使用后群体受孕率低的现象。其原因为PMSG是一种大分子量抗原,长期使用后母兔血清中PMSG抗体滴度增加,再次使用PMSG时极易发生抗原-抗体中和反应,以致PMSG效价降低,效果不显著[1]。目前规模化兔场已普遍采用周期化生产模式,但母兔在短日照季节发情及配种效率低下,季节性乏情现象明显,目前只能依靠人工激素维持周期化生产。如能采用人工光照诱导干预兔自身繁殖节律,则可实现无人工激素的周期化繁殖模式,显著降低人工辅助配种的劳动强度和经济成本,同时,与采用激素调控母兔同期发情相比,光照调控可避免母兔激素耐受效应,提高母兔利用效率。本研究从分子水平阐述单色光调控兔性腺激素节律性分泌的分子机制,为提高规模兔场周期化繁殖效率以及规模兔场周期化生产中光需求参数的设定提供参考依据。
1材料与方法
1.1试验设计
1.1.1试验动物与试验时间试验母兔选自江苏省农业科学院六合动物科学基地试验兔场(实验兔生产许可证号:SCXK(苏)2017-0008)。选择体质量接近的300只未配种纯种新西兰后备母兔,随机平均分成5组,每组3个重复,每个重复20只。5组分别为白炽灯对照组、白光组、红光组、绿光组、蓝光组。选择秋季日照时长变短后开始正式试验,通过每周进行3次补光,观察不同光色对母兔同期发情等繁殖性能的影响。预试验时间为1周(2017年9月14日-9月21日),正式试验时间为3个月(2017年9月22日-12月21日)。试验兔舍空调温度设定为24 ℃,并通过机械通风方式,保证空气质量。排除温度、声音、气味刺激等干扰,确保LED光色为唯一变量。
1.1.2光照方案每个光照处理组均采用双层遮阳窗帘进行分隔,单独隔间。母兔采取不锈钢单笼饲养,兔笼规格为60 cm×60 cm×60 cm。兔笼上方60 cm处分别安装LED灯带,向下投射LED红光(660 nm)、LED绿光(540 nm)、LED蓝光(480 nm)和LED白光(400~760 nm),对照为白炽灯光组(400~1 050 nm),每隔2 m安装1个灯泡,安装高度为兔笼上方2.5 m(通过Testo-540照度仪监测,此高度下光照度与LED灯带下的光照度一致)。正式试验时间段内,母兔接受LED光照的次数为每周3次,即正式试验中每个星期内周五至周日下午18∶00至次日上午6∶00,时长为12 h。其他时间打开遮阳窗帘,不进行任何补光处理。LED灯带与白炽灯采用动态光照控制系统(软著登字第1551136号)控制,光照度均设置为100 lx。光照试验开始时,每周通过Testo-540照度仪监测光照度,保证各组间光照度一致。光照试验开始后0.5 h及灯光关闭前0.5 h,通过控制系统实现0~100 lx和100~0 lx的光照度过渡期,以避免突然开关灯导致的试验兔应激。
1.1.3样本采集正式试验时间段内,分别在第14 d、28 d、42 d、56 d、78 d、90 d的23∶30-24∶30进行耳缘静脉采血,每次每组分别选择5只母兔(已在白天标记发情的母兔),每只试验兔采集10 ml。采集的血清样本进行MLT浓度及情绪物质测定。血液静置凝固后,1 000 g离心10 min,分离血清,-20 ℃保存用于血液相关指标的测定。在LED光处理后第91 d早晨,每组选择体质量接近、处于同一生理阶段(发情中后期外阴颜色为深红或紫红)的5只母兔进行屠宰。屠宰时取出母兔右侧卵巢放入4%多聚甲醛磷酸缓冲液(0.1 mol/L,pH7.4)中,固定48 h后制成常规石蜡切片进行观察。同时迅速取下每组母兔视网膜、SCN核、松果体、下丘脑、垂体、卵巢分别进行液氮保存,以待后期试验。实验兔的屠宰执行江苏省农业科学院动物福利和伦理委员会的规定。
1.1.4饲养管理与营养水平试验期内母兔均为自由采食和饮水,其他饲养管理按常规进行。水、饲料、饲养人员、饲养管理各组均一致。按照NRC兔营养标准配置饲料并制成全价颗粒饲料,饲料配方见表1。
1.2卵巢HE染色及卵泡数量统计
1.2.1卵巢HE染色具体方法:(1)将右侧卵巢切块,大小约0.5 cm×0.5 cm×0.5 cm,放入甲醛溶液中固定24 h,甲醛溶液的体积为卵巢组织块体积的20倍。将组织块依次放入70%、80%、95%、95%的乙醇中2 h,之后分别放入100%、100%的乙醇中1.5 h,进行脱水處理;(2)为了使组织块透明,将组织块放入溶液I(二甲苯∶无水乙醇=1∶1,体积比)中30 min,之后依次放入二甲苯I和II中,每次30 min。组织块依次放入二甲苯∶石蜡=1∶1(体积比)的混合液中30 min,之后放入石蜡I中1 h,紧接着放入石蜡II中1 h,制成蜡块;(3)使用切片机将组织块切成厚度为5 μm的薄片,将制备好的切片放入65 ℃的烤箱中烘烤2 h,将切片上的蜡融化;(4)将烤好的切片分别在二甲苯I中5 min、二甲苯II中5 min和二甲苯III中5 min进行处理;(5)把切片按下面顺序进行处理:100%乙醇I中5 min,100%乙醇II中5 min,95%乙醇I中5 min, 95%乙醇II中5 min,80%乙醇中5 min,75%乙醇中5 min;(6)苏木素染色15 min后,自来水冲洗;(7)使用盐酸酒精(0.5%)进行分色10 s,自来水冲洗片刻;(8)浸染伊红(1%)3~5 min,水洗片刻;(9)把切片按下面顺序进行处理:在85%的乙醇中5 min,95%的乙醇中5 min和100%的乙醇中I和II中各5 min,最后将切片依次放入二甲苯I和II中各5 min;(10)采用中性树胶将切片进行封片。
1.2.2卵泡数量统计所用的切片为5 μm的连续切片,每间隔9张(即第10张)取1张切片统计卵泡的数目,每张切片对5个切面进行统计。在光镜下面对原始、初级、次级以及有腔卵泡进行统计。为了避免对同一卵泡的重复计数,只统计含有卵母细胞核的卵泡。原始卵泡的判定标准:初级卵母细胞的周围包围着一层扁平的上皮细胞即原始卵泡;初级卵泡的判定标准:初级卵母细胞周围包绕着一层柱状或立方型卵泡上皮细胞即初级卵泡;次级卵泡的判定标准:卵母细胞周围包绕着多层卵泡上皮细胞或颗粒细胞即次级卵泡;三级卵泡的判定标准:颗粒细胞间开始出现空隙,形成卵泡腔;成熟卵泡的判定标准:卵泡不断发育,卵泡液增多,体积增大,逐渐突出于卵巢表面。
1.3基因相对表达量测定
1.3.1Trizol 法提取组织总RNA将匀浆器、1.5 ml指形管、Trizol试剂(Invitrogen公司产品)预先置于冰上预冷,在匀浆器内加入2 ml Trizol,将研钵和研棒用烤过的锡箔纸包好,向研钵内加入液氮和组织样。将研细的样品放入匀浆器内,冰浴中快速匀浆,匀浆液倒入2 ml指形管,置于冰上。每管加入0.4 ml氯仿,振荡20 s,室温放置2~3 min,4 ℃、12 000 r/min离心15 min。取上清液于另一指形管中,加入1 ml异丙醇,轻轻混匀,室温放置10 min,4 ℃、12 000 r/min离心10min,弃掉上清液,将管倒置于纸巾上,尽量吸干其中的液体,加入1 ml 75%乙醇洗涤沉淀,4 ℃、7 500 r/min离心10 min,弃掉乙醇,空气干燥5~10 min,加50 μl DEPC处理水(或用去离子甲酰胺)溶解RNA沉淀,并将指形管置于冰上。取2 μl RNA水溶液于另一指形管中,加入98 μl DEPC处理水中,100倍稀释,测OD260,检测RNA浓度。用DEPC处理水溶解的RNA样品于-70 ℃保存,用去离子甲酰胺溶解的RNA样-20 ℃保存。
1.3.2总RNA电泳检测电泳槽用RNA清洗液浸泡4~5 h,再用DEPC处理过的水反复冲洗数次后倒入1×TBE待用。琼脂糖凝胶用1×TBE配制。在10 μl上样缓冲液中加入1 μl以上组织总RNA。65 ℃变性10 min后立即放入冰水中2~3 min,点样于琼脂糖凝胶中5 V/cm电泳,电泳至溴酚蓝泳到达凝胶的2/3处,取下凝胶,EB染色,紫外灯下检测电泳结果。
1.3.3反转录(RT)取一PCR管,加入含2 μg RNA的溶液,加入1 μl Oligo (dT) 18,用无核糖核酸酶的去离子水补足至12 μl。于PCR仪上70 ℃保温5 min,迅速置冰上冷却。依次加入4 μl 5×buffer、2 μl 10 mmol/L dNTPs、1 μl RNA inhibitor(Invitrogen公司产品)和1 μl 反转录酶(Invitrogen公司产品),用枪抽吸混匀,于PCR仪上42 ℃保温60 min,结束后80 ℃保温5 min灭活反转录酶。
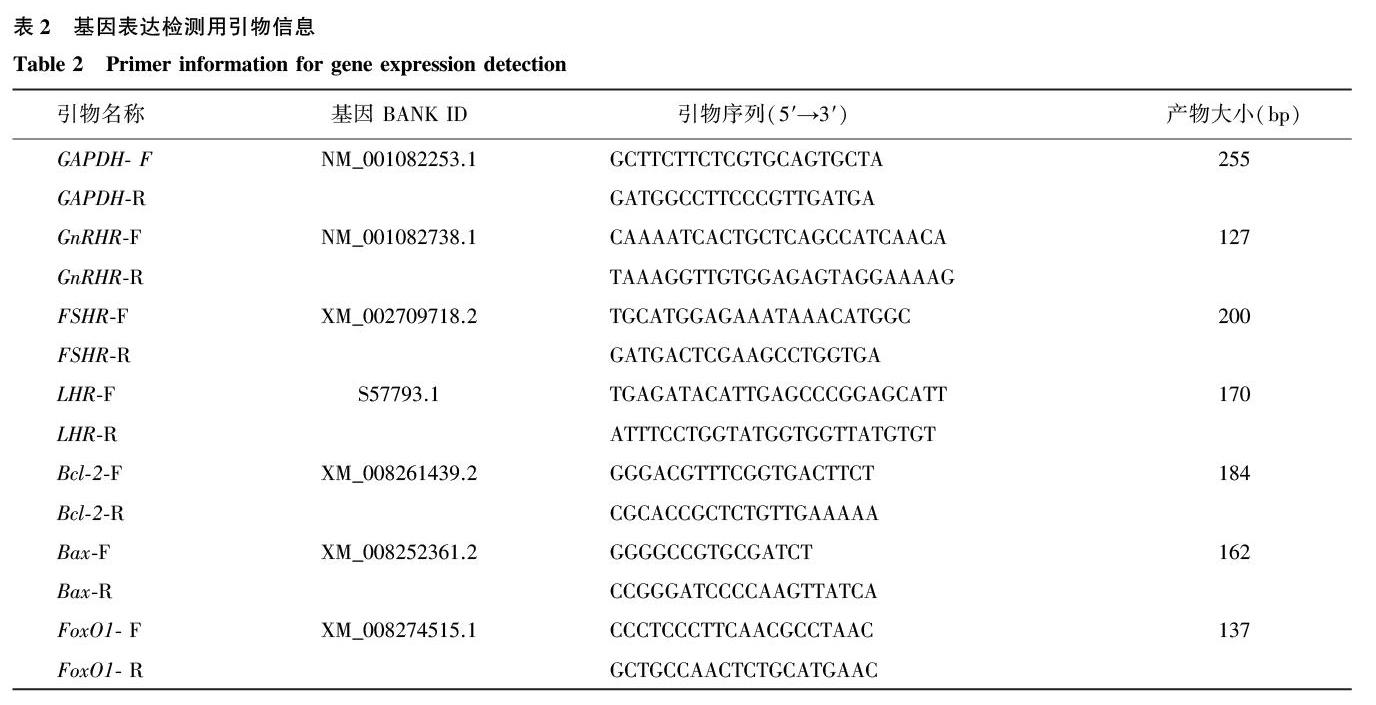
1.3.4基因表达检测用引物用于基因表达检测的引物及其序列见表2。
1.3.5荧光定量PCR(qRT-PCR)取0.2 ml PCR管,配制如下反应体系(每个反转录产物配制3管):12.5 μl 2×qPCR Mix(Invitrogen公司产品)、2.0 μl 7.5 μmol/L基因引物、2.5 μl反转录产物、8.0 μl ddH2O。将cDNA原液稀释20倍,实时荧光定量PCR检测目的基因mRNA表达。采用10.0 μl体系,即5.0 μl SYBR Green Real-time PCR Master Mix,2.0 μl超纯水,1.0 μmol/L的上游引物0.5 μl,1 μmol/L下游引物0.5 μl,2.0 μl稀释后的cDNA。PCR反应条件为95 ℃预变性3 min;95 ℃变性30 s,62 ℃退火22 s,72 ℃延伸20 s,共24个循环。每个样品重复1次。每板做一个用高压三蒸水和不加cDNA阴性模版的扩增,以检测水和试剂是否被污染。
1.4数据统计分析
同期发情率统计:在LED光处理后的第14 d、28 d、42 d、56 d、78 d、90 d上午,采用外阴检查法对母兔进行同期发情效果鉴定。当外阴出现大红或深红色则为发情,登记并统计发情母兔占该组实验兔的比率即为同期发情率。试验数据用Excel 2016软件进行处理和作图,用SPSS 18.0软件One-Way ANOVA法对试验数据进行方差分析。
卵巢红色大卵泡数量统计:在LED光处理后的第91 d早晨进行屠宰,每组取5只实验兔统计两侧卵巢上红色大卵泡数量,数据用Excel 2016软件进行处理和作图,用SPSS 18.0软件One-Way ANOVA法对试验数据进行方差分析。
實时荧光定量数据统计分析:用2-△△Ct法进行,将目的基因的Ct值,用内参基因mRNA的Ct值进行校对,计算目的基因的相对量。计算公式为:△△Ct=(CtTarget- CtTBP)X-(CtTarget-CtTBP)CK,式中,以对照组的目的基因CtTarget和内标基因CtTBP差值的平均值为参照进行计算,X表示任意一个样本。通过上述公式计算每一个样本目标基因的表达量,通过TBP校正计算相对于对照组的目的基因表达倍数。
2结果
2.1不同LED光色对母兔同期发情率的影响
母兔同期发情率统计结果显示,LED白光组、LED红光组、LED绿光组、LED蓝光组和白炽灯光对照组同期发情率分别为75.13%±9.66%、85.64%±6.59%、80.98%±8.34%、78.31%±7.23%、64.75%±5.33%。LED红光组母兔同期发情率与白炽灯光对照组及LED白光组相比,分别提高20.89个百分点和10.51个百分点,差异显著(P<0.05);LED红光组母兔同期发情率与绿光组及蓝光组相比,分别提高4.66个百分点和和7.33个百分点,差异不显著(P>0.05)。
2.2不同LED光色对母兔红色大卵泡数量的影响
不同LED光色对母兔卵巢上红色大卵泡数量的影响如图1所示,LED红光组母兔卵巢上红色大卵泡数量有增加趋势,但各个试验组间卵巢上红色大卵泡数量差异不显著(P>0.05)。
2.3不同LED光色对母兔垂体GnRHR基因、卵巢FSHR、LHR基因 mRNA表达的影响
与白织灯光、LED白光、LED绿光、LED蓝光相比,LED红光能促进母兔垂体GnRHR mRNA表达,但差异不显著(P>0.05);与LED白光、LED绿光、LED蓝光相比,LED红光显著提高了卵巢组织中FSHR、LHR 基因mRNA的表达(P<0.05);与白炽灯光相比,LED红光有提高卵巢组织中FSHR、LHR 基因mRNA表达水平的趋势,但差异不显著(P>0.05)(图2)。
2.4不同LED光色对母兔卵巢各级卵泡数量的影响
卵巢组织结构由生殖上皮白膜、皮质和髓质3部分组成。卵巢表面被覆了扁平或立方型的生殖上皮细胞,下为白膜结构,由结缔组织构成(图3)。卵巢外周是HE染色较深的皮质部位,其中包含不同阶段的卵泡、结缔组织和血管,其中原始卵泡(PrF)及初级卵泡(PF)分布于皮质表层。原始卵泡呈圆形或卵圆形,由1个卵母细胞和1层扁平卵泡细胞构成,分布于皮质层外周,呈聚集状,数量密集;初级卵泡比原始卵泡体积大,形态呈柱状或立方状,层次明显,直径大小差异较大,多分散分布于皮质表层,数量较多;次级卵泡(SF)的卵泡膜逐渐增厚且内外层清晰,腔内颗粒细胞逐渐增加,排列呈疏松状,腔内的卵母细胞被颗粒细胞紧密包围,形成完整的透明带,多分布于皮质中层,由于卵泡逐级闭锁,数量与原始卵泡(PrF)及初级卵泡(PF)相比数量显著降低;当卵泡腔里的卵泡液逐渐增多时,次级卵泡开始向三级卵泡过渡,随着卵泡腔的增大和卵泡液的增多,卵泡直径显著增大,卵母细胞开始向卵泡一侧靠近,与紧密包裹的颗粒细胞共同形成卵丘,三级卵泡(TF)突出于皮质表层,由于卵泡进一步闭锁,数量显著减少。试验中未观察到完整结构的成熟卵泡,只见到排卵后的巨大卵泡腔。
原始卵泡分布于皮质层外周,呈聚集状分布(图4)。在原始卵泡(PrF)阶段与初级卵泡(PF)阶段,不同LED光色对其数量的影响差异不显著(P>0.05);次级卵泡(SF)数量与原始卵泡(PrF)及初级卵泡(PF)相比,由于卵泡逐级闭锁,数量显著降低,不同组间开始出现差异,与LED绿光组及LED蓝光组相比,LED红光组、LED白光组及白炽灯光对照组次级卵泡(SF)数量显著增加(P<0.05);由于卵泡进一步闭锁,与原始卵泡(PrF)、初级卵泡(PF)以及次级卵泡(SF)相比,三级卵泡(TF)数量显著减少,不同组间三级卵泡(TF)数量也呈现不同差异,与LED绿光组、LED蓝光组及白炽灯光对照组相比,LED红光组三级卵泡(TF)数量显著增加(P<0.05),但与LED白光组相比,差异不显著(P>0.05)。
2.5不同光色对母兔卵泡凋亡基因FoxO1 mRNA表达的影响
不同LED光色对母兔卵泡凋亡基因FoxO1 mRNA表达影响如图5所示。与LED绿光相比,LED红光及白炽灯光能显著抑制母兔卵巢FoxO1 mRNA表达(P<0.05);与LED白光及LED蓝光相比,LED红光及白炽灯光有抑制母兔卵巢FoxO1 mRNA表达的趋势,但差异不显著(P>0.05)。
2.6Bcl-2/Bax mRNA表达模式及不同LED光色对母兔卵巢Bcl-2/Bax mRNA表达的影响
图6显示,Bcl-2、 Bax 2个凋亡相关基因在兔卵巢中均有表達,但两者的表达量有显著差异(P<0.05),Bax mRNA表达量显著高于Bcl-2 mRNA表达量。不同LED光色对兔卵巢Bcl-2/Bax mRNA表达的影响也存在差异,与LED绿光、蓝光及白炽灯光相比,LED红光显著提高Bcl-2 mRNA的表达量(P<0.05),但与LED白光相比,差异不显著(P>0.05),Bcl-2基因的表达量受到不同光色的影响呈现红光>白光>白炽灯光>绿光>蓝光;不同LED光色对Bax mRNA的表达影响呈现绿光>蓝光>白光>白炽灯光>红光,但各组间差异不显著(P>0.05)。
3讨论
3.1不同LED光色对母兔同期发情及红色大卵泡数量的影响
哺乳动物中,繁殖周期的级联起源从促性腺激素释放激素(GnRH)节律性释放开始[2]。发情前期,GnRH分泌进入垂体门脉引起垂体节律性释放促卵泡素(FSH)以及促黄体素(LH),引发发情及诱导排卵。Nakao等[3]、Anand等[4]、Takahashi[5]研究认为,要触发HPG通道,以下2种输入类型是必不可少的:(1)卵泡成熟过程中雌二醇反馈调节;(2)光信号通过颅内核心分子昼夜振荡器形成的反馈回路,调节松果体褪黑激素(MLT)分泌,进而影响GnRH脉冲式分泌调节下游生殖轴一系列的反应。Renstrm等[6]、Lee等[7]、Herm等[8]研究结果显示,机体内分泌系统的节律性变化受光信息等环境因素控制,如褪黑激素(MLT)等松果体激素可经血液循环和脑脊髓液扩散至丘脑下部,节律性抑制GnRH的分泌。在此基础上,曹静等[9]采用单一光谱证实,MLT影响鸡下丘脑GnRH的表达是通过调控颅内钟基因Clock/Cry1的表达实现的。但董锡文等[10]的研究结果提示,由于禽类与哺乳动物在光信号接受上存在差异性,兔是否也具有这一调控通路仍未知。就家兔而言,如何利用光信息调节其自身繁殖节律,从而实现无人工激素的周期化繁殖模式,关键在于如何控制下丘脑GnRH分泌引起垂体FSH、LH节律性释放,诱发母兔发情。
目前,与单色光对禽类繁殖性能影响的研究相比[11-14],光色对兔繁殖性能影响的研究相对较少,更多集中在光周期对兔繁殖性能的影响。如Szendr等[15]发现在规模兔场中授精前8 d将8 h光照变为16 h光照能有效增加母兔发情率,但其并未进一步研究光的颜色对母兔繁殖的影响。朱慈根等[16]选择健康新西兰母兔,随机分成3组进行不同补光时间对母兔繁殖性能的影响试验,结果显示人工授精前3 d与人工授精前7 d补光处理差异不显著,与激素处理相比,均能显著提高母兔同期发情率、发情配种数及怀孕数。宋亚鹏[17]选用1 120只伊拉母兔,随机分为2组,在人工授精前进行7 d的光照处理,每天16 h,试验结果表明,LED白光组同期发情率、受胎率与节能灯组相比差异显著,其试验结果证实了白色LED灯光对提高母兔繁殖性能的效果要优于白炽灯光,说明LED光源控制母兔同期发情技术完全能应用到商品肉兔的繁殖生产中。李士栋 [18]对不同补光方式的哺乳期母兔生产性能进行了比较,发现在夏季使用LED灯补光的母兔受胎率和产仔率比使用节能灯的母兔高5%。崔双保等[19]的试验结果显示,LED光源显著提高了母兔同期发情率、受胎率、产仔数、活仔数、出生窝质量、断奶窝质量。Kalaba等[20]发现红光对母兔繁殖性能及仔兔生长性能的影响显著,与自然光相比,红光试验组母兔产仔数、产仔率、仔兔初生质量、存活率、断奶质量、断奶个数及断奶存活率最高,并且红光组母兔血浆中褪黑激素(MLT)、促卵泡素(FSH)、雌二醇(E2)浓度最高,表明红光可增加母兔繁殖性能及仔兔存活率。本试验采用LED光处理母兔,观察不同光源及不同LED光色对母兔同期发情的影响,试验结果与上述类似,发现LED红光组母兔同期发情率与白炽灯光对照组及LED白光组相比,分别提高20.89个百分点和10.51个百分点,差异显著;LED红光组母兔同期发情率与绿光组和蓝光组相比,分别提高4.66个百分点和和7.33个百分点,但差异不显著。综上所述,LED光可用在规模兔场周期化繁殖生产模式中,并且能够提高母兔的繁殖性能。
本研究发现,各LED光处理对母兔红色大卵泡数量影响不显著,推测母兔卵巢上红色大卵泡继续发育可能会排卵,因此初步将其定义为可能的排卵点。LED红光组母兔红色大卵泡数量比朱华萍等[21]报道的正常母兔排卵点数量(8.08±1.51)略高。
3.2不同LED光色对母兔垂体GnRHR及卵巢FSHR、LHR mRNA表达的影响
GnRHR、FSHR、LHR是与哺乳动物繁殖性状相关的3个重要候选基因[22-23],Ramakrishnappa 等[24]研究发现,GnRHR在下丘脑、垂体、卵巢内均有表达,并且Zerani等[25]发现在家兔卵母细胞、颗粒细胞、膜细胞和透明带内均有GnRHR特异性受体的表达。FSHR和LHR在卵泡的发育和成熟中起重要作用。Parillo等[26]研究发现,FSHR和LHR蛋白在家兔透明带上均有表达。以上研究结果表明GnRHR、FSHR、LHR基因直接参与了家兔的繁殖调控。关于不同光色对兔繁殖性能影响的研究报道较少,更多研究集中在光周期与光照度对于母兔繁殖及其相关基因的影响。张玉仙等 [27]研究发现,长光照处理组母兔下丘脑GnRHR mRNA的表达显著增强,下丘脑所分泌的GnRHR是调控哺乳动物生殖活动的核心,表明不同光周期能显著调控家兔的繁殖过程,此外在母兔垂体中长光照组母兔GnRHR mRNA 表达量较短光照组和对照组显著升高。孙良展[28]研究发现,在60 lx、80 lx、100 lx这3种光照度下,母兔卵巢中FSHR、LHR基因的表达没有显著差异,其原因可能是60 lx、80 lx、100 lx这3组的光照度差异不大,导致基因表达结果无显著性差异。本研究發现LED红光能促进母兔垂体GnRHR mRNA表达,但差异不显著,但与LED白光、绿光、蓝光相比,LED红光处理显著提高了卵巢组织中FSHR、LHR 基因mRNA的表达,表明不同LED光色对母兔垂体GnRHR,卵巢FSHR、LHR 基因mRNA表达的影响存在差异。在兔生产中正确利用这一差异性,将能显著提高家兔规模化生产时周期化繁殖的效率。
3.3不同LED光色对母兔卵泡闭锁及卵巢FoxO1 mRNA表达的影响
长期以来研究人员围绕遗传及环境因素引起的雌性哺乳动物卵泡闭锁进行了大量的研究。早期研究主要围绕卵泡闭锁形态以及生化特征变化上,包括不同程度闭锁卵泡的外部形态及组织学变化、激素及生长因子等水平变化[29-31]。随着对卵泡闭锁研究的深入,研究人员发现卵泡闭锁伴随着卵泡颗粒细胞大量调亡过程,其中由环境因素导致的氧化应激诱导卵泡颗粒细胞凋亡的研究已取得重要进展。刘红林等 [32]认为叉头盒转录因子O1(FoxO1)是氧化应激诱导卵泡颗粒细胞凋亡的关键调控因子。Shen [33]发现机体氧化应激反应导致小鼠卵泡颗粒细胞内活性氧(ROS)水平显著升高,小鼠卵泡颗粒细胞凋亡和卵泡闭锁率同时上升。上述结果表明,FoxO1基因可能在氧化应激引起小鼠卵泡颗粒细胞凋亡中发挥重要作用。
本研究发现,与LED红光及白炽灯光相比,LED绿光能显著促进母兔卵巢FoxO1 mRNA表达。红光波长较其他可见光长,其携带的能量少,照射视网膜后引起的氧化应激作用没有其他波长的光强烈,因此氧化应激小。LED红光组FoxO1 mRNA转录水平显著低于其他组,推测不同LED光处理后母兔机体氧化应激反应存在差异,这种差异的产生可能是由于不同波长LED光所携带的光子能量不同而引起的,不同能量LED光在进入视网膜后引起的生物学效率不一致,导致母兔卵巢中FoxO1 mRNA表达水平呈现差异,而这一差异产生的结果直接体现在各组间有腔卵泡(三级卵泡)的数量上。与LED绿光组、LED蓝光组及白炽灯光对照组相比,LED红光组显著提高了三级卵泡(TF)数量,说明LED红光在降低三级卵泡闭锁进程中起一定作用。
總之,环境因素可作为诱导机体产生氧化应激反应的原因,诱导动物有腔卵泡闭锁,氧化应激通过增加转录因子FoxO1在卵泡颗粒细胞中的表达,诱导下游细胞凋亡相关基因的表达,从而导致雌性动物颗粒细胞的凋亡与卵泡闭锁。
3.4不同LED光色对母兔卵巢Bcl-2/Bax mRNA表达的影响
Dharma等[34]、Wasowska等[35]、Van Cruchten等[36]、Liu等[37]的研究结果显示,整个发情周期中,雌性动物卵巢上卵泡动态发育-闭锁过程与颗粒细胞凋亡密切相关。Zhu等[38]和Zhang等[39]的研究结果显示,影响颗粒细胞凋亡的因素主要有2大类:内源的促凋亡或抗凋亡因子的调控以及外在的凋亡诱发因素(如激素刺激等),其中线粒体内源凋亡发生在卵母细胞周围的颗粒细胞中,占整个凋亡过程的主导地位,此过程由Bcl-2蛋白家族介导。Bcl-2原癌基因是与细胞凋亡极为相关的关键基因之一,它能阻断细胞凋亡的最后通路,而其家族成员Bax基因则具有与Bcl-2基因相反的功能,可加速细胞凋亡[40]。基因敲除试验证明,Bax能引起卵泡闭锁,敲除Bax基因后卵泡数量增加[41],说明生殖细胞凋亡受到抑制;此外,敲除Bcl-2基因的小鼠体内初级卵泡数量减少[42],若Bcl-2过度表达,则可引起出生后小鼠体内卵泡数目提高[43],说明Bcl-2有促进细胞存活的作用。Figueroa等[44]和Vartak等[45]研究发现,Bax和Bcl-2的比值是细胞凋亡开关,二者的平衡决定了卵泡发育或是闭锁。Bax/Bcl-2比值较高时,形成异源二聚体,抑制凋亡;Bax/Bcl-2比值较低时,或者当Bax/Bcl-2之间的作用被破坏时,形成Bax/Bax同源二聚体,诱导凋亡。
本研究选择这2个明确功能的基因,观察母兔在不同LED光色下两者表达特征,结果显示,这2个凋亡相关基因在不同光处理的兔卵巢中均有表达,但两者的相对表达量差异显著,并呈现相反特征,表明兔卵泡发育过程中,其闭锁过程占主导,绝大多数卵泡在发育过程中都经历闭锁过程,极少部分形成了优势卵泡。此外,不同LED光色对兔卵巢Bcl-2/Bax mRNA表达的影响也存在差异,与其他组相比,LED红光组Bax mRNA表达显著降低。这一结果也提示LED红光在降低兔卵巢次级卵泡向三级有腔卵泡发育过程中的闭锁程度上起到一定作用,验证了卵巢中Bcl-2和Bax基因直接参与母兔发情过程中卵泡的发育与闭锁,而优势卵泡在发育过程中,由于FSH的作用,卵泡中颗粒细胞大量合成和分泌雌激素,血液中雌激素水平不断升高,并且Bax/Bcl-2比值不断变化,推测不同LED光色对Bax/Bcl-2 mRNA表达影响的差异可能直接促进了母兔发情状态的转变。
参考文献:
[1]QUINTELA L, PEA A, BARRIO M, et al. Reproductive performance of multiparous rabbit lactating does: effect of lighting programs and PMSG use[J]. Reproduction Nutrition Development, 2001, 41(3): 247-257.
[2]BROWN-GRANT K, MURRAY M A F, RAISMAN G, et al. Reproductive function in male and female rats following extra-and intra-hypothalamic lesions[J]. Proceedings of the Royal Society of London Series B Biological Sciences, 1977, 198(1132): 267-278.
[3]NAKAO R, YAMAMOTO S, HORIKAWA K, et al. Atypical expression of circadian clock genes in denervated mouse skeletal muscle[J]. Chronobiology International, 2015, 32(4): 486-496.
[4]ANAND S N, MAYWOOD E S, CHESHAM J E, et al. Distinct and separable roles for endogenous CRY1 and CRY2 within the circadian molecular clockwork of the suprachiasmatic nucleus, as revealed by the Fbxl3Afh mutation[J]. Journal of Neuroscience, 2013, 33(17): 7145-7153.
[5]TAKAHASHI J S. Molecular components of the circadian clock in mammals[J]. Diabetes, Obesity and Metabolism, 2015, 17: 6-11.
[6]RENSTRM F, KOIVULA R W, VARGA T V, et al. Season-dependent associations of circadian rhythm-regulating loci (CRY1, CRY2 and MTNR1B) and glucose homeostasis: the GLACIER Study[J]. Diabetologia, 2015, 58(5): 997-1005.
[7]LEE Y, JANG A R, FRANCEY L J, et al. KPNB1 mediates PER/CRY nuclear translocation and circadian clock function[J]. Elife, 2015, 4: e08647.
[8]HERM G, MUSCHER-BANSE A S, BREVES G, et al. Renal mechanisms of calcium homeostasis in sheep and goats[J]. Journal of Animal Science, 2015, 93(4): 1608-1621.
[9]曹靜,陈耀星,王子旭,等. 单色光对肉鸡生长发育的影响[J]. 中国农业科学, 2007, 40(10): 2350-2354.
[10]董锡文,高德臣. 家兔脑垂体和松果体血脑屏障的研究[J]. 动物学杂志, 1998, 33(3): 6-7.
[11]VAN DER POL C W, VAN ROOVERT-REIJRINK I A M, MAATJENS C M, et al. Light-dark rhythms during incubation of broiler chicken embryos and their effects on embryonic and post hatch leg bone development[J]. PLoS ONE, 2019, 14(1): e0210886.
[12]HIEKE A S C, HUBERT S M, ATHREY G. Circadian disruption and divergent microbiota acquisition under extended photoperiod regimens in chicken[J]. PeerJ, 2019, 7: e6592.
[13]DROZDOVA A, OKULIAROVA M, ZEMAN M. The effect of different wavelengths of light during incubation on the development of rhythmic pineal melatonin biosynthesis in chick embryos[J]. Animal, 2019,8(13): 1635-1640.
[14]ALEJEVSKI F, SAINT-CHARLES A, MICHARD-VANHE C, et al. The HisCl1 histamine receptor acts in photoreceptors to synchronize Drosophila behavioral rhythms with light-dark cycles[J]. Nature Communications, 2019, 10(1): 252-262.
[15]SZENDR Z, GERENCSR Z, MCNITT J I, et al. Effect of lighting on rabbits and its role in rabbit production: A review[J]. Livestock Science, 2016, 183: 12-18.
[16]朱慈根,潘孝青,邵乐,等. 不同补光时间对母兔繁殖性能的影响[J]. 中国养兔, 2017 (5): 33-34.
[17]宋亚鹏. LED 光源, 节能灯对母兔同期发情影响[J]. 中国动物保健, 2014, 16(12): 70-71.
[18]李士栋. 光照刺激, 光源和季节对母兔繁殖性能的影响[J]. 中国养兔, 2016(4):18-20.
[19]崔双保,常军强. LED 光源对獭兔母兔繁殖性能的影响[J]. 中国畜禽种业, 2016(4): 56-57.
[20]KALABA Z M, ABDEL-KHALEK A E. Reproductive performance of rabbit does and productivity of their kits in response to colour of light[J]. Asian J Anim Vet Adv, 2011, 6: 814-822.
[21]朱华萍,李六金,屈红莉,等. 重复手术法收集超数排卵后的家兔卵母细胞[J]. 中国养兔, 2003 (3): 17-20.
[22]周虚.动物繁殖学[M]. 北京:科学出版社, 2015.
[23]杨利国.动物繁殖学[M]. 北京:中国农业出版社, 2010.
[24]RAMAKRISHNAPPA N, RAJAMAHENDRAN R, LIN Y M, et al. GnRH in non-hypothalamic reproductive tissues[J]. Animal Reproduction Science, 2005, 88(1/2):95-113.
[25]ZERANI M, PARILLO F, BRECCHIA G, et al. Expression of type I GNRH receptor and in vivo and in vitro GNRH-I effects in corpora lutea of pseudopregnant rabbits[J]. Journal of Endocrinology, 2010, 207(3): 289-301.
[26]PARILLO F, CATONE G, GOBBETTI A, et al. Cell localization of ACTH, dopamine, and GnRH receptors and PPARγ in bovine corpora lutea during diestrus[J]. Acta Scientiae Veterinariae, 2013, 41(1): 1-5.
[27]张玉仙,王文利,原展航,等. 不同光照周期对雌兔卵泡发育和下丘脑-垂体-卵巢轴的影响[J].畜牧兽医学报, 2019, 50(8): 1694-1701.
[28]孙良展.日粮能量水平和光照强度对獭兔繁殖性能和体况的影响[D].泰安:山东农业大学,2015.
[29]GUTHRIE H D, COOPER B S, WELCH G R, et al. Atresia in follicles grown after ovulation in the pig: measurement of increased apoptosis in granulosa cells and reduced follicular fluid estradiol-17β[J]. Biology of Reproduction, 1995, 52(4): 920-927.
[30]MILLER A T, PICTON H M, CRAIGON J, et al. Follicle dynamics and aromatase activity in high-ovulating Meishan sows and in Large-White hybrid contemporaries[J]. Biology of Reproduction, 1998, 58(6): 1372-1378.
[31]MANABE N, IMAI Y, OHNO H, et al. Apoptosis occurs in granulosa cells but not cumulus cells in the atretic antral follicles in pig ovaries[J]. Experientia, 1996, 52(7): 647-651.
[32]刘红林,孟繁星. 氧化应激对动物有腔卵泡闭锁的影响及机制[J]. 南京农业大学学报, 2019, 42(1): 6-13.
[33]SHEN M, LIN F, ZHANG J, et al. Involvement of the up-regulated FoxO1 expression in follicular granulosa cell apoptosis induced by oxidative stress[J]. Journal of Biological Chemistry, 2012, 287(31): 25727-25740.
[34]DHARMA S J, KHOLKUTE S D, NANDEDKAR T D. Apoptosis in endometrium of mouse during estrous cycle[J]. NISCAIR Online Periodicals Repository,2001,39(3):218-222.
[35]WASOWSKA B, LUDKIEWICZ B, STEFANCZYK-KRZYMOWSKA S, et al. Apoptotic cell death in the porcine endometrium during the oestrous cycle[J]. Acta Veterinaria Hungarica, 2001, 49(1): 71-79.
[36]VAN CRUCHTEN S, VAN DEN BROECK W, DUCHATEAU L, et al. Apoptosis in the canine endometrium during the estrous cycle[J]. Theriogenology, 2003, 60(9): 1595-1608.
[37]LIU Y, WANG Y L, HE S, et al. Protective effects of resveratrol against mancozeb induced apoptosis damage in mouse oocytes[J]. Oncotarget, 2017, 8(4): 6233-6245.
[38]ZHU C C, ZHANG Y, DUAN X, et al. Toxic effects of HT-2 toxin on mouse oocytes and its possible mechanisms[J]. Archives of Toxicology, 2016, 90(6): 1495-1505.
[39]ZHANG Z, QIN P, LIU Y, et al. Alleviation of ischaemia-reperfusion injury by endogenous estrogen involves maintaining Bcl-2 expression via the ERα signalling pathway[J]. Brain Research, 2017, 1661: 15-23.
[40]REED J C. Double identity for proteins of the Bcl-2 family[J]. Nature, 1997, 387:773-776.
[41]PEREZ G I, ROBLES R, KNUDSON C M, et al. Prolongation of ovarian lifespan into advanced chronological age by Bax-deficiency[J]. Nature Genetics, 1999, 21(2): 200-203.
[42]RATTS V S, FLAWS J A, KOLP R, et al. Ablation of bcl-2 gene expression decreases the numbers of oocytes and primordial follicles established in the post-natal female mouse gonad[J]. Endocrinology, 1995, 136(8): 3665-3668.
[43]FLAWS J A, HIRSHFIELD A N, HEWITT J A, et al. Effect of bcl-2 on the primordial follicle endowment in the mouse ovary[J]. Biology of Reproduction, 2001, 64(4): 1153-1159.
[44]FIGUEROA F, MOTTA A, ACOSTA M, et al. Role of macrophage secretions on rat polycystic ovary: its effect on apoptosis[J]. Reproduction, 2015, 150(5): 437-448.
[45]VARTAK S V, IYER D, SANTHOSHKUMAR T R, et al. Novel BCL2 inhibitor, Disarib induces apoptosis by disruption of BCL2-BAK interaction[J]. Biochemical pharmacology, 2017, 131: 16-28.
(責任编辑:张震林)
