外源赤霉素诱导矮生山茶恨天高植株生长的转录组分析
2020-03-27王江英朱朋波汤雪燕孙明伟葛金涛赵统利李纪元惠林冲邵小斌
王江英 朱朋波 汤雪燕 孙明伟 葛金涛 赵统利 李纪元 惠林冲 邵小斌


摘要:对0 mg/L、800 mg/L赤霉素处理的矮生山茶恨天高叶片、茎段和茎尖进行了Illumina HiSeq高通量转录组测序,共获得476 635个Unigenes,其中181 115(38.00%)個Unigenes获得了注释;差异基因分析发现了43 624个差异基因,其中包括43 295个特异的和329个共同的差异基因;GO和KEGG富集分析结果显示,恨天高叶片增大、茎段伸长及茎尖生长与糖代谢、苯丙烷生物合成代谢相关;茎尖生长还与植物激素信号传导和二萜生物合成有关。通过赤霉素处理后恨天高叶片、茎段、茎尖转录组分析发现,茎尖组织中参与赤霉素生物合成的KAO、GA20ox、GA3ox和GA2ox基因表达量发生变化,赤霉素信号传导过程中DELLA蛋白调控以及赤霉素和生长素、细胞分裂素等其他激素间的互作促进恨天高植株生长。
关键词:矮生恨天高;赤霉素;转录组;差异表达基因
中图分类号:S685.14文献标识码:A文章编号:1000-4440(2020)01-0047-10
Abstract:Illumina HiSeq high-throughput sequencing was performed on the leaves, stem segments and shoot tips of Camellia reticulata Hentiangao treated with mg/L0 and 800 mg/L gibberellin, respectively. A total of 476 635 unigenes were obtained, and 181 115 (38.00%) of them were annotated. In addition, 43 624 differentially expressed genes (DEGs), including 43 295 unique and 329 common, were identified. GO and KEGG enrichment analysis results showed that leaf enlargement, stem elongation and shoot tip growth were related to glucose metabdism and phenylpropanoid biosynthesis. Furthermore, many DEGs in shoot tip growth were involved in plant hormone signal transduction and diterpenoid biosynthesis. According to the transcriptome analysis, three factors were found to promote the growth of Hentiangao. The first was the expression changes of KAO, GA20ox, GA3ox and GA2ox genes involved in gibberellin biosynthesis in shoot tips. The second was the regulation of DELLA protein in gibberellin signal transduction. The third was the interaction of gibberellin with auxin, cytokinin and other hormones.
Key words:Camellia reticulata Hentiangao;gibberellin;transcriptome;differentially expressed genes
赤霉素(Gibberellins,GAs),二萜类植物激素,主要促进植株的营养生长,包括节间的延长、根的伸长和叶的扩展[1-3]。在赤霉素合成途径中,萜烯合成酶TPSs、细胞色素P450s和GA氧化酶(GAoxs)将前体牻牛儿牻牛儿焦磷酸GGDP催化成活性赤霉素,其中贝壳杉烯酸氧化酶(KAO)属于细胞色素P450,催化赤霉素合成前期阶段。GA氧化酶包括GA2ox、GA20ox和GA3ox,是赤霉素合成和代谢后期阶段的主要调控点,将非活性赤霉素催化成活性赤霉素[4-7]。前期研究发现,多种植物的KAO突变能诱导植株矮化,如水稻d35突变体[8]。梨矮化砧木中KAO表达量低于乔化和半矮化的品种[9]。相对于早期合成酶,后期生物合成酶易受植物生长发育和环境因素调节,这些酶在生物活性赤霉素水平的调控中起着关键作用。GA20ox和GA3ox过量表达后提高活性赤霉素的含量,加快植物生长,节间伸长,GA20ox和GA3ox功能缺失会引起植株矮化[10-11]。GA2ox的作用则是降低活性赤霉素的水平[11-12]。
赤霉素信号传导途径中,DELLA蛋白作为植物生长抑制剂可被活性赤霉素抵消[13],赤霉素信号启动DELLA蛋白的降解,调控赤霉素反应基因的表达,从而促进植物的生长,所以DELLA蛋白对植物的生长发育起负反馈调节[14-16]。目前DELLA基因在拟南芥[17]、葡萄[18]、草莓[19]和甘蓝型油菜[20]等植物中陆续被克隆及分析,为植物矮化性状研究提供依据。
恨天高(Camellia reticulata Hentiangao)是云南山茶最珍贵的品种之一,其株形矮小,生长缓慢,花瓣平展,完全重瓣,形姿优美,叶浓花艳,具有极高的观赏价值[21]。随着城市的快速发展,矮生和盆栽木本花卉植物在园林绿化、居室美化等方面有着重要作用。通过转录组分析挖掘高效调控恨天高株高的关键基因,为培育微型山茶新品种奠定基础。
本研究以云南山茶矮生品种恨天高为材料,利用转录组测序分析恨天高植株矮生与赤霉素合成代谢和信号传导间的关系,以期获得调控植物株高的重要基因,并揭示其矮生机制。
1材料與方法
1.1试验材料
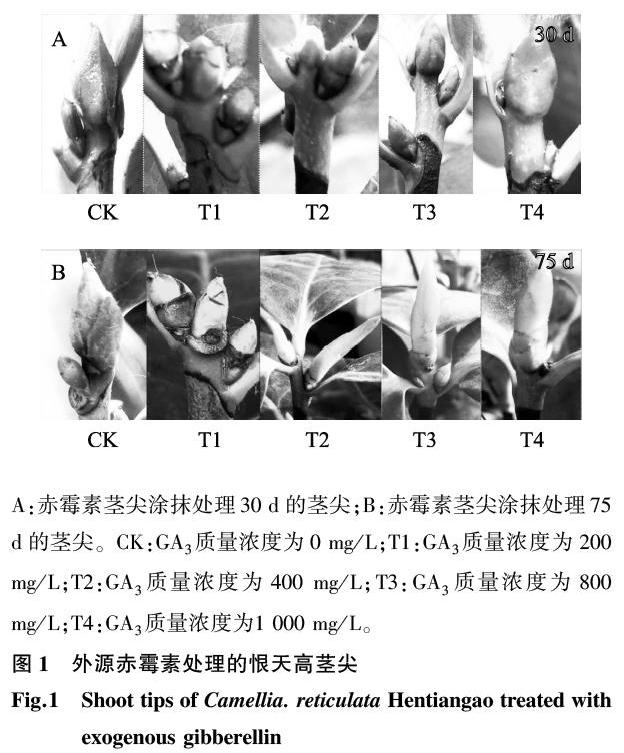
以立地条件相同且生长年龄相近的恨天高山茶(Camellia reticulate Hentiangao)为材料,利用不同质量浓度梯度[0 mg/L(CK)、200 mg/L(T1)、400 mg/L(T2)、800 mg/L(T3)和1 000 mg/L(T4)]的赤霉素(GA3)进行茎尖涂抹。75 d后采集各质量浓度处理后的叶片、茎段及茎尖组织进行液氮速冻,-80 ℃保存备用。
1.2茎尖和叶片总RNA提取
参照北京艾德莱生物科技有限公司RN53-EASYspin Plus植物试剂盒说明书提取样品总RNA。利用1%的琼脂糖凝胶电泳和Nanodrop 2000分光光度计检测RNA完整度、浓度、A260/280、A260/230及核酸峰度是否正常,之后再经Agilent bioanalyzer 2100进行RNA质量检测。
1.3赤霉素诱导恨天高植株生长的质量浓度筛选
分别利用0 mg/L、200 mg/L、400 mg/L、800 mg/L和1 000 mg/L的GA3涂抹5年生恨天高植株茎尖,每2 d涂1次,每个质量浓度处理3株,每株分别处理5个茎尖,30 d和75 d后分别测量茎尖生长值。
1.4文库构建和转录组测序
恨天高叶片、茎段和茎尖总RNA质量分别检测合格后,利用NEBNext Poly(A) mRNA Magnetic Isolation Module进行mRNA捕获,利用NEBNext Ultra RNA Library Prep Kit for Illumina和Beckman Agencourt AMPure XP beads分别进行文库构建和文库纯化,利用TruSeq PE Cluster Kit V4完成cBOT自动成簇,最后通过TrSeq SBS Kit v4-HS进行HiSeq测序。以上文库构建和转录组测序均由苏州金唯智生物科技有限公司完成。
1.5生物信息学分析
对测序结果原始图像数据利用软件Bcl2fastq(v2.17.1.14)进行图像碱基识别,初步质量分析后得到原始测序数据。测序数据质量评估采用FastQC(v0.10.1)进行分析,使用Cutadapt(version1.9.1)对测序原始数据去除接头以及低质量序列等,得到后续信息分析用的高质量有效序列。采用Trinity对样品数据从头组装,组装结果通过序列聚类进行进一步序列拼接和去冗余处理,得到长的非冗余Unigenes,利用TransDecoder软件进行ORF分析[22]。
Unigenes表达计算使用RSEM软件,该软件使用FPKM(Fragment per kilo bases per million reads)方法计算基因表达量。利用EdgeR软件进行基因差异表达分析,以变化2倍以上、Pvalue≤0.05且错误发现率(FDR)<0.01为差异表达基因筛选标准。最后基于差异表达基因进行GO功能注释、KEGG代谢通路分析和COG功能注释。
1.6实时荧光定量PCR验证
利用实时荧光定量PCR验证转录组测序的准确性,挑选5个差异表达基因设计引物,以山茶18S RNA为内标基因(所用引物见表1),生物学试验重复3次。运用2-△△Ct计算方法求得差异基因的表达量。
2结果与分析
2.1外施赤霉素促进恨天高茎尖伸长
选择立地条件相同、生长状态良好且一致的三年生恨天高(Camellia reticulate Hentiangao)幼苗为材料(图1A),利用不同质量浓度梯度的GA3进行茎尖涂抹(图1B)。研究结果发现,GA3处理30 d后,对照组和试验组茎尖长度差异显著(P<0.05)(图1C),其中CK的茎尖长度最短,T1、T2、T4处理分别是CK的1.23倍、1.58倍和1.92倍,T3为CK的2.53倍(图2A);GA3处理75 d后,对照组和试验组茎尖长度差异显著(P<0.05)(图1D),其中CK茎尖长度依旧最短,其次是T1处理和T2处理,为CK的1.59倍和1.93倍,而T4处理和T3处理分别为CK的2.27倍和3.61倍(图2B)。比较发现,对照组和试验组在2次测量的45 d间隔期,CK的茎尖少许伸长,试验组除了T1处理长势变化不明显外,T2、T3、T4处理长势旺,尤其T3处理(图2C)。由此可以推测,外源GA3能诱导恨天高山茶的植株生长,并且随着外施质量浓度的增高(0 mg/L、200 mg/L、400 mg/L),茎尖生长值也随之增加,当质量浓度达800 mg/L时,茎尖生长最快,然而质量浓度达1 000 mg/L时,茎尖增加幅度却有所下降,从而表明800 mg/L是诱导恨天高山茶植株生长的较佳质量浓度。
2.2转录组序列组装及Unigene注释分析
利用最佳赤霉素诱导质量浓度800 mg/L处理恨天高茎尖组织,0 mg/L的GA3处理作对照,75 d后采集叶片、茎段、茎尖进行转录组测序,其中叶片和茎段分别取2组样品进行测试,茎尖只取1组样品进行测试。
使用软件Cutadapt对测序原始数据去除接头以及低质量序列,获得后续信息分析用的过滤数据。恨天高3种组织及对照共8个文库产生了411 464 870条序列,约60.96 Gb转录组数据,Unigene平均长度为147.38~148.61 bp,G+C碱基含量为44.58%~46.84%(表2)。由表3可以看出,转录组数据经组装产生了43 073 816个重叠群,476 635个Unigenes,平均长度为497.69 bp。在所有Unigenes序列中,序列长度小于500 bp的占71.60%。Unigene注释分析显示有181 115条Unigenes获得注释,占Unigenes总数的38.00%,其中获得注释较多的数据库分别是Nr注释172 121条(36.11%),COG注释74 120条(15.55%),Swissport注释106 818条(22.41%)和KEGG注释25 837条(5.42%)(图3)。
2.3差异表达基因筛选及分析
将Clean data比对到Unigene上,利用bowtie2软件进行短reads比对,结果显示,唯一比对到参考基因的reads数量在2.5×107~3.6×107,用于基因表达分析。在叶片、茎段和茎尖3种组织中,发现了特异的和共同的差异表达基因,共发现43 624个差异表达基因,包括43 295个特异差异表达基因和329个共同差异表达基因(图4A)。
CK1(对照叶片样品)与L1(800 mg/L外源赤霉素处理后叶片样品1)比较中发现27 424个差异表达基因,其中上调表达基因16 495个,下调表达基因10 929个;CK1与L2(800 mg/L外源赤霉素处理后叶片样品2)比较中发现23 450个差异表达基因,其中上调表达基因12 956个,下调表达基因10 494个;CK2(对照茎段样品)与SS1(800 mg/L外源赤霉素处理后茎段样品1)比较中发现20 773个差异表达基因,其中上调表达基因11 168个,下调表达基因9 605个;CK2与SS2(800 mg/L外源赤霉素处理后茎段样品2)比较中发现21 040个差异表达基因,其中上调表达基因11 706个,下调表达基因9 334个;CK3(对照茎尖样品)与ST1(800 mg/L外源赤霉素处理后茎尖样品)比较中发现4 256个差异表达基因,其中上调表达基因1 734个,下调表达基因2 522个(图4B)。在5组比较中,CK3与ST1比较获得的上调和下调基因数量均最低,可能是由于茎尖组织相对于叶片和茎段而言,与植株伸长生长更为密切,获得的差异表达基因控制植株生长的作用更大。
根据FPKM值将8个文库中的基因表达水平分为极高、高、中、低和极低5类(图4C),其中差异表达基因中占比例最大的是极低表达基因,FPKM为0~1,占比例最小的是极高表达基因,FPKM>60。另外,在叶片、茎段和茎尖等组织中检测到共同差异表达基因329个,通过层次聚类分析将其划分成A、B 2个簇(图4D)。
2.4差异基因GO富集分析
通过GO富集分析对差异表达基因进行生物学功能研究,在错误发现率FDR<0.01时,43个GO条目富集在CK1/L1,42个GO条目富集在CK1/L2,39个GO条目富集在CK2/SS1,39个GO条目富集在CK2/SS2,37個GO条目富集在CK3/ST1。基于所有GO富集分析,确定37个共同GO类别和8个差异GO类别,在37个共同GO条目中,催化活性、结合、代谢过程、细胞过程、细胞组分和细胞器是富集基因最多的GO类别。在8个差异GO类别中,CK3/ST1无分子功能调节剂富集;鸟苷酸交换因子活性显著富集在CK1/L1和CK1/L2;CK2/SS1和CK2/SS2无细胞外基质部分和细胞外区域部分富集;CK3/ST1无类核和细胞外基质富集;转运状态显著富集在CK1/L1;CK3/ST1无生物附着富集。由此可以看出,在外源赤霉素处理下叶片、茎段和茎尖组织中的GO类别存在差异,诱导植株生长。
2.5差异基因KEGG富集分析
KEGG富集分析结果显示,分别有30、30、18、14和27条代谢途径富集在CK1/L1、CK1/L2、CK2/SS1、CK2/SS2和CK3/ST1,显著富集的则为5、4、5、4和5条代谢途径(图5)。苯丙烷生物合成、戊糖和葡萄糖醛酸相互转化过程是共同显著富集的代谢途径(图5),倍半萜和三萜生物合成富集在CK1/L1、CK1/L2和CK2/SS2(图5A,图5B,图5D),细胞色素P450对外源化合物代谢的影响、药物代谢-细胞色素P450只富集在CK1/L1(图5A),糖酵解/糖异生只富集在CK1/L2(图5B),光合-天线蛋白、油菜素内酯生物合成只富集在CK2/SS1(图5C),玉米素生物合成只富集在CK2/SS1和CK2/SS2(图5C、图5D),CK3/ST1显著富集植物激素信号转导、二萜生物合成和类胡萝卜素生物合成(图5E)。由此可以看出,CK3/ST1中所富集的植物激素信号转导和二萜生物合成两条途径与恨天高植株生长关系较为密切,其他途径则间接调控植株生长。
KEGG富集研究结果显示,CK3/ST1所富集的植物激素信号转导途径中色氨酸代谢CH3、SAUR下调表达,玉米素生物合成AHP上调表达、A-ARR下调表达,二萜生物合成途径DELLA下调表达,油菜素内酯合成TCH4上调表达、BSK和CYCD3下调表达(图6A)。表明,植株生长受多种激素互作的影响,本研究中可以认为二萜生物合成途径对植株生长首先起作用。KEGG富集结果显示,二萜生物赤霉素生物合成途径中KAO上调表达、GA20ox和GA3ox下调表达、GA2ox既有上调也有下调表达(CK1/L1上调,CK3/ST1下调)(图6B)。说明,二萜生物合成途径中DELLA、KAO、GA20ox、GA3ox和GA2ox调控恨天高植株生长。
2.6转录组的实时荧光定量PCR验证
挑选5个差异表达基因,利用实时荧光定量PCR进行对照组和试验组(800 mg/L GA3处理75 d)茎尖基因的表达量测定。结果显示,实时荧光定量PCR(qPCR)与转录组测序(RNA-Seq)的结果在基因表达量变化幅度上具有一定差异,但基因的表达趋势是一致的(图7)。利用SPSS Pearson对qPCR和RNA-Seq进行双变量相关性分析,结果显示5个差异表达基因的qPCR和RNA-Seq在P<0.01水平(双侧)上显著相关,相关系数为0.978(表4)。由此可以说明,转录组测序获得的基因差异表达结果可靠。
3讨论
恨天高作为天然矮生资源,是山茶矮化育种的优良亲本材料。本研究采用Illumina HiSeq高通量技术对0 mg/L和800 mg/L GA3处理75 d的叶片、茎段和茎尖组织进行测序,组装得到的181 115条Unigenes获得了注释。通过实时荧光定量PCR检验,qPCR和RNA-Seq结果显著相关,因此,本研究转录组测序结果是可靠的。
GO富集分析发现,大量差异表达基因在催化活性、结合、代谢过程、细胞过程、细胞组分和细胞器等类别中显著富集,在差异条目中,叶片、茎段和茎尖所富集的类别存在差异,可能是外源赤霉素对不同组织的诱导作用存在差异,也可能是组织本身存在差异所造成。KEGG通路分析发现,叶片、茎段和茎尖显著富集的代谢途径不完全相同,其中苯丙烷生物合成、戊糖和葡萄糖醛酸相互转化过程是共同显著富集的代谢途径。苯丙烷生物合成是植物最重要的次生代谢途径之一[23],而戊糖和葡萄糖醛酸相互转化也是糖代谢的重要环节,参与植物多种发育过程[24],表明在外源赤霉素诱导过程中,苯丙烷生物合成、戊糖和葡萄糖醛酸相互转化途径中差异基因对恨天高植株生长具有重要作用。然而,相比于其他4组,CK3/ST1显著富集的植物激素信号转导、二萜生物合成和类胡萝卜素生物合成途径中差异表达基因直接参与调控恨天高植株生长。
本研究中,茎尖组织中外源赤霉素诱导的差异表达基因包括赤霉素信号传导途径中的DELLA,赤霉素生物合成途径中的KAO、GA20ox、GA3ox和GA2ox等基因,DELLA、GA20ox、GA3ox和GA2ox下调表达,KAO上调表达。研究结果表明,DELLA蛋白在赤霉素信号传导途径中起中心开关的作用,对赤霉素诱导的反应非常灵敏,赤霉素处理5~10 min后蛋白水平显著下降[25-26],本研究中外源赤霉素的诱导信号传递给DELLA蛋白,DELLA蛋白呈下調表达,从而诱导下游赤霉素代谢基因如KAO的上调表达。
高等植物赤霉素水平通过正反馈和负反馈来实现调节体内激素的平衡。当体内活性赤霉素水平低时,拟南芥GA20ox1、GA20ox2、GA20ox3和GA3ox1的表达量均显著提高,外施GA3后,其表达量又显著降低[27-28]。本研究中,外施赤霉素后恨天高茎尖中GA20ox、GA3ox也呈下调表达。当活性赤霉素水平增加时,拟南芥GA2ox表达量上调[29],在植物中过量表达GA2ox能诱导植株矮化,本研究中通过差异基因表达水平测定发现,茎尖中GA2ox下调表达,叶片中GA2ox呈上调表达,可能由于茎尖在外源赤霉素的诱导下,快速生长,积累较多的活性赤霉素,当活性赤霉素由茎尖传输到叶片时,则诱导叶片中的GA2ox上调表达,以抑制植株进一步生长,起到反馈调节作用。
另外,我们挑选了DELLA、GA20ox、GA3ox、GA2ox和KAO 5个差异表达基因进行了实时荧光定量PCR验证,在茎尖组织中,实时荧光定量PCR(qPCR)与转录组测序(RNA-Seq)结果一致,DELLA、GA20ox、GA3ox、GA2ox呈下调表达,KAO上调表达。由此可以推测,800 mg/L外源赤霉素茎尖涂抹处理后,赤霉素质量浓度升高,DELLA蛋白接受信号呈下调表达,诱导下游KAO上调表达,GA20ox、GA3ox、GA2ox呈下调表达,多个基因相互作用,促进植株生长,当体内赤霉素质量浓度积累到一定程度时,GA2ox则反馈调节抑制植株继续生长。外源赤霉素诱导植株生长的机理,以本文为基础,后续还需要进一步深入研究。
本研究利用高通量转录组测序技术建立矮生山茶恨天高赤霉素诱导前后叶片、茎段和茎尖转录组数据库,分析比较3种组织在外源赤霉素处理后生物反应途径的差异,发现相对于叶片和茎段,茎尖对植株生长影响较大,进一步筛选出茎尖组织中的差异表达基因,为研究恨天高矮生机制以及培育矮生山茶品种提供基础。
参考文献:
[1]RICHAEDS D E, KING K E, AIT-ALI T, et al. How gibberellin regulates plant growth and development: a molecular genetic analysis of gibberellin signaling [J]. Annual Review of Plant Biology, 2001, 52: 67-88.
[2]张旭红,孙美玉,李靖锐,等. 东方百合‘索邦GA20ox的克隆及表达分析[J]. 园艺学报, 2019, 46(1): 74-86.
[3]YAMAGUCHI S. Gibberellin metabolism and its regulation [J]. Annual Review of Plant Biology, 2008, 59: 225-251.
[4]DAVIDSON S E, ELLIOTT R C, HELLIWELL C A, et al. The pea gene NA encodes ent-kaurenoic acid oxidase [J]. Plant Physiology, 2003, 131(1): 335-344.
[5]LANGE T, HEDDEN P, GRAEBE J E. Expression cloning of a gibberellin 20-oxidase, a multifunctional enzyme involved in gibberellin biosynthesis [J]. Proceedings of the National Academy of Sciences, 1994, 91(18): 8522-8566.
[6]APPLEFORD N E J, LENTON J R. Gibberellins and leaf expansion in near-isogenic wheat lines containing Rht1 and Rhe3 dwarfing alleles [J]. Planta, 1991, 183(2): 229-236.
[7]COLES J P, PHILLIPS A L, CROKER S J, et al. Modification of gibberellin production and plant development in Arabidopsis by sense and antisense expression of gibberellin 20-oxidase genes [J]. The Plant Journal, 1999, 17(5): 547-563.
[8]SAKAMOTO T, MIURA K, ITOH H, et al. An overview of gibberellin metabolism enzyme genes and their related mutants in rice [J]. Plant Physiology, 2004, 134(4): 1642-1653.
[9]欧春青,姜淑苓,王斐,等. 梨贝壳杉烯酸氧化酶基因PcKAO1的克隆与表达分析[J]. 园艺学报, 2013, 40(5): 849-858.
[10]WANG J Y, WU B, LI J Y, et al. Overexpression and silent expression of CrGA20ox1 from Camellia reticulate ‘Hentiangao and its effect on morphological alterations in transgenic tobacco plants [J]. Plant Breeding, 2018, 9(3): 1-9.
[11]HUANG Y, WANG X, GE S, et al. Divergence and adaptive evolution of the gibberellin oxidase genes in plants [J]. BMC Evolutionary Biology, 2015, 15: 207-221.
[12]THOMAS S G, PHILLIPS A L, HEDDEN P. Molecular cloning and functional expression of gibberellin 2-oxidases, multifunctional enzymes involved in gibberellin deactivation [J]. Proceedings of the National Academy of Sciences, 1999, 96(8): 4698-4703.
[13]李巧峽,张丽,王玉,等. 赤霉素调控植物开花及器官发育的研究进展[J]. 中国细胞生物学学报, 2019, 41(4): 746-758.
[14]WILLIGE B C, GHOSH S, NILL C, et al. The DELLA domain of GA INSENSITIVE mediates the interaction with the GA INSENSITIVE DWARF1A gibberellin receptor of Arabidopsis [J]. The Plant Cell, 2007, 19(4): 1209-1220.
[15]DILL A, THOMAS S G, HU J, et al. The Arabidopsis F-Box protein SLEEPY1 targets gibberellin signaling repressors for gibberellin-induced degradation [J]. The Plant Cell, 2004, 16(6): 1392-1405.
[16]SUN T P. Gibberellin-GID1-DELLA: a pivotal regulatory module for plant growth and development [J]. Plant Physiology, 2010, 154(2): 567-570.
[17]CHEN J H, CHENG T L, WANG P K, et al. Genome-wide bioinformatics analysis of DELLA-family proteins from plants [J]. Plant Omics, 2013, 6(3): 201-207.
[18]张文颖,王晨,朱旭东. 葡萄全基因组DELLA 蛋白基因家族鉴定及其应答外源赤霉素调控葡萄果实发育的特征[J]. 中国农业科学, 2018, 51(16): 3130-3146.
[19]LI W J, ZHANG J X, SUN H Y. FveRGA1, encoding a DELLA protein, negatively regulates runner production in Fragaria vesca [J]. Planta, 2018, 247(4): 941-951.
[20]贾永鹏,李开祥,昝领兄,等. 甘蓝型油菜全基因组DELLA蛋白基因家族的鉴定和表达分析[J]. 中国油料作物学报, 2019, 41(3): 360-368.
[21]管开云.中国茶花图鉴[M]. 杭州: 浙江科学技术出版社, 2014:53-54.
[22]张恩亮,马玲玲,杨如同,等. IBA诱导楸树嫩枝扦插不定根发育的转录组分析[J]. 林业科学, 2018, 54(5): 48-61.
[23]WANG Y, WEATHERS P J. Sugar proportionately affect artemisinin production [J]. Plant Cell Report, 2007, 26(7): 1073-1081.
[24]HU Y L, GAI Y, YIN L, et al. Crystal structures of a Populus tomentosa 4- coumarate: CoA ligase shed light on its enzymatic mechanisms[J]. Plant Cell, 2010,22(9):3093-3104.
[25]ITOH H, UEGUCHI-TANAKA M, SATO Y, et al. The gibberellin signaling pathway is regulated by the appearance and disappearance of SLENDER RICE1 in nuclei [J]. Plant Cell, 2002, 14(1): 57-70.
[26]TYLER L, THOMAS S G, HU J, et al. DELLA proteins and gibberellin regulated seed germination and floral development in Arabidopsis [J]. Plant Physiology, 2004, 135(2): 1008-1019.
[27]MITCHUM M G, YAMAGUCHI S, HANADA A, et al. Distinct and overlapping roles of two gibberellin 3-oxidases in Arabidopsis development [J]. The Plant Journal, 2006, 45(5): 804-818.
[28]RIEU I, RUIZ-RIVERO O, FERNANDEZ-GARCIA N, et al. The gibberellin biosynthetic genes At GA20ox1 and At GA20ox2 act, partially redundantly, to promote growth and development throughout the Arabidopsis life cycle [J]. The Plant Journal, 2008, 53(3): 488-504.
[29]RIEU I, THOMAS S, POWERS S J, et al. Genetic analysis reveals that C19-GA 2-oxidation is a major gibberellin inactivation pathway in Arabidopsis [J]. Plant Cell, 2008, 20(9): 2420-2436.
(責任编辑:陈海霞)
