南粳5055及其亲本的光合特性
2020-03-27孙萌萌王莹慧汪育文陈国祥赵凌张亚东
孙萌萌 王莹慧 汪育文 陈国祥 赵凌 张亚东

摘要:为探究优良食味粳稻的光合特性,进一步挖掘南粳系列水稻光合潜力,对优良食味粳稻南粳5055及其母本武粳13和父本日本优质粳稻关东194的叶绿素荧光参数、类囊体膜蛋白组分与含量进行分析。结果显示:南粳5055在生殖生长期的叶绿素和类胡萝卜素含量、净光合速率、量子产额、光合性能指数高于关东194,略低于武粳13;南粳5055在完熟期的结实率与千粒质量接近武粳13,高于关东194;温和蓝绿胶电泳结果表明,南粳5055在孕穗期和灌浆期光系统I复合物含量较高;蛋白质免疫印迹显示南粳5055具有较高的Lhca1和Lhca2蛋白含量,而光系统II中心复合物和捕光色素II复合物等其他复合物含量均低于武粳13。说明南粳5055的光合特性在一定程度上与母本武粳13较为接近,南粳5055在孕穗期和乳熟期保持相对较高的光系统I复合物含量,且在生育后期具有高效的热耗散能力可以避免光抑制的发生,推测这可能是该品种能保持高效光合特性的物质和代谢基础。
关键词:优良食味粳稻;叶绿素荧光参数;类囊体膜蛋白复合物
中图分类号:S511.01
文献标识码:A文章编号:1000-4440(2020)01-0001-09
Abstract:In order to explore the photosynthetic characteristics and photosynthetic potentiality of Nanjing rice, the chlorophyll fluorescence parameters and the components and contents of thylakoid membrane protein of Nanjing 5055, its female parent Wujing 13 and male parent Guandong 194 were studied. The results showed that the chlorophyll content, carotenoid content, net photosynthesis rate, quantum yield and photosynthetic performance index of Nanjing 5055 were higher than those of Guandong 194 and slightly lower than those of Wujing 13 in the reproductive period. The seed setting rate and 1000-grain weight of Nanjing 5055 were higher than those of Guandong 194 and chose to those of Wujing 13 in the full stage. Blue native polyacrylamide gel electrophoresis (BN-PAGE) results showed that the contents of photosystem I complexes in Nanjing 5055 were higher at the booting and milking stages. The results of western blotting indicated that the contents of Lhca1 and Lhca2 protein in Nanjing 5055 were higher, while the contents of other complexes such as photosystem II core and light-harvesting pigment II were slightly lower than those in Wujing 13. The above results indicated that the photosynthetic performance of Nanjing 5055 was close to its female parent Wujing 13, and the contents of photosystem I complexes were higher in the booting and milk stages. Moreover, Nanjing 5055 had high heat dissipation performance to avoid light inhibition in the later growth stage, so it was speculated that those were material and metabolic basis for Nanjing 5055 to maintain high photosynthetic efficiency.
Key words:japonica rice with good taste quality;chlorophyll fluorescence parameters;thylakoid membrane protein complexes
作物產量与光合作用呈正相关关系[1-2]。因此,提高光合作用光能利用率是提高水稻产量的有效途径。南粳5055是以日本优质粳稻关东194为父本,与江苏省优质高产粳稻武粳13杂交,经数代筛选培育而成的高产优良食味粳稻,具有米质优和抗性强等特点,产量高达11.5 t/hm2,被农业部认定为超级稻[3]。已有学者对南粳5055的产量与播栽方式[4]、基蘖肥与穗肥比例[5]、盐逆境抗性[6]等进行了较多分析,但这些研究局限于通过改善作物生长的外部环境来间接影响其光合性能,且多数研究是在实验室条件下仅对水稻某一个时期进行的,对南粳5055在田间自然生长和常规管理条件下光合作用的动态变化规律缺乏深入的研究,特别是南粳5055产量形成的关键期——生殖生长期的光化学特性还有待进一步探索。
作物的光合作用与叶绿体类囊体膜的各个色素蛋白质复合物以及相关电子载体中的光能吸收、转化和电子传递过程密切相关[7]。所以围绕南粳5055叶绿体的结构和功能,特别是基于类囊体膜蛋白主要组分的含量,结合叶绿素荧光技术和类囊体膜蛋白分析技术衡量优良食味高产粳稻品种的叶片光能转化特性具有重要的意义。为此,本研究以南粳5055、武粳13(母本)与关东194(父本)为试验材料,比较分析生殖生长期内其叶绿素含量、净光合速率、荧光参数、类囊体膜色素蛋白复合物及其亚基含量的变化,并结合其完熟期的农艺性状差异,比较分析优良食味高产粳稻南粳5055与其亲本的光能利用效率差异,为进一步挖掘光合潜力,选择优质亲本资源,以及定点改良品种性状提供可靠依据。
1材料与方法
1.1试验材料
试验于2017年和2018年在南京师范大学试验基地进行。试验田前茬空闲,土壤为黏壤,肥力中等。试验材料为南粳5055、武粳13和关东194,均由江苏省农业科学院粮食作物研究所提供。5月中旬播种,6月中旬移栽,移栽密度为34 cm×14 cm,常规肥水管理。水稻生长状况良好,均能正常抽穗结实。
1.2测定项目与方法
1.2.1农艺性状调查在水稻完熟期,随机抽取各水稻品种的15个主穗,脱粒后烘干测定每穗粒数、每穗实粒数和千粒质量,计算结实率。
1.2.2叶片叶绿素和类胡萝卜素含量的测定按照Arnon[8]方法提取孕穗期、抽穗期、乳熟期、蜡熟期和完熟期剑叶上端1/3的色素,利用双光束UV/VIS spectrophotometer Cintra1010 (GBC scientist equipment,Australia)分别在470 nm、645 nm和663 nm处测定各样品色素提取液的吸光度值。叶绿素和类胡萝卜素含量的计算参照Arnon[8]和Lichtenthaler等[9]方法。试验设置3组重复,每组重复测定3次,取平均值。
1.2.3叶片净光合速率的测定晴天上午9∶30-10∶30,温度28~30 ℃,采用英国CIRAS-3便携式光合测定仪,使用红蓝光源,光量子通量密度(PPFD)为1 400 μmol/(m2·s),在孕穗期、抽穗期、乳熟期、蜡熟期和完熟期,分别测定各水稻品种剑叶上端1/3位置处的叶片净光合速率,每次随机测定15片剑叶,测定重复3次。
1.2.4叶片荧光参数测定在孕穗期、抽穗期及乳熟期,于晴天上午9∶00-10∶00,参照Strasser等[10]的方法,采用Handy PEA连续激发式荧光仪(Hansatech, UK)测定水稻剑叶上端1/3处的荧光参数。每个水稻品种每次随机测定15片剑叶,测定重复3次。叶片暗适应20 min,用Handy PEA提供的650 nm波长的800 ms饱和光[3 000 μmol/(m2·s)]激发,设备自动记录从10 μs到1 s内的高分辨率间隔荧光信号。采用专业软件PEA Plus和Biolyzer HP3获得荧光参数,用Excel 2003软件进行数据分析,Excel 2003和GraphPad Prism 6软件作图。计算PSII单位反应中心吸收的光能(ABS/RC),t=0时PSII的最大光化学效率(φPo)、t=0时PSII单位反应中心捕获的用于还原QA的能量(TRo/RC),t=0时PSII单位反应中心捕获的用于电子传递的能量(ETo/RC),单位反应中心PSI受体侧还原的电子通量(REo/RC),t=0时PSII单位反应中心耗散掉的能量(DIo/RC),t=0时PSII用于电子传递的量子产额(φEo),t=0时用于还原PSI受体侧末端电子受体的量子产额(φRo),以吸收光能为基础的性能指数(PIabs)和综合光合性能指数(PItot),计算公式参照Wang等[11]的方法。
1.2.5类囊体膜样品的制备及温和蓝绿胶电泳在孕穗期和乳熟期,称取洗净的去脉剑叶1 g,用4 ℃预冷的 STN (0.4 mol/L蔗糖、50 mmol/L pH 7.0 Tris-HCl、10 mmol/L NaCl)提取液冰浴研磨成浆,4层尼龙网过滤,200 g冷冻离心5 min,取上清液6 000 g冷冻离心12 min,沉淀用TN (50 mmol/L pH 7.6 Tris-HCl、10 mmol/L NaCl) 缓冲液悬浮5 min,6 000 g冷冻离心12 min,沉淀用B25G20 [25 mmol/L pH 7.0 BisTris-HCl, 20% (体积比) Glycerol]缓冲液悬浮6 000 g冷冻离心12 min,用B25G20缓冲液重悬沉淀得类囊体膜蛋白悬浮液。样品分别经2%和3% (质量体积比)十二烷基-β-D-麦芽糖苷(n-Dodecyl β-D-maltoside, DM)处理后进行温和蓝绿胶电泳(Blue-native polyacrylamide gel-electrophoresis, BN-PAGE),具体操作步骤参照Kügler等[12]和Shao等[13]方法。用Bio-Rad Quantity One V4.6.2对图像的蛋白质条带进行分析,试验重复3次。
1.2.6叶绿体膜蛋白的提取及免疫印迹分析在孕穗期、抽穗期及乳熟期,称取洗净的去脉水稻剑叶0.5 g于研钵中,用预冷的STN [50 mmol/L pH 7.6 Tris-HCl、5 mmol/L MgCl2、10 mmol/L NaCl, 0.4 mol/L 蔗糖, 0.1% (质量体积比) BSA]提取液将其研磨成浆,1 000 g冷冻离心6 min,取上清液,2 000 g冷冻离心8 min,沉淀经STN提取液悬浮后即为叶绿体蛋白悬浮液。叶绿体蛋白经SDS-PAGE的5%浓缩胶和12%分离胶分离后转移到PVDF膜上进行蛋白质免疫印迹(Western blot,WB)分析,光合抗体购于Agrisera公司,具体步骤参考Shen等[14]的方法。用化學发光成像仪(Tannon)检测,用Image J软件[15]采集信号,试验重复3次。
1.3数据分析
采用Excel 2003及SPSS Statistics 17.0分析数据,Excel 2003和GraphPad Prism 6软件作图。1D BN-PAGE 电泳染色后经GE Image Scanner III扫描获取图像,用Bio-Rad Quantity One V4.6.2进行分析。蛋白质免疫印迹结果用Image J软件进行图像差异分析。
2结果与分析
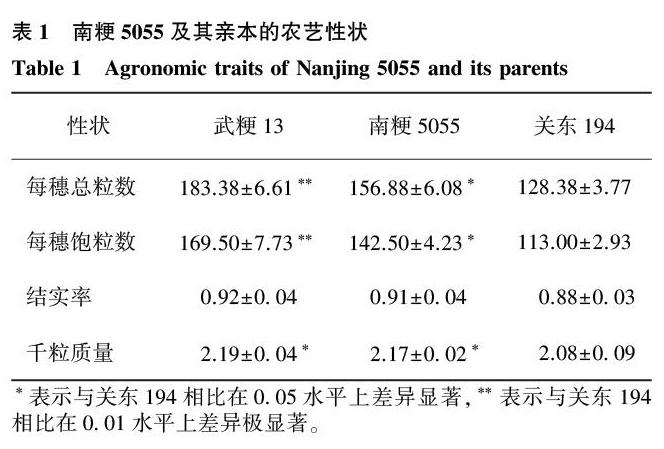
2.1南粳5055及其亲本农艺性状的差异
3个水稻品种的各农艺性状指标均呈现相同的趋势:武粳13>南粳5055>关东194(表1)。各水稻品种间每穗总粒数和每穗实粒数差异显著。千粒质量是衡量水稻产量的重要指标之一,南粳5055的千粒质量高于父本关东194,达到显著水平,与母本武粳13无显著差异。3个水稻品种的结实率不存在显著性差异。
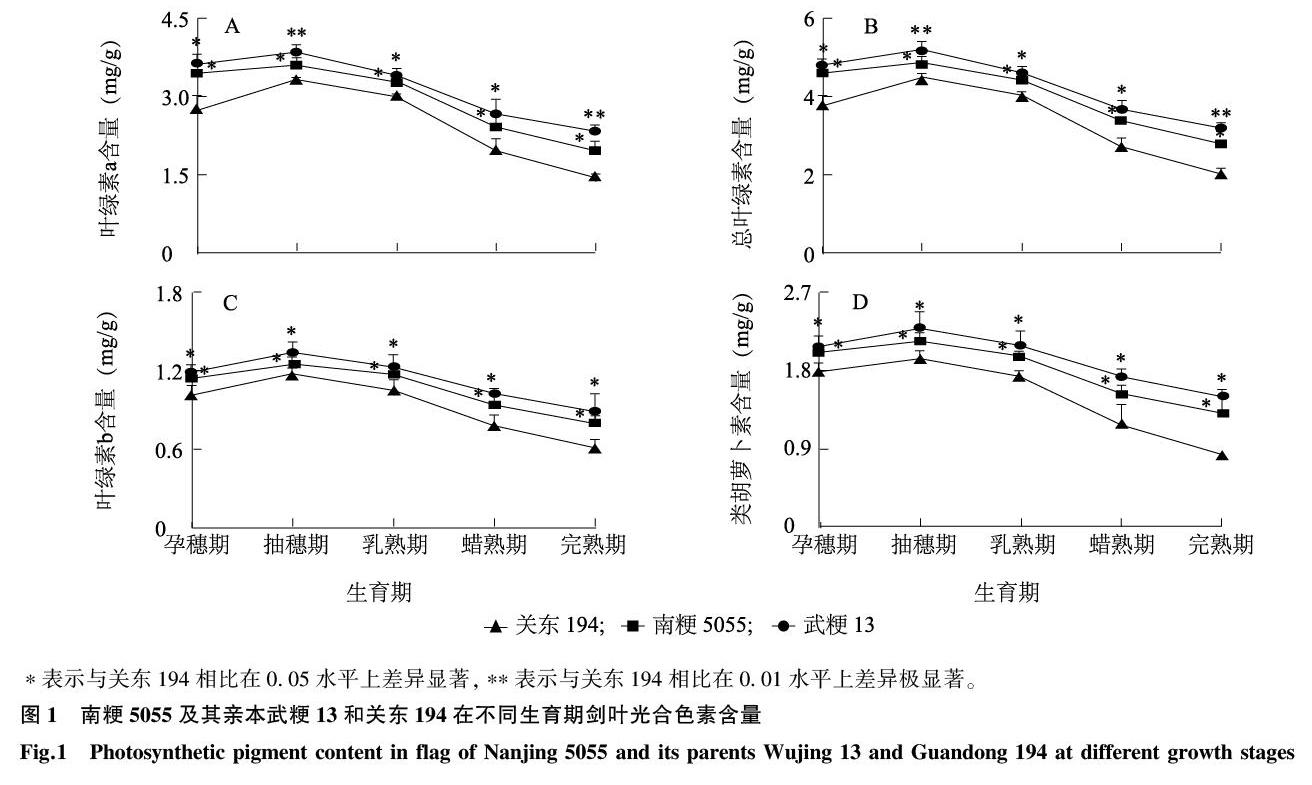
2.2南粳5055及其亲本的叶片光合色素含量差异
由图1可以看出,武粳13、南粳5055和关东194的总叶绿素、叶绿素a、叶绿素b及类胡萝卜素含量的峰值均出现在抽穗期,说明各水稻品种在抽穗期可以捕获、转化较多的光能;抽穗期过后,各水稻品种的光合色素含量开始下降,到完熟期关东194、南粳5055和武粳13的总叶绿素含量分别下降了54.3%、43.2%、38.0%,说明关东194在生育后期衰老速度较快。在孕穗期、乳熟期和蜡熟期,南粳5055的叶绿素与类胡萝卜素含量与母本武粳13没有显著差异,与父本关东194存在显著差异。在整个生殖生长期,南粳5055的光合色素含量略低于母本武粳13,高于父本关东194。
2.3南粳5055及其亲本叶片净光合速率差异
由图2可知,3个水稻品种的光合速率均呈先上升后下降的趋势,且峰值均出现在抽穗期,与光合色素含量变化趋势相一致。在孕穗期、抽穗期和乳熟期3个水稻品种均保持较高的净光合速率,为其籽粒中碳水化合物的形成与积累提供了重要保障;乳熟期后,3个水稻品种的光合速率下降较快,与关东194相比武粳13与南粳5055的光合速率下降趋势较缓,关东194的光合速率下降幅度较大。在整个生殖生长时期,3个水稻品种的净光合速率大小顺序为:武粳13>南粳5055>关东194。在孕穗期、乳熟期和完熟期,南粳5055的净光合速率接近武粳13,无明显差异,但显著高于关东194;在抽穗期,武粳13的净光合速率分别比南粳5055和关东194高5.3%、11.7%;在蜡熟期,3个水稻品种间的净光合速率差异达到显著或极显著性水平,武粳13的净光合速率分别是南粳5055和关东194的1.08和1.24倍。
2.4南粳5055及其亲本叶片叶绿素荧光参数差异
由图3可知,在孕穗期、抽穗期和乳熟期,南粳5055光系统II (Photosystem II, PSII)的单位反应中心吸收(ABS/RC)、捕获光能(TRo/RC)及传递电子(ETo/RC)的效率高于母本武粳13和父本关东194;在孕穗期单位PSII反应中心热耗散效率(DIo/RC)低于武粳13,高于关东194,且随着生育进程的推进,南粳5055与武粳13的DIo/RC参数逐渐靠近。南粳5055光系统I (Photosystem I, PSI)端还原电子效率(REo/RC)接近于武粳13,高于关东194。在量子产额方面,南粳5055吸收的光能传递到PSII最初电子受体的效率(φPo)和吸收的光能传递到PSII末端电子受体的效率(φEo)略低于武粳13,高于关东194;南粳5055用于还原PSI受体侧末端电子受体的量子产额(φRo)接近于武粳13,高于关东194。
ABS/RC: PSII单位反应中心吸收的光能; DIO/RC: t=0时PSII单位反应中心耗散掉的能量; TRO/RC: t=0时单位反应中心捕获的用于还原QA的能量; ETO/RC: t=0时单位反应中心捕获的用于电子传递的能量; REO/RC:单位反应中心PSI受体侧还原的电子通量; φPo:t=0时PSII的最大光化学效率;φEo: t=0时用于电子传递的量子产额; φRo: t=0时用于还原PSI受体侧末端电子受体的量子产额; PIabs: 以吸收光能为基础的性能指数; PItot: 综合光合性能指数。每个参数均为相对于对照关东194的比例。
PIabs是PSII光能吸收的光合性能指数,PItot是衡量PSII、PSI能量传递效率的综合性能指数[16-17]。图4显示,3个水稻品种的PIabs和PItot参数从孕穗期到乳熟期呈先增加后降低的趋势,在抽穗期达到峰值,说明3个水稻品种的PSI和PSII在抽穗期光化学效率较强,有利于光合产物的合成和转运。在孕穗期、抽穗期及乳熟期,3个水稻品种的PIabs和PItot参数大小顺序均为武粳13>南粳5055>关东194,南粳5055的PIabs与母本武粳13、父本关东194均存在显著差异,PItot与母本无显著差异,与父本存在显著差异。
2.5南粳5055及其亲本的类囊体膜蛋白复合物含量差异
BN-PAGE考染结果显示,3%DM能清晰地分离大分子量蛋白复合物,2%DM能较好地分离小分子量蛋白复合物(图5)。以关东194各类囊体膜蛋白复合物含量为基准的南粳5055与武粳13的类囊体蛋白复合物相对含量如图6所示。在孕穗期和乳熟期,南粳5055的PSI含量高于武粳13和关东194,并且在孕穗期南粳5055与武粳13的PSI含量无显著差异,与关东194存在显著差异。南粳5055的光系统II核心复合物(Photosystem II core,PSIIcore)和PSII捕光复合物(LHCII1、LHCII2、和LHCII3)含量均略低于母本武粳13,高于父本关東194。
2.6南粳5055及其亲本的类囊体膜光合蛋白复合物的亚基含量差异
为进一步探究南粳5055、武粳13和关东194的类囊体膜蛋白复合物中各类亚基的变化,通过蛋白质免疫印迹技术分析了3个水稻品种间类囊体膜光合蛋白复合体亚基含量差异(图7)。在孕穗期和乳熟期,南粳5055的PSI蛋白亚基PsaB含量略高于母本武粳13和父本关东194。南粳5055在孕穗期的LHCI蛋白(Lhca1、Lhca2)含量高于武粳13和关东194。南粳5055在抽穗期的Lhca1和Lhca2
蛋白含量低于武粳13,高于关东194;南粳5055在乳熟期的Lhca1、Lhca2蛋白含量高于武粳13,低于关东194。在孕穗期、抽穗期和乳熟期,南粳5055的PSII核心蛋白亚基PsbB、PsbO和LHCII蛋白亚基Lhcb2、Lhcb4含量略低于武粳13,高于父本关东194。
3讨论
生殖生长期水稻功能叶片的光合作用对水稻产量有重要影响[17]。本研究发现,南粳5055的结实率和千粒质量与武粳13无显著性差异,显著高于关东194,在孕穗期、乳熟期和完熟期南粳5055的净光合速率显著高于关东194,略低于武粳13。南粳5055较高的净光合速率有利于光合产物的形成与积累,为其产量的提高打下基础。张笑寒等[18]研究结果表明,水稻生殖生长期的净光合速率与光合色素含量成正比。光合色素具有捕获光子、转化光能的作用,叶绿素a是光反应中心的重要组成部分,叶绿素b是捕光复合物组装和稳定的重要物质基础[19-22]。在孕穗期、乳熟期和完熟期,南粳5055的叶绿素a、叶绿素b、总叶绿素和类胡萝卜素含量均显著高于父本关东194,略低于母本武粳13。南粳5055的光合色素含量与净光合速率同步变化,说明南粳5055稳定的光合色素含量为其稳定的光合速率提供了重要的物质基础。类胡萝卜素除了能捕获光能外,还可以作为光保护剂抵御光抑制的发生[23]。有研究结果表明作物可以通过热耗散能力阻止活性氧的产生及光抑制的发生[24]。南粳5055在孕穗期DIo/RC参数低于武粳13,高于关东194,在生育后期与武粳13接近且高于关东194,说明南粳5055在生育后期具有较好的热耗散能力,可能与其含有稳定的类胡萝卜素和稳定的LHCII有关。稳定的光合色素含量和热耗散能力可能是南粳5055保持较高净光合速率和产量的生理基础。
叶绿素荧光参数能够准确地反映光系统内光化学效率和电子传递水平[25-31]。在孕穗期、抽穗期和乳熟期,南粳5055的REo/RC和φRo参数接近武粳13,高于关东194,说明南粳5055 PSI受体侧末端还原电子效率较强。植物体的光系统主要包括PSI和PSII[32]。本研究结果显示,在孕穗期和乳熟期,南粳5055的PSI及其亚基PsaB、Lhca1、Lhca2 含量略高于武粳13和关东194,说明南粳5055较高的PSI蛋白含量可能为其较强的PSI端电子还原效率提供了物质条件。PSII主要包含PSII核心复合体(PSIIcore)和PSII捕光色素复合体(LHCII)。PSIIcore分离光诱导的电荷、传递电子并催化水的光解[33]。LHCII是光合膜上含量最丰富的蛋白质,结合60%左右的叶绿素,具有吸收光能、传递能量和维持膜结构稳定的功能[34-35]。在孕穗期和乳熟期,南粳5055的PSIIcore及其亚基PsbB、PsbO含量和LHCII(LHCII1、LHCII2、LHCII3)及其亚基Lhcb2、Lhcb4含量略低于武粳13,高于关东194,说明南粳5055 PSII的光能吸收、传递和转换效率可能略低于武粳13,高于关东194。荧光参数显示,南粳5055的ABS/RC、TRo/RC和ETo/RC高于武粳13和关东194,φPo和φEo效率略低于武粳13,高于关东194,推测南粳5055具有相对较高的单位反应中心吸收、捕获光能和传递能量的潜力,而南粳5055吸收的光能传递到PSII最初电子受体和末端电子受体的效率略低于武粳13。
在孕穗期、抽穗期和乳熟期,南粳5055的PIabs显著低于武粳13,高于关东194,PItot与武粳13无明显差异,显著高于关东194。与武粳13和关东194相比,推测南粳5055的PSI能量传递效率较高,光合性能存在优势。BN-PAGE和WB分析结果表明,南粳5055的PSI含量高于武粳13和关东194,PSII含量接近武粳13但高于关东194,表明南粳5055较高的PSI含量可能在其PSI优越的光合性能方面发挥着重要作用。
参考文献:
[1]欧志英, 彭长连, 阳成伟, 等. 超高产水稻剑叶的高效光合特性[J]. 热带亚热带植物学报, 2003, 11(1):1-6.
[2]剧成欣, 陶进, 钱希旸, 等. 不同年代中籼水稻品种的叶片光合性状[J]. 作物学报, 2016, 42(3):415-426.
[3]WEI X D. Photosynthesis enhanced oxidative stress tolerance in high-yield rice varieties (Oryza sativa var. japonica L.) in the field[J]. Genetics&Molecular Research, 2016, 15(3):1-14.
[4]劉红江, 陈虞雯, 张岳芳, 等. 不同播栽方式对水稻叶片光合特性及产量的影响[J]. 江苏农业学报, 2016, 32(6):1206-1211.
[5]李晓峰, 程金秋, 梁健, 等. 秸秆全量还田与氮肥运筹对机插粳稻产量及氮素吸收利用的影响[J]. 作物学报, 2017, 43(6):912-924.
[6]周根友, 翟彩娇, 邓先亮, 等. 盐逆境对水稻产量、光合特性及品质的影响[J]. 中国水稻科学, 2018, 32(2):146-154.
[7]叶露幻, 沈唯军, 郑宝刚, 等. 两优培九剑叶衰老过程光合膜功能及蛋白质复合物的变化[J]. 作物学报, 2013, 39(11):2030-2038.
[8]ARNON D I. Copper enzymes in isolated chloroplasts: polyphenoloxidase in Beta vulgaris[J]. Plant Physiology, 1949, 24(1):1.
[9]LICHTENTHALER H, LICHTENTHALER H K. Lichtenthaler,chlorophylls and carotenoids: pigment photosynthetic biomembranes[J]. Methods in Enzymology, 1987, 148(1):350-382.
[10]STRASSER R J, TSIMILLI-MICHAEL M. Activity and heterogeneity of PS II probed in vivo by the chlorophyll a fluorescence rise O-[K]-J-I-P[J].Photosynthesis: Mechanisms and Effects,1998, 5(1):4321-4324.
[11]WANG Y, ZHANG J, YU J, et al. Photosynthetic changes of flag leaves during senescence stage in super high-yield hybrid rice LYPJ grown in field condition[J]. Plant Physiology and Biochemistry, 2014, 82(3):194-201.
[12]KGLER M, JNSCH L, KRUFT V, et al. Analysis of the chloroplast protein complexes by blue-native polyacrylamide gelelectrophoresis (BN-PAGE)[J]. Photosynthesis Research, 1997, 53(1):35-44.
[13]SHAO J, ZHANG Y, YU J, et al. Isolation of thylakoid membrane complexes from rice by a new double-strips BN/SDS-PAGE and bioinformatics prediction of stromal ridge subunits interaction.[J]. PLoS ONE, 2011, 6(5):e20342.
[14]SHEN W J,CHEN G X, XU J G, et al. High light acclimation of Oryza sativa L. leaves involves specific photosynthetic-sourced changes of NADPH/NADP+ in the midvein.[J]. Protoplasma, 2015, 252(1):77-87.
[15]牛东东, 郝育杰, 荣瑞娟, 等. 转基因水稻中GUS蛋白质的检测及其表达特征[J]. 中国农业科学, 2014, 47(14):2715-2722.
[16]HOLLAND V, KOLLER S, BRGGEMANN W. Insight into the photosynthetic apparatus in evergreen and deciduous european oaks during autumn senescence using OJIP fluorescence transient analysis[J]. Plant Biology, 2014, 16(4):801-808.
[17]SRIVASTAVA A, STRASSER R J. Greening of peas: parallel measurements of 77 K emission spectra, OJIP chlorophylla fluorescence transient, period four oscillation of the initial fluorescence level, delayed light emission, and P700[J]. Photosynthetica, 1999, 37(3):365-392.
[18]张笑寒, 趙德刚, 何友勋, 等. 杂交水稻毕粳优210及其亲本光合特性研究[J]. 云南农业大学学报, 2016, 31(3):381-386.
[19]刘自刚, 孙万仓, 方彦, 等. 夜间低温对白菜型冬油菜光合机构的影响[J]. 中国农业科学, 2015, 48(4):672-682.
[20]张菂, 陈昌盛, 李鹏民, 等. 利用快速荧光、延迟荧光和820 nm光反射同步测量技术探讨干旱对平邑甜茶叶片光合机构的伤害机制[J]. 植物生理学报, 2013, 49(6):551-560.
[21]ZHANG Z S, LI G, GAO H Y, et al. Characterization of photosynthetic performance during senescence in stay-green and quick-leaf-senescence,Zea mays L. inbredlines[J]. PLoS ONE, 2012, 7(8):e42936.
[22]孙小玲, 许岳飞, 马鲁沂, 等.植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报, 2010, 34(8):989-999.
[23]李霞, 焦德茂. 水稻耐光氧化和耐荫特性的生理基础(英文)[J]. 植物学报, 2000, 42(12):1271-1277.
[24]MORALES F, ABADIA J, ABADIA A. Thermal energy dissipation in plants under unfavorable soil conditions[M]// ADAMS B, GARAB G, ADAMS W. Non-photochemical quenching and energy dissipation in plants, algae and cyanobacteria.New York: Springer Dordrecht HeidelberPress, 2014.
[25]孟力力,柳軍,皮杰,等. 不同光质LED光源对彩叶草生长及叶绿素荧光参数的影响[J]. 江苏农业科学,2018,46(20):161-164.
[26]BAKER N R. Chlorophyll fluorescence: a probe of photosynthesis in vivo[J]. Annual Review of Plant Biology, 2008, 59(1):89-113.
[27]王玉丽,孙居文,荀守华,等. 干旱胁迫对东岳红光合特性、叶绿素荧光参数及叶片相对含水量的影响[J]. 山东农业科学,2017,49(4):46-50.
[28]ZHANG M P, ZHANG C J, YU G H, et al. Changes in chloroplast ultrastructure, fatty acid components of thylakoid membrane and chlorophyll a fluorescence transient in flag leaves of a super-high-yield hybrid rice and its parents during the reproductive stage[J]. Journal of Plant Physiology, 2010, 167(4):277-285.
[29]杨万基,蒋欣梅,高欢,等. 28-高芸苔素内酯对低温弱光胁迫辣椒幼苗光合和荧光特性的影响[J]. 南方农业学报,2018,49(4):741-747.
[30]程占慧, 刘良云. 基于叶绿素荧光发射光谱的光能利用率探测[J]. 农业工程学报, 2010, 26(增刊2): 74-80.
[31]黄相玲.福清龙江不同断面空心莲子草生理生态特征比较[J].杂草学报,2018,36(1):20-24.
[32]DEKKER J P, BOEKEMA E J. Supramolecular organization of thylakoid membrane proteins in green plants[J]. BBA-Bioenergetics, 2005, 1706(1):12-39.
[33]ZHOU F, LIU S, HU Z H, et al. Effect of monogalactosyldiacylglycerol on the interaction between photosystem II core complex and its antenna complexes in liposomes of thylakoid lipids[J]. Photosynthesis Research, 2009, 99(3):185-193.
[34]OUKARROUM A, SCHANSKER G, STRASSER R J. Drought stress effects on photosystem I content and photosystem II thermotolerance analyzed using Chl a fluorescence kinetics in barley varieties differing in their drought tolerance[J]. Physiol Plant, 2009, 137:188-199.
[35]RUBAN A V, YOUNG A J, PASCAL A A, et al. The effects of illumination on the xanthophyll composition of the photosystem II light-harvesting complexes of spinach thylakoid membranes[J]. Plant Physiol, 1999, 104:227-234.
(责任编辑:张震林)
