家蚕卵形指数对孵化率的影响及孵化相关基因表达分析
2020-03-24王雪珍徐娇王闪闪浦月霞沈兴家唐顺明
王雪珍 徐娇 王闪闪 浦月霞 沈兴家 唐顺明


摘要:【目的】分析家蠶卵形指数对孵化率的影响规律,以及孵化酶基因(BmHE I和BmHE II )、几丁质酶基因(Chitinase)和周期蛋白基因(Period)在不同卵形间的表达规律,为阐明家蚕卵形指数与孵化率的相关性及其分子机理打下基础。【方法】调查家蚕Nistari品种野生型正常形品种(Nistari+)及其新突变体纺锤形品种(Nistari-)的卵形指数、孵化率、受精率和转青死卵率,分析其卵形指数与孵化率的相关性;并通过实时荧光定量PCR检测蚕卵胚胎发育后期孵化相关基因的表达情况。【结果】Nistari+蚕卵的平均卵形指数为1.26,极显著低于Nistari-蚕卵(1.73)(P<0.01,下同);孵化率为96.22%,极显著高于Nistari-蚕卵(51.33%)。当Nistari+蚕卵的卵形指数为1.24~1.25时,其孵化率(97.39%)和受精率(98.84%)均最高,转青死卵率最低(2.61%);而Nistari-蚕卵的卵形指数为1.77~1.81时,其孵化率(56.52%)和受精率(74.87%)均最高,转青死卵率最低(43.48%)。相关分析结果表明,Nistari蚕卵孵化率、受精率和转青死卵率与卵形指数存在一定的相关性,且受卵形指数影响。在蚕卵胚胎发育后期(孵化前),Nistari+蚕卵的BmHE I、BmHE II、Chitinase和Period基因大量表达,对应的相对表达量显著(P<0.05)或极显著高于NISTAR-蚕卵。【结论】家蚕Nistari品种的卵形指数与孵化率存在一定相关性,而BmHE I、BmHE II、Chitinase和Period基因的表达差异是导致Nistari-蚕卵与Nistari+蚕卵孵化率差异的分子基础。
关键词: 家蚕;Nistari品种;卵形指数;孵化率;孵化相关基因
中图分类号: S882.4 文献标志码: A 文章编号:2095-1191(2020)12-3109-07
Abstract:【Objective】The effects of silkworm egg shape index (ESI) on hatching rate(HR), and the expression patterns of hatching enzyme genes(BmHE I and BmHE II), chitinase gene(Chitinase) and period protein gene(Period ) in different egg shapes were investigated, which laid a foundation for elucidating the correlation between egg shape index and hatching rate of silkworm eggs and its molecular mechanism. 【Method】The ESI, HR, fertilization rate(FR), and mortality rate in egg with pigmentary body of embryo(MR) were investigated between the wild type normal egg variety(Nistari+)and its new mutant spindle egg variety (Nistari-), and the correlation of ESI with HR were analyzed. And investigated the differences in gene expression levels related to hatching process in the later stages of embryonic development by real-time quantitative PCR. 【Result】The mean ESI of Nistari+ was 1.26, which was extremely lower than that of Nistari-(1.73)(P<0.01,the same below); the HR of Nistari+was 96.22%, which was extremely higher than that of Nistari- silkworm eggs(51.33%). When the ESI of Nistari+ was 1.24-1.25, the HR (97.39%) and FR(98.84%) were the highest and the MR(2.61%) was the lowest, while when the ESI of Nistari- was 1.77-1.81, the HR(56.52%) and FR(74.87%) of its eggs were the highest, MR was the lowest(43.48%). The results of correlation analysis showed that there was a certain correlation between the Nistari ESI and HR, FR and MR, and was affected by ESI. In the later stages of silkworm egg embryo development(before hatching), the expression levels of BmHE I, BmHE II, Chitinase and Period genes of Nistari+ silkworm eggs were high, and were significantly(P<0.05) or extremely(P<0.01) higher than those of Nistari_ silkworm eggs(P<0.05). 【Conclusion】There is certain correlation between ESI and HR of silkworm Nistari varieties. The differe-nces in expression of four genes, BmHE I, BmHE II, Chitinase and Period, are the molecular basis for the differences in HR between silkworm varieties of Nistari- and Nistari+.
Key words: sailkworm(Bombyx mori); Nistari varieties; egg shape index; hatching rate; hatching related genes
Foundation item:National Natural Science Foundation of China(31372376,31672490);Jiangsu Natural Science Foundation(BK20141285)
0 引言
【研究意义】家蚕(Bombyx mori)是一种重要的鳞翅目经济昆虫,在农业经济体系中占据重要地位。孵化率是衡量蚕种质量的一项关键性指标,其影响因素包括蚕种品质、制种季节、蚕卵营养、冷藏时间和催青条件等(李燕飞等,2018;高海青等,2019),其中蚕种的卵形及卵重等品质指标对蚕卵孵化率有明显影响(潘明德等,2019)。因此,研究分析家蚕卵形指数对孵化率的影响及其分子机理,对提高蚕种孵化率、蚕种选育与保存具有重要意义。【前人研究进展】昆虫胚胎孵化后才能进行后续的生长发育(Young et al.,2000;Bowles et al.,2008),除了温度、湿度和光照等外部条件对昆虫的胚胎发育有影响外,其内部的基因表达调控网络也会对昆虫孵化及后期发育有显著影响(张艳,2020)。高颂等(2012)研究发现,几丁质酶(Chitinase)主要在昆虫表皮和中肠中表达,与幼虫蜕皮、化蛹和成虫羽化及翅的延展有关。Tao等(2017)研究表明,大多数昆虫的孵化过程受生物钟调控机制严格调节,其中周期蛋白基因(Period)在生物钟信号通路中扮演重要角色。家蚕孵化也呈明显的时间节律性,故推测其受Period基因的调控。至今,有关蚕卵孵化的研究已有较多报道。Lu等(2010)在蚕卵孵化过程中发现,消化液从成熟胚中分泌溶解并软化卵壳,从而有利于蚁蚕孵化。Tang等(2012)研究表明,在蚕卵孵化过程中BmHE I和BmHE II两种孵化酶基因的表达趋势与其孵化进程基本一致。Tao等(2017)研究发现,家蚕蚁蚕从含有大量几丁质的卵壳中孵化出来,需依赖几丁质酶将几丁质降解为寡糖,即蚕卵的孵化过程需要几丁质酶参与。【本研究切入点】已有研究证实禽蛋孵化率与蛋形指数(禽蛋长轴与短轴间的比值)有关。朱振鹏等(2013)研究认为,扬州鹅种蛋的蛋形指数在1.32~1.46时其孵化率最高;张楠楠等(2014)研究发现,肉杂鸡种蛋的蛋形指数在1.25~1.30和1.31~1.37 时孵化效果较好,而在1.19~1.24时孵化效果较差。但针对家蚕卵形指数与其卵孵化率间的相关研究至今未见报道。【拟解决的关键问题】调查家蚕Nistari品种野生型正常形卵(Nistari+)及其新突变体纺锤形卵(Nistari-)的卵形指数、孵化率、受精率和转青死卵率,分析家蚕卵形指数对孵化率的影响规律,以及孵化酶基因(BmHE I和BmHE II)、几丁质酶基因(Chitinase)和周期蛋白基因(Period)在不同卵形间的表达规律,为阐明家蚕卵形指数与孵化率的相关性及其分子机理打下基础。
1 材料与方法
1. 1 试验材料
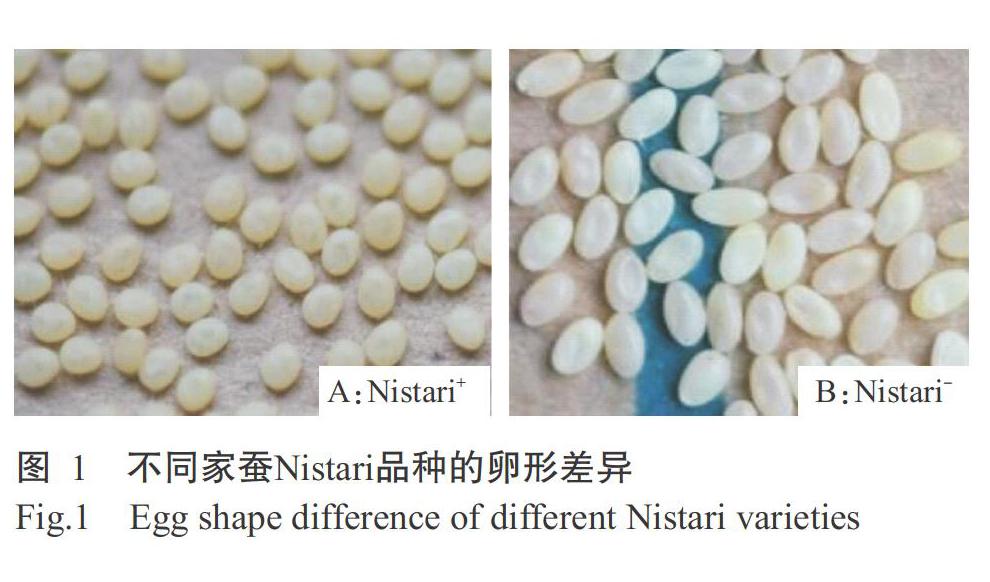
家蚕Nistari品种的野生型正常形品种Nistari+(图1-A)及其新突变体纺锤形品种Nistari-(图1-B)由江苏科技大学/中国农业科学院蚕业研究所保存提供。其中,Nistari+品种的蚕卵呈椭圆形,Nistari-品种的蚕卵呈纺锤形。2个品种的蚕卵孵化后,幼虫在25 ℃、相对湿度(65±5)%、12 h光照/12 h黑暗的条件下桑叶饲养,上蔟结茧、化蛹、羽化产卵和蚕卵催青等按常规管理条件进行操作。
1. 2 品种间卵形指数及孵化率调查
以正常产卵的框制种Nistari+和Nistari-蚕卵为材料,以蛾圈为单位,每个蛾圈调查50粒卵,调查10个蛾圈。在Leica体视显微镜下测量蚕卵的纵径和横径,计算卵形指数。调查后的蚕种按常规催青条件进行催青,待蚕卵完全孵化后,统计不同品种蛾圈内的总卵数、孵化卵数、受精卵数和转青死卵数,计算蚕卵的孵化率、受精率和转青死卵率。3次重复,取平均值,比较Nistari+和Nistari-品种间的卵形指数和孵化率差异。
卵形指数=纵径长度(长轴)/横径长度(短轴)
孵化率(%)=孵化蚕卵数/受精卵数×100
受精率(%)=受精卵数/总卵数×100
转青死卵率(%)=(受精卵数-孵化卵数)/受精卵数×100
1. 3 品种内卵形指数及孵化率调查
以正常产卵Nistari+和Nistari-散卵为材料,每个供试品种取3000粒卵,按1.2的方法计算卵形指数后放入预先标记好的不同卵形指数小组内,每组100粒卵。调查后的蚕种按常规催青条件进行催青,待蚕卵完全孵化后,按1.2的方法调查不同卵形指数小组内的总卵数,统计孵化卵数、受精卵数和转青死卵数,计算蚕卵的孵化率、受精率和转青死卵率。3次重复,取平均值,分别分析Nistari+蚕卵及Nistari-蚕卵不同卵形指数与孵化率、受精率和转青死卵率的关系,并进行相关分析。
1. 4 4个孵化相关基因表达差异比较
以肌动蛋白3(Actin3)为内参基因,比较蚕卵胚胎后期孵化相关基因(BmHE I、BmHE II、Chitinase和Period)的表达差异。所用引物及其序列信息见表1,均委托生工生物工程(上海)股份有限公司合成。以Nistari+和Nistari-蚕卵催青第7、8、9和10 d(蚕卵胚胎发育后期)的散卵各100 mg为材料,按TRIzol试剂盒说明提取总RNA,获得的蚕卵总RNA用适量DEPC水溶解,并稀释至500 ng/?L。取1 ?g RNA反转录合成cDNA第一链,具体步骤按照First Strand cDNA Synthesis Kit试剂盒(TaKaRa公司)说明进行操作。以cDNA为模板进行实时荧光定量PCR检测,反应体系50.0 ?L:2×Ultra SYBR Mixture 25.0 ?L,上、下游引物(10 ?mol/L)各1.0 ?L,cDNA模板2.0 ?L,ddH2O补足至50.0 ?L。擴增程序:95 ℃预变性2 min;95 ℃ 15 s,59 ℃ 30 s,72 ℃ 30 s,进行30个循环。
1. 5 统计分析
试验数据采用Excel 2016进行统计整理,运用SPSS 17.0进行差异显著性分析,并以Origin 8.0制图。
2 结果与分析
2. 1 Nistari+和Nistari-蚕卵的卵形指数及其孵化率
由表2可知,Nistari+蚕卵的平均卵形指数(1.26)极显著低于Nistari-蚕卵(1.73)(P<0.01,下同);Nistari+蚕卵的卵形指数最大值为1.29、最小值为1.22,而Nistari-蚕卵的卵形指数最大值为1.81、最小值为1.65。Nistari+和Nistari-蚕卵的孵化率分别为96.22%和51.33%,二者差异极显著。可见,平均卵形指数较小有利于Nistari+蚕卵孵化,平均卵形指数较大不利于Nistari-蚕卵孵化。
2. 2 Nistari+蚕卵卵形指数与孵化率、受精率和转青死卵率的关系
由表3可知,第1~4组Nistari+蚕卵的卵形指数分别在1.22~1.23、1.24~1.25、1.26~1.27和1.28~1.29,其中以第4组最高、第1组最低;第2组Nistari+蚕卵的孵化率最高,为97.39%,极显著高于其他3个组别;第1、第3、第4组Nistari+蚕卵的孵化率分别为95.88%、96.93%和94.68%,组间差异均达极显著水平。第2组Nistari+蚕卵的受精率最高,为98.84%,极显著高于其他3个组别;第2组Nistari+蚕卵的转青死卵率最低,仅为2.61%,极显著低于其他3个组别。可见,卵形指数为1.24~1.25更有利Nistari+蚕卵受精和孵化,其受精率和孵化率均最高。
2. 3 Nistari-蚕卵卵形指数与孵化率、受精率和转青死卵率的关系
由表4可知,第1~4组Nistari-蚕卵的卵形指数分别为1.65~1.68、1.69~1.72、1.73~1.76和1.77~1.81,其中以第4组最高、第1组最低;第4组Nistari-蚕卵的孵化率最高,为56.52%,极显著高于其他3个组别;第1、第2和第3组Nistari-蚕卵的孵化率分别为50.43%、47.87%和50.48%,其中第1组与第3组的差异不显著(P>0.05,下同),但二者极显著高于第2组。第4组Nistari-蚕卵的受精率最高(74.87%),极显著高于其他3个组别;第2组Nistari-蚕卵的受精率最低(54.59%),极显著低于其他3个组别。第4组Nistari-蚕卵的转青死卵率最低,为43.48%,极显著低于其他3个组别。可见,卵形指数在1.77~1.81更有利于Nistari-蚕卵受精和孵化,受精率和孵化率均最高。
2. 4 卵形指数与蚕卵孵化率、受精率和转青死卵率的相关分析结果
根据统计学正态分布规律及参考禽蛋相关蛋形指数与孵化率的相关分析方法(韦偏等,2019;黄得纯等,2020),采用SPSS 17.0中的最小二乘法进行拟合回归方程相关分析。由表5可知,卵形指数与Nistari+蚕卵孵化率、受精率和转青死卵率所对应的回归方程分别为:y=-2350x2+5878.2x-3578.4、y= -2500x2+6267.6x-3829.9和y=2350x2-5878.2x+3578.4。卵形指数与Nistari-蚕卵孵化率、受精率和转青死卵率所对应的回归方程分别为:y=1185.6x2-4045.5x+3499.3、y=2780.9x2-9492.6x+8156.6和y=-1185.6x2+4045.5x-3499.3。综上所述,蚕卵孵化率、受精率和转青死卵率与卵形指数存在一定的相关性,且受卵形指数影响。
2. 5 Nistari+和Nistari-蚕卵胚胎发育后期孵化相关基因的表达差异
在常规条件下进行催青,蚕卵在第11 d孵化。选取蚕卵胚胎发育后期即催青第7、8、9和10 d的Nistari+和Nistari-蠶卵,调查比较BmHE I、BmHE II、Chitinase和Period等孵化相关基因的表达情况。结果(图2)显示,Nistari+和Nistari-蚕卵的BmHE I和BmHE II基因相对表达量在胚胎发育后期至孵化前均呈逐渐上升趋势,说明BmHE I和BmHE II基因参与蚕卵孵化过程;Nistari+蚕卵的BmHE I基因相对表达量在催青第7~10 d均极显著高于Nistari-蚕卵(图2-A),Nistari+蚕卵的BmHE II基因相对表达量在催青第7~8 d表现为显著高于Nistari-蚕卵(P<0.05,下同),在催青第9~10 d则表现为极显著性高于Nistari-蚕卵(图2-B)。可见,家蚕的BmHE I和BmHE II基因均在蚕卵胚胎发育后期(孵化前)大量合成,且Nistari+蚕卵的合成量远高于Nistari-蚕卵,可能是导致Nistari-与Nistari+品种间孵化率极显著差异的主要原因。
由图3-A可看出,在催青第7、8、9和10 d,Nistari+蚕卵的Chitinase基因相对表达量(分别为0.002、0.004、0.008和0.035)均极显著高于Nistari-蚕卵(分别为0.001、0.002、0.004和0.010),Nistari+蚕卵的Chitinase基因相对表达量在孵化前1 d(催青第10 d)达最高值(0.035),远高于催青第7~9 d的Nistari+蚕卵Chitinase基因相对表达量。说明Nistari+蚕卵的Chitinase基因在孵化前1 d大量合成,且极显著高于Nistari-蚕卵,可能是导致Nistari-蚕卵与Nistari+蚕卵孵化率差异的原因之一。
由图3-B可看出,在催青第7、8、9和10 d,Nistari+蚕卵的Period基因相对表达量(分别为0.0082、0.0500、0.0253和0.0125)均极显著高于Nistari-蚕卵(分别为0.0060、0.0039、0.0227和0.0080),Nistari+蚕卵的Period基因相对表达量在孵化前2 d(催青第9 d)达最高值(0.0253),远高于催青第7、8和10 d的Nistari+蚕卵Period基因相对表达量。说明Nistari+蚕卵的Period基因在孵化前2 d大量合成,且极显著高于Nistari-蚕卵,推测这也是导致Nistari-蚕卵与Nistari+蚕卵孵化率差异的原因之一。
高海青,唐莹,顾海洋,杨斌. 2019. 影响蚕种孵化率的因素及解决途径[J]. 江苏蚕业,41(1-2):15-17. [Gao H Q,Tang Y,Gu H Y,Yang B. 2019. Influence factors on hatching rate of silkworm eggs and its solutions[J]. Jiangsu Sericulture,41(1-2):15-17.]
高颂,刘立会,刘仕平,王伟,陆改,夏庆友. 2012. 家蚕GH18家族几丁质酶的系统进化和BmChi的时期表达分析[J]. 蚕业科学,38(3):418-423. [Gao S,Liu L H,Liu S P,Wang W,Lu G,Xia Q Y. 2012. Phylogenetic analysis of GH18 family chitinases and temporal expressional profile of BmChi in the silkworm,Bombyx mori[J]. Science of Sericulture,38(3):418-423.]
黄得纯,吕敏芝,冯鑫,黎振杰,张绮琼,吴日富,甘仕棠. 2020. 东涛鸡鸡蛋品质测定及相关性分析[J]. 黑龙江畜牧兽医,(2):41-44. [Huang D C,Lü M Z,Feng X,Li Z J,Zhang Q Q,Wu R F,Gan S T. 2020. Quality determination and correlation analysis of Dongtao chicken eggs[J]. Heilongjiang Animal Science and Veterinary Medicine,(2):41-44.]
雷芳. 2010. 浅谈影响蚕种质量的因素及对策[J]. 四川蚕业,(3):52-53. [Lei F. 2010. Influence factors on the quality of silkworm eggs and its countermeasures[J]. Sichuan Sericulture,(3):52-53.]
李燕飞,李乙,蒋玉莲,韦红群,何珊珊,莫云霞. 2018. 广西现行家蚕品种两广二号原种随时孵化技术[J]. 南方农业学报,49(4):787-793. [Li Y F,Li Y,Jiang Y L,Wei H Q,He S S,Mo Y X. 2018.Instantaneous hatching technique for silkworm variety Liangguang 2 stock in Guangxi[J]. Journal of Southern Agriculture,49(4):787-793.]
刘振兴. 2014. 夜间光照对黑腹果蝇睡眠和生存能力影响及黑腹果蝇钟蛋白Timeless与Period相互作用的调控机理[D]. 北京:中国农业大学. [Liu Z X. 2014. Effects of light interruption on sleep and viability and interaction between clock proteins Timeless and Period in Drosophila melanogaster[D]. Beijing:China Agricultural University.]
潘明德,席全忠,张波,田超文. 2019. 蚕种孵化的影响因素及应对措施[J]. 现代农业科技,(23):213. [Pan M D,Xi Q Z,Zhang B,Tian C W. 2019. Influence factors on hatching process of silkworm eggs and its countermeasures[J]. Modern Agricultural Science and Technology,(23):213.]
申建梅,陈炳翰,黄丹青,何梦琪,胡黎明. 2018. 小菜蛾几丁质酶基因的克隆及表达分析[J]. 环境昆虫学报,40(1):173-179. [Shen J M,Chen B H,Huang D Q,He M Q,Hu L M. 2018. Cloning and expression profiling of a Chitinase gene from Plutella xylostella[J]. Journal of Environmental Entomology,40(1):173-179.]
束梅影. 2013. 家蚕BmN培养细胞昼夜节律生物钟基因的表达特征[D]. 苏州:苏州大学. [Shu M Y. 2013. Expression characteristics of the circadian clock genes in BmN cell line[D]. Suzhou:Soochow University.]
陶卉,徐世清. 2015. 鱗翅目昆虫昼夜节律的授时机制研究进展[J]. 生命科学,27(11):1355-1363. [Tao H,Xu S Q. 2015. Research progress in the circadian rhythm mechanism of lepidopteron[J]. Chinese Bulletin of Life Scien-ces,27(11):1355-1363.]
王英,司马杨虎,宋艳,朱晓苏,徐世清. 2008. 昆虫生物钟基因及其分子作用机制研究进展[J]. 江苏蚕业,30(1):9-14. [Wang Y,Sima Y H,Song Y,Zhu X S,Xu S Q. 2008. Research progress on insect circadian clock genes and their molecular mechanisms[J]. Jiangsu Sericulture,30(1):9-14.]
韦偏,祖盘玉,张福平. 2019. 贵州黄鸡蛋品质测定和相关性分析[J]. 贵州畜牧兽医,43(2):4-6. [Wei P,Zu P Y,Zhang F P. 2019. Quality determination and correlation analysis of Guizhou yellow eggs[J]. Guizhou Journal of Animal Husbandry and Veterinary Medicine,43(2):4-6.]
张达燕. 2013. 基于光节律诱导的家蚕孵化节律及分子机制研究[D]. 苏州:苏州大学. [Zhang D Y. 2013. Research on hatching rhythm and its molecular mechanism of Bombyx eggs under induction condition of circadian photoentrainment[D]. Suzhou:Soochow University].
张楠楠,檀晓萌,郝二英,贾淑庚,陈辉. 2014. 蛋形指数对肉杂鸡孵化率的影响[J]. 家禽科学,(8):14-16. [Zhang N N,Tan X M,Hao E Y,Jia S G,Chen H. 2014. Effect of egg shape index on hatching rate of broiler chickens[J]. Poultry Science,(8):14-16.]
张艳. 2020. 亚洲小车蝗的产卵、孵化行为与染菌后蝗蝻体温响应的研究[D]. 兰州:甘肃农业大学. [Zhang Y. 2020. Study on oviposition,egg hatching behavior of Oedaleus decorus asiaticus and its nymph body temperature response infected by Metarhizium anisopliae[D]. Lanzhou:Gansu Agricultural University.]
赵振华,黎寿丰,黄华云,张静,丁余荣,薛龙岗. 2010. 蛋重与蛋形指数对邵伯鸡种蛋孵化性能的影响[J]. 中国家禽,32(19):64-65. [Zhao Z H,Li S F,Huang H Y,Zhang J,Ding Y R,Xue L G. 2010. Effect of egg weight and egg shape index on the hatching performance of Shaobo chic-ken breeding eggs[J]. Chinese Poultry,32(19):64-65.]
朱振鹏,孙晓先,桑丹丹,龚道清. 2013. 蛋重和蛋形指数对扬州鹅种蛋孵化率的影响[J]. 饲料博览,(8):6-8. [Zhu Z P,Sun X X,Sang D D,Gong D Q. 2013. Influence of egg weight and egg shape index on egg hatchability of Yangzhou goose[J]. Feed Review,(8):6-8.]
Bowles V M,Young A R,Barker S C. 2008. Metalloproteases and egg-hatching in Pediculus humanus,the body(clothes) louse of humans(Phthiraptera:Insecta)[J]. Parasitology,135(1):125-130.
Lu F H,Tang S M,Shen X J,Wang N,Zhao Q L,Zhang G Z,Guo X J. 2010. Molecular cloning and characterization of hatching enzyme-like gene in the silkworm,Bombyx mori[J]. Molecular Biology Reports,37(3):1175-1182.
Royer V,Fraichard S,Bouhin H. 2002. A novel putative insect chitinase with multiple catalytic domains:Hormonal regulation during metamorphosis[J]. The Biochemical Journal,366(3):921-928.
Sauman I,Tsai T,Roca A L,Reppert S M. 1996. Period protein is necessary for circadian control of egg hatching behavior in the silkmoth Antheraea pernyi[J]. Neuron,17(5):901-909.
Tang S M,Wu J,Zhao X H,Wang H Y,Qiu Z Y,Shen X J,Guo X J. 2012. Molecular cloning and characterization of hatching enzyme-like geneII (BmHELII) in the silkworm,Bombyx mori[J]. Biochemical and Biophysical Research Communications,419(2):194-199.
Tao H,LI X,Qiu J F,Liu H J,Zhang D Y,Chu F,Sima Y h,Xu S Q. 2017. The light cycle controls the hatching rhythm in Bombyx mori via negative feedback loop of the circadian oscillator[J]. Archives of Insect Biochemistry & Physiology,96(2). doi:10.1002/arch.21408.
Yasumasu S,Iuchi I,Yamagami K. 2010. cDNAs and the genes of HCE and LCE,two constituents of the medaka hatching enzyme[J]. Development,Growth & Differentiation,36(3):241-250.
Young A R,Mancuso N,Meeusen E N,Bowles V M. 2000. Characterisation of proteases involved in egg hatching of the sheep blowfly,Lucilia cuprina[J]. International Journal for Parasitology,30(8):925-932.
(責任编辑 兰宗宝)
