锦鲤人工雌核发育早期胚胎观察
2016-11-28蒋国民王冬武邹利何志刚李绍明
蒋国民+王冬武+邹利+何志刚+李绍明
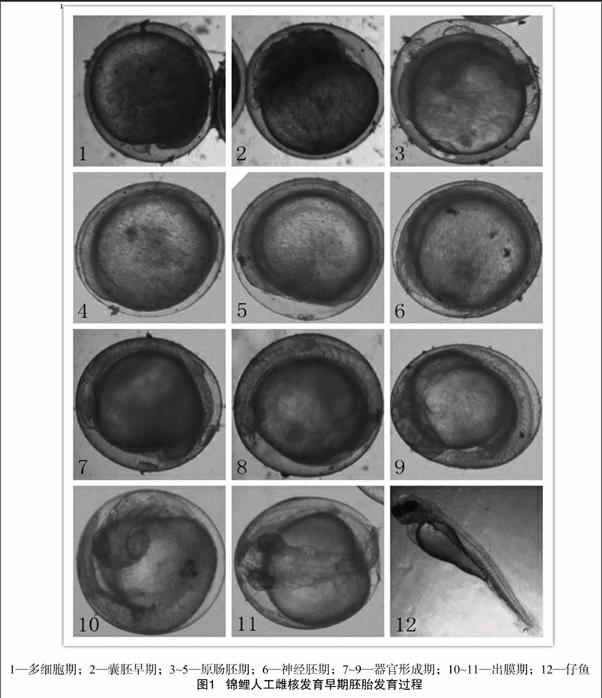
摘要:以团头鲂灭活精子为诱导,采用热休克染色体加倍处理方法进行锦鲤雌核发育。锦鲤卵为黏性卵,置于(20±1) ℃室内平皿孵化,50 min后开始卵裂,6 h后出现囊胚期,18.67 h后出现原肠胚期,30 h后出现神经胚期,39 h 后器官开始形成,约3 d后可以脱膜孵化,孵化率达68.5%。
关键词:雌核发育;早期胚胎;锦鲤;热休克;脱模;孵化率
中图分类号: S961.2 文献标志码: A
文章编号:1002-1302(2016)09-0248-03
锦鲤属鲤形目鲤科鲤鱼属,原产于我国,后传入日本[1],其色彩鲜艳,神态雍容华贵,观赏价值高,是一种高档观赏鱼,也是一种高度杂合体,花色遗传机制复杂。目前,大部分锦鲤品种主要是通过杂交以及长期人工选育而得到的。可见,通过纯系亲本来揭示花色遗传机制是目前锦鲤育种方面最亟待解决的问题。因此,雌核发育在锦鲤选育和亲市品种开发研究方面具有重大意义[2],它利用灭活的外源精子刺激卵子发育,再通过人工染色体加倍处理获得雌核发育后代,能快速建立遗传纯系,加快发育速度[3]。目前,我国水产行业中鲤[4-5]、草鱼[6]、白鲫[7]、虹鳟[8]等10多种鱼类进行雌核发育研究,但由于人工雌核发育的孵化率低,在生产上很难推广。因此,本试验以锦鲤为母本,以灭活的团头鲂精子为外源诱导精子,采用热休克处理假受精卵,受精卵和孵化率分别可达56.54%、 68.71%,并定期观察研究胚胎发育,为今后锦鲤人工雌核发育的推广提供参考资料。
1 材料与方法
1.1 试验材料
1.1.1 试验鱼 母本体质健壮,腹部膨大,色泽鲜艳,成熟度一致的2+龄锦鲤,来自湖南省渔缘生物有限公司;父本为2+龄性成熟团头鲂,来自湖南省渔缘生物有限公司。
1.1.2 药品 实验室内配制Hanks液,冰箱4 ℃保存备用。催产素于注射前配制,现配现用。
1.1.3 设备 Olympus显微镜及其摄像系统,紫外灯2个(30 W),灯架,摇床、纱布,温度计,加热棒,鸡毛等。
1.2 试验方法
1.2.1 催产 锦鲤亲本进行2针催产,催产药物注射时间与量根据当时水温、亲本成熟度、方便操作等多因素来确定,团头鲂注射1次,用量为锦鲤亲本一半。锦鲤与团头鲂分池养殖。
1.2.2 精子灭活[9] 人工挤出团头鲂精子(挤之前必须用毛巾擦干净鱼身上的水,沿着胸鳍至泄殖腔轻轻挤压),立刻加Hanks液,精子 ∶Hanks液=1 ∶4,然后充分摇匀,在培养皿上铺成约1 mm的液层,放距紫外线15~20 cm处垫有冰板的摇床上处理10~20 min,显微镜下定期检查精子活性。当90%精子失去活性时就停止紫外照射,收集失活精子,贮存碎冰中备用。
1.2.3 雌核发育[10] (1)受精。捞取发情锦鲤亲本,人工挤出成熟卵粒,快速加入失活精子,用干燥、洁净的鸡毛充分搅拌,进行干法人工假受精。
(2)热休克。用22 ℃水尽量冲散卵粒,均匀黏附直径为22 cm 的玻璃培养皿内,恒温3 min,然后逐步进入41 ℃水体,放置2 min,再逐步回到22 ℃,放置3 min,其后放置室内孵化。
(3)胚胎发育观察。孵化水温和室温维持在(20±1) ℃,孵化用水充分曝气,每隔2~3 h换水1次,定期剔除死卵,定期用OLYMPUS显微镜观察与摄像胚胎发育过程,并统计受精率和胚胎孵化率。
2 结果与分析
2.1 卵裂
受精50 min后,胚盘开始出现第1次分裂,其卵裂速度很快,1 h内完成16细胞期分裂,胚盘开始形成多层,卵裂球越来越小,规则地排列在胚盘表面,逐渐向胚盘外表推移,并集中在胚盘处形成较为明显的隆起,形成多细胞期(图1)。
2.2 囊胚期
受精6 h后,胚胎细胞界限开始模糊不清,胚盘在卵黄上呈高峰状,出现早期囊胚(图1),进入高囊胚期;9.8 h后,细胞界限消失,囊胚细胞开始向下方扩展,面积不断扩大,囊胚降低,囊胚细胞逐步平展于卵黄上,胚盘为弓形,形成低囊期。
2.3 原肠胚期
受精18.67 h后,胚层进一步向植物极扩张,约占整个胚胎的1/3(图1);受精20.17 h后,胚盘下包卵黄1/2,由于细胞的集中和内卷后造成一环带形的胚胎和一新月形的缺口,这就是背唇,即原肠期形成的开始(图1)。21.33 h后,胚盘下包3/5,背唇处又内卷及增生的细胞向中央伸展集中形成球胚盾,前端头部隆起明显,形成原肠晚期胚胎(图1)。原肠期统计受精率为56.54%。
2.4 神经胚期
受精后30 h,胚层细胞继续下包4/5,受精35 h后,囊胚层完全包围卵黄,胚孔闭合,胚体形成,呈弧形,胚盾中线形成神经索,脑部逐渐膨大,出现2个收缩部分,脑分为前、中、后脑3部分,胚体上神经沟两侧可见5~6对短柱状体节,达到胚孔封闭期(图1)。
2.5 器官形成期
受精39 h后,胚体前方两侧出现椭圆突起的眼泡原基,出现体节,并随着时间的推迟,体节越来越明显,受精49 h后,出现眼点,胚体后部肌肉可以轻微扭动,可见神经脊索(图1)。受精52 h后,个别胚体心脏开始微弱跳动(图1)。
2.6 孵化期
受精70~80 h后,胚体活动先明显减弱,然后胚体尾部出现剧烈扭动,甚至翻滚整个胚体,借助尾部摆动的力量而冲破卵膜(图1)。胚体有尾部先冲出卵膜的,也有头部先冲出卵膜的,从卵膜破裂到胚体完全脱落需要5~10 h,并统计胚胎孵化率(为68.71%)。刚脱膜而出的鱼苗,腹部带有一椭圆形卵黄囊,2~3 d后消失,鱼苗能平游(图1)。
3 结论与讨论
雌核发育主要是人工加倍染色体,采取阻止卵子的第2次成熟分裂,或卵子的第2次有丝分裂而使染色体加倍,不同阶段染色体加倍处理的雌核发育后代基因纯度不同[6]。热休克是一种常用的染色体加倍处理方法,用于雌核发育研究的不多,并且不同鱼类和不同染色体加倍处理阶段,热休克起始时间、所需强度、温度等均有所不同,孵化率和成活率也较低[11-12]。本试验用遗传失活的团头鲂精子能有效启动锦鲤雌核发育,采用热休克处理染色体加倍,较王云等学者研究结果[13]来看,可达到较高的受精卵和孵化率,表明此方法进行锦鲤雌核发育是有效可行的。
试验过程中,胚胎发育时间同其他研究学者研究上有所差异,笔者认为可能是有以下几个原因造成的:第一,孵化水温和室温的差异导致胚胎发育速度有所改变。胚胎在培养皿发育过程中,水温易受到环境的影响,所以孵化水温较难控制。第二,雌核胚胎发育多放在室内进行,环境光照度对其影响较大。第三,不同品种鱼类的胚胎发育时间会有所不同。
团头鲂属鲤科鲌亚科鲂属,染色体数目2n=48[14],锦鲤染色体数目为2n=100,两者关系较远,外部形态差异大,理论上杂交个体不成活[15]。在该研究中,用未经遗传失活的团头鲂精子与锦鲤人工受精,有杂交个体产生,体色黑,外部形态与团头鲂相似,与刘静霞等研究结果[16]相悖,其远缘杂交出现成活个体的机理仍有待进一步研究。
参考文献:
[1]焦长军,侯景军. 锦鲤的人工繁殖试验技术总结[J]. 黑龙江水产,2007(2):25.
[2]Streisinger G,Walker C,Dower N,et al. Production of clones ofhomozygous diploid zebra fish (Brachydanio rerio)[J]. Nature,1981,291(5813):293-296.
[3]攀连春. 雌核发育进行银鲫遗传育种新进展[J]. 生物学通报,1994,29(10):4-6.
[4]Gomelsky B,Cherfas N,Ben-Dom N,et al. Color inheritance in omanmental(Koi)carp(Cyprinus carpio L.)inferred from color variability in normal and gynogenetic progenies[J]. Israeli Journal ofAquaculture-Bamidgeh,1996,48(4):219-230.
[5]Gomelsky B,Cherfas N,Hulata G. Studies on the inheritance of black patch in omamental(koi)carp[J]. Israeli Journal of Aquaculture-Bamidgeh,1998,50(3):134-139.
[6]李冰霞,罗 琛. 热休克法抑制第一次卵裂实现草鱼雌核发育的细胞学观察[J]. 水生生物学报,2003,27(2):155-160.
[7]Sun Y D,Zhang C,Liu S J,et al. Induction of gynogenesis inJapanese crucian carp (Carassius cuvieri)[J]. Yi Chuan Xue Bao(Acta Genetica Sinica),2006,33(5):405-412.
[8]Liu S J,Sun Y D,Zhang C,et al. Production of gynogennetic progeny from allotetraploid hybrids red crucian carp×common carp[J].Aquaculture,2004,236(1/2/3/4):193-200.
[9]罗 琛,刘 筠. 人工诱导草鱼和鲫鱼雌核发育的研究[J]. 湖南师范大学自然科学学报,1991,14(2):154-159.
[10]梁拥军,孙向军,史东杰,等. 用团头鲂精子诱导红白锦鲤雌核发育研究[J]. 安徽农业科学,2010,38(29):16262-16265,16270.
[11]程汉良,潘黔生,马国文,等. 热休克诱导鲫鱼纯合雌核发育二倍体的研究[J]. 水利渔业,2005,25(3):25-27,81.
[12]李胜忠,陈 琳,杜劲松. 热休克诱导虹鳟二倍体雌核发育[J]. 动物学杂志,1997(05):8-10.
[13]王 云,刘少军,易 念,等. 雌核发育鲫鲤早期胚胎发育观察[J]. 湖南师范大学自然科学学报,2005,28(3):58-61.
[14]李思发. 中国主要淡水养殖鱼类种质研究[M]. 上海:上海科学技术出版社,1998:189-193.
[15]刘静霞,周 莉,魏丽华,等. 红白锦鲤人工雌核发育纯系的微卫星标记分析[J]. 水生生物学报,2003,27(6):557-562.
