维持性血液透析患者甲状腺功能、同型半胱氨酸与心血管病变的关系
2020-03-20李宏彬
李宏彬,梁 军
维持性血液透析(maintenance hemodialysis,MHD)是终末期肾脏病(end-stage renal disease,ESRD)患者最主要的治疗形式,国内接受MHD治疗的ESRD患者约占80%以上[1]。动脉粥样硬化是ESRD患者最常见的并发症之一,有研究显示ESRD患者出现颈动脉病变风险明显升高[2]。颈动脉内膜中膜厚度不仅是反映颈动脉病变的良好指标,还能较好地预测全身动脉粥样硬化病变情况。此外,ESRD患者多存在甲状腺激素合成、分泌及代谢异常,而甲状腺激素功能异常能明显影响心血管系统[3,4]。目前关于ESRD患者甲状腺功能与颈动脉病变和心功能间的关系研究报道尚少,本研究通过分析MHD患者甲状腺功能指标、同型半胱氨酸(Hcy)水平和颈动脉病变及心功能的关系,旨在深入了解MHD患者心血管疾病发生率高的原因,以期为临床干预提供依据,现报告如下。
1 对象与方法
1.1 对象 选取2017-01至2018-12在我院治疗的MHD患者70例,透析时间3个月以上,其中女28例,男42例;年龄29~75岁,平均(56.29±10.37)岁;透析龄5~71个月,平均(42.30±10.95)个月;慢性肾小球肾炎43例,痛风性肾病4例,梗阻性肾病3例,多囊肾2例,间质性肾炎3例,狼疮性肾炎2例,其他13例。纳入标准:(1)行MHD治疗3个月以上;(2)无原发性甲状腺疾病;(3)非高血压肾病患者;(4)本研究经伦理委员会批准且患者知情同意。排除标准:(1)既往有心肌梗死、脑血管病史者;(2)合并糖尿病者;(3)近期有使用含碘药物、β受体阻滞药等可能影响甲状腺功能的药物;(4)合并恶性肿瘤;(5)近1个月内有感染病史者。
1.2 方法 所有病例均采用一次性聚砜膜透析器行MHD治疗,采用碳酸氢盐透析液,4 h/次,3次/周,以动静脉内瘘或深静脉透析导管为血管通路进行透析,使用低分子肝素进行个体化抗凝。血流量为250~300 ml/min,透析液流量500 ml/min。
1.3 观察指标 收集记录患者临床资料;所有病例透析前,抽取清晨空腹静脉血10 ml,检测血常规、糖化血红蛋白、血脂、钙、磷、甲状腺功能指标[游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺素(TSH)]和Hcy水平。甲状腺功能测定使用电化学发光仪,Hcy水平检测使用荧光偏振免疫分析法,各指标正常值:FT33.1~6.8 pmol/L,FT412.0~22.0 pmol/L,TSH 0.27~4.20 mU/L,Hcy<15 μmol/L。
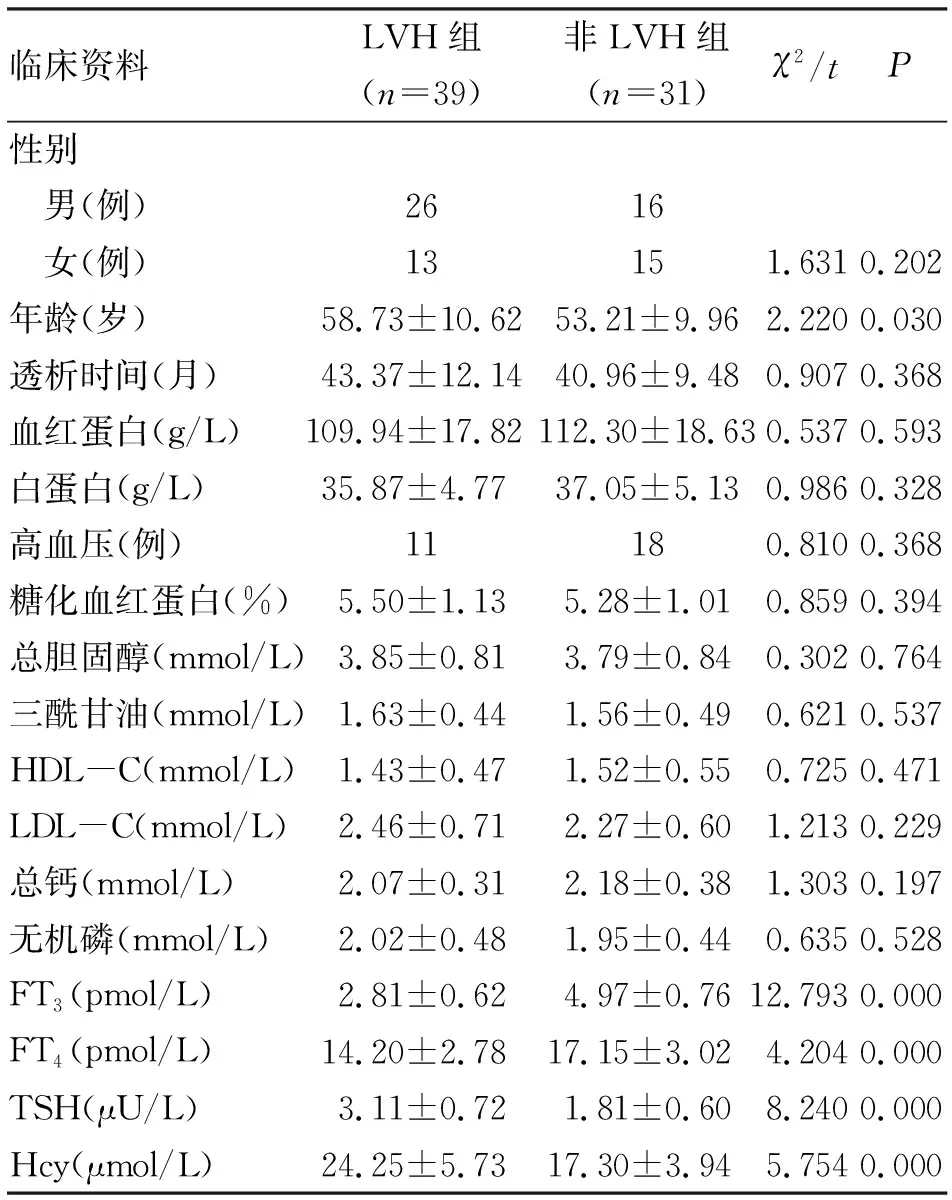
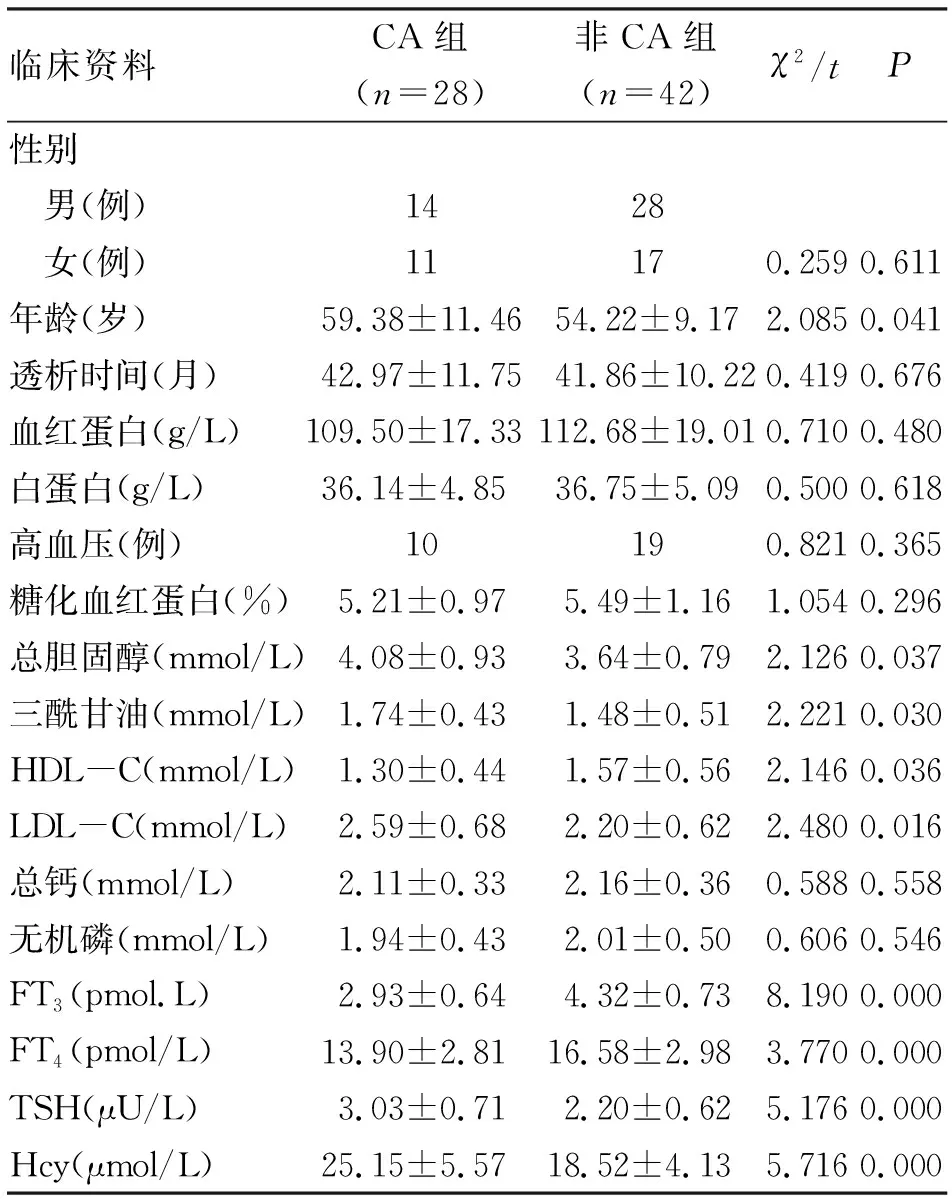
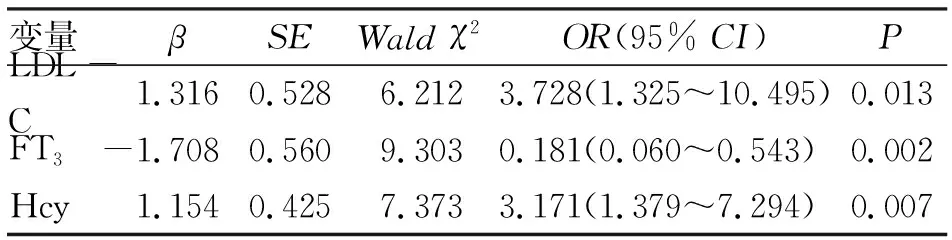
使用彩色多普勒超声仪测定左心室心肌质量指数(LVMI)、左室射血分数(LVEF)、左室舒张末期内径(LVEDD)及左室舒张早期和晚期最大血流速度比(E/A),以LVMI男性>131 g/m2,女性>100 g/m2诊断为左心室肥厚(left ventricular hypertrophy,LVH)[5]。颈动脉彩超测定MHD患者颈动脉内膜中膜(IMT),颈动脉IMT≥1.0 mm提示增厚,以1.0 mm 独立样本t检验;计数资料采用率表示,行χ2检验;多因素分析采用Logistic回归方程。所有检验均采用双侧检验,P<0.05为差异有统计学意义。 2.1 MHD患者甲状腺功能及血清Hcy水平情况 70例MHD患者中,甲状腺功能异常者共31例,占44.29%。血清Hcy水平平均(21.27±5.04)μmol/L,共51例(72.86%)血清Hcy水平高于正常值。 2.2 影响MHD患者左心室肥厚单因素和多因素分析 心脏超声检查结果显示,70例MHD患者中,其中39例(55.71%)伴有左心室肥厚。根据是否伴有左心室肥厚分为LVH组和非LVH组。对与MHD患者左心室肥厚相关因素进行单因素分析,结果提示年龄、FT3、FT4、TSH及Hcy与左心室肥厚相关(均P<0.05,表1)。将上述单因素分析有统计学意义的变量纳入多因素Logistic回归分析,结果提示FT3降低、Hcy升高是MHD患者左心室肥厚的独立危险因素(均P<0.05,表2)。 临床资料LVH组(n=39)非LVH组(n=31)χ2/tP性别 男(例)2616 女(例)13151.6310.202年龄(岁)58.73±10.6253.21±9.962.2200.030透析时间(月)43.37±12.1440.96±9.480.9070.368血红蛋白(g/L)109.94±17.82112.30±18.630.5370.593白蛋白(g/L)35.87±4.7737.05±5.130.9860.328高血压(例)11180.8100.368糖化血红蛋白(%)5.50±1.135.28±1.010.8590.394总胆固醇(mmol/L)3.85±0.813.79±0.840.3020.764三酰甘油(mmol/L)1.63±0.441.56±0.490.6210.537HDL-C(mmol/L)1.43±0.471.52±0.550.7250.471LDL-C(mmol/L)2.46±0.712.27±0.601.2130.229总钙(mmol/L)2.07±0.312.18±0.381.3030.197无机磷(mmol/L)2.02±0.481.95±0.440.6350.528FT3(pmol/L)2.81±0.624.97±0.7612.7930.000FT4(pmol/L)14.20±2.7817.15±3.024.2040.000TSH(μU/L)3.11±0.721.81±0.608.2400.000Hcy(μmol/L)24.25±5.7317.30±3.945.7540.000 表2 影响MHD患者左心室肥厚的多因素Logistic回归分析 2.3 影响MHD患者颈动脉粥样硬化(CA)的单因素和多因素分析 颈动脉超声结果显示,70例MHD患者中,28例(40.00%)存在颈动脉粥样硬化表现,根据是否伴有颈动脉粥样硬化分为CA组和非CA组。对与MHD患者颈动脉粥样硬化相关的因素进行单因素分析,结果提示年龄、总胆固醇、三酰甘油、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、FT3、FT4、TSH及Hcy与颈动脉粥样硬化有关(均P<0.05,表3)。将上述单因素分析有统计学意义的变量纳入多因素Logistic回归分析,结果提示LDL-C升高、FT3降低、Hcy升高是MHD患者颈动脉粥样硬化的独立危险因素(均P<0.05,表4)。 临床资料CA组(n=28)非CA组(n=42)χ2/tP性别 男(例)1428 女(例)11170.2590.611年龄(岁)59.38±11.4654.22±9.172.0850.041透析时间(月)42.97±11.7541.86±10.220.4190.676血红蛋白(g/L)109.50±17.33112.68±19.010.7100.480白蛋白(g/L)36.14±4.8536.75±5.090.5000.618高血压(例)10190.8210.365糖化血红蛋白(%)5.21±0.975.49±1.161.0540.296总胆固醇(mmol/L)4.08±0.933.64±0.792.1260.037三酰甘油(mmol/L)1.74±0.431.48±0.512.2210.030HDL-C(mmol/L)1.30±0.441.57±0.562.1460.036LDL-C(mmol/L)2.59±0.682.20±0.622.4800.016总钙(mmol/L)2.11±0.332.16±0.360.5880.558无机磷(mmol/L)1.94±0.432.01±0.500.6060.546FT3(pmol.L)2.93±0.644.32±0.738.1900.000FT4(pmol/L)13.90±2.8116.58±2.983.7700.000TSH(μU/L)3.03±0.712.20±0.625.1760.000Hcy(μmol/L)25.15±5.5718.52±4.135.7160.000 注:CA为颈动脉粥样硬化 表4 影响MHD患者颈动脉粥样硬化的多因素Logistic回归分析 ESRD患者表现为不可逆性肾功能损伤,需要进行肾脏替代治疗以维持生命功能。据报道,ESRD在总死亡率中居第11位[4],在我国有(200~300)万ESRD患者,且目前仍呈升高趋势。目前临床治疗ESRD的方法主要包括血液透析、腹膜透析及肾移植等,其中以MHD方案最为普遍[7]。报道显示,MHD患者具有相对较高的动脉粥样硬化发生风险,且同其他人群比较,发病年龄相对提前。心血管疾病是影响MHD患者长期生存的重要因素,其引起的死亡人数约占MHD总死亡人数的50%[8]。甲状腺功能与肾功能密切相关,肾脏参与包括甲状腺激素在内的众多激素的代谢和排泄过程。有研究显示,甲状腺功能异常发生率在慢性肾病患者较一般人群高,患者可伴有FT3水平降低[9]。本研究中,甲状腺功能异常的MDH患者占44.29%,主要表现为FT3水平降低,与上述研究结果类似。分析其原因可能为MHD患者体内毒素及各种细胞因子的累积抑制T4向T3转换,此外,MHD患者存在下丘脑-垂体-甲状腺轴功能障碍,这些因素均可能导致患者甲状腺功能异常。Hcy是蛋氨酸代谢的中间产物,血清Hcy水平异常可能与其合成、代谢相关酶系统异常有关。在MHD患者,肾小球滤过率下降,同时体内累积的尿素、肌酐等亦可能抑制Hcy代谢相关酶的活性,引起血清Hcy水平升高[10]。本研究中,51例(72.86%)MHD患者血清Hcy水平高于正常值。 心血管系统作为甲状腺激素的靶器官之一,对甲状腺激素具有较高的敏感性。MHD患者甲状腺功能的改变对其心血管疾病的发生具有重要影响。LVH是MHD患者常见的并发症之一,陈小妹等[11]研究纳入了71例病情稳定的MHD患者,发现患者入组时LVH发生率为30.99%,随访1年时上升至36.22%。LVH是终末期肾病患者出现心力衰竭的关键危险因素,本研究中有39例(55.71%)患者伴有左心室肥厚。多因素Logistic回归分析显示FT3降低、Hcy升高是MHD患者左心室肥厚的独立危险因素。Fragidis等[12]发现,在调整年龄、高血压、糖尿病、白蛋白及血肌酐等因素后,FT3降低是预测血液透析患者死亡的独立危险因素。研究指出血清Hcy水平与心肌纤维化和LVH密切相关,Hcy可通过氧化应激等多种途径引起血管壁重构,同时高Hcy水平还可引起低密度脂蛋白的沉积参与心血管疾病进展[13,14]。 颈动脉病变是MHD患者另一常见并发症,颈动脉IMT不仅可以反映颈动脉病变情况,还可以很好地反映全身动脉粥样硬化情况。本研究中28例(40.0%)患者伴有颈动脉粥样硬化,多因素Logistic回归分析显示LDL-C升高、FT3降低及Hcy升高是MHD患者颈动脉粥样硬化的独立危险因素。王维平等[6]发现,FT3降低与颈动脉粥样硬化密切相关,其还指出Hcy升高、CRP升高、FTT3降低是颈动脉粥样硬化的独立危险因素。本研究结果与其不同之处在于,LDL-C亦是MHD患者颈动脉粥样硬化的独立危险因素,这可能与其研究中患者血脂控制较好有关,削弱了血脂对患者颈动脉粥样硬化的影响。甲状腺功能异常时,血管内皮损伤加剧,此外FT3降低还可能通过刺激促炎性细胞因子,促进动脉粥样硬化进展[15]。Hcy水平升高可通过氧化应激等促进动脉粥样硬化发展,相关研究显示,MHD患者中,Hcy水平与颈动脉IMT、斑块形成及颈动脉粥样硬化明显正相关[16]。 总之,MHD患者较多伴有甲状腺功能异常及血清Hcy水平升高,同时甲状腺功能和Hcy水平异常与心功能和心脏结构改变、颈动脉病变相关。因此,对MHD患者应注意监测其甲状腺功能和血清Hcy水平。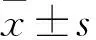
2 结 果
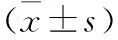

3 讨 论
