山羊源海藻糖比伯斯坦杆菌(Bibersteinia trehalosi)转铁结合蛋白B的克隆与功能鉴定
2020-03-13郭建华焦云娟霍溢徽段杨鑫婷何深宏任绍科罗献梅虞荣华程方俊西南大学动物科学学院重庆荣昌40460加拿大卡尔加里大学医学院阿尔伯塔卡尔加里TN4N
郭建华,焦云娟,霍溢徽,段杨鑫婷,何深宏,刘 威,任绍科,罗献梅,虞荣华,程方俊∗ (.西南大学 动物科学学院,重庆 荣昌40460;.加拿大卡尔加里大学 医学院,阿尔伯塔卡尔加里TN 4N)
铁因为参与了电子传递、DNA 合成、氧气输送、酶的辅酶等重要生理活动,广泛存在于几乎所有的从低等到高等的生物细胞中,没有铁就没有生命。铁虽然广泛存在地壳中,但在宿主动物体内,没有自由的铁供细菌利用,所以病原菌进化出一系列途径从宿主获得铁。一些巴氏杆菌科和奈氏菌科的细菌能产生转铁结合蛋白(transferrin binding protein,Tbp),Tbp进而“劫持”宿主转铁蛋白的铁,供细菌利用。转铁蛋白受体包含转铁结合蛋白A(transferrin binding protein A,Tbp A)和转铁结合蛋白B(transferrin binding protein B,Tbp B),一般认为TbpB先识别并结合转铁蛋白(transferrin,Tf),然后使转铁蛋白结合Tbp A,然后通过Tbp A 将转铁蛋白的铁传输到细菌的周质空间进而穿过内膜进入细菌[1-2]。相比脱铁转铁蛋白,Tbp B 对结合了铁的转铁蛋白有更强的结合力,这表明TbpB 在与转铁蛋白识别中占有更重要的角色[3-4]。
各种来源的TbpB 在结构上有保守性,与转铁蛋白一样,它也具有2个小叶组成:氨基端小叶(Nlobe)和羧基端小叶(C-lobe),其相对分子质量通常在60 000到100 000。Tbp B作为外膜蛋白,成为良好的疫苗设计靶点。目前的报道中,有的转铁蛋白的N-lobe和C-lobe均参与了与转铁蛋白受体的结合,如在牛卡它莫拉菌(Moraxella catarrhalis)Tbp B与牛转铁蛋白反应中,而在人的奈氏菌中是人转铁蛋白的C-lobe参与了与转铁蛋白受体B 的结合[5-6]。
海藻糖比伯斯坦杆菌(Bibersteinia trehalosi)为巴氏杆菌科比伯斯坦杆菌属。根据分解阿拉伯糖和海藻糖能力的不同,海藻糖比伯斯坦杆菌最初被分为溶血性巴氏杆菌T 生物型(Pasteurella haemolyticabiotypeT)[7-8]。该菌是引起山羊呼吸道疾病重要病原菌之一[7,9-10],通过生物信息学分析该菌含有转铁蛋白受体,但其克隆表达与功能鉴定还未见报道。本研究对分离自重庆荣昌的1株山羊源海藻糖比伯斯坦杆菌,对其TbpB序列分析的基础上,预测其结构模型,分别设计引物克隆、表达和纯化其完整蛋白(In-tact)、N-lobe、C-lobe蛋白,并通过与山羊转铁蛋白结合试验验证其功能,为下一步研究其铁吸收途径奠定基础。
1 材料与方法
1.1 菌株来源2018年4月重庆荣昌某山羊养殖场的羊只发病死亡,剖检可见肺部出血、坏死等病理变化。无菌采集肺脏接种于鲜血培养基中,37℃恒温培养24 h,分离纯化获得1株细菌命名为grc184。通过生理生化试验、16S r DNA、白细胞毒素蛋白、RNA 聚合酶β亚基序列分析等方法鉴定为海藻糖比伯斯坦杆菌(其结果另文发表)。
1.2 引物设计与PCR 扩增根据Tbp B 基因两边保守序列,设计引物进行PCR 扩增、测序,得到Tbp B全序列,进行结构模拟分析得到Tbp B N-lobe部分和C-lobe部分,设计引物分别扩增海藻糖比伯斯坦杆菌Tbp B20-581(In-tact)、N-lobe和C-lobe,引物序列如表1所示,引物下划线是引入的限制性酶切位点。

表1 本研究所用引物序列
1.3 序列特征与进化分析将序列转换成蛋白质序列后,再在NCBI检索溶血性曼氏杆菌、副猪嗜血杆菌(Haephilus parasuis)、猪胸膜肺炎放线杆菌、牛睡眠嗜血杆菌(Haemophilus somnus)、禽禽杆菌(Avibacterium avian)等TbpB,通过生物信息学软件MEGA6.0进行N-J系统发育树的构建。
1.4 结构模型预测通过SWISS 模型在线程序,以已经发表的猪胸膜肺炎放线杆菌Tbp B晶体结构为模板[1],进行海藻糖比伯斯坦杆菌TbpB 三维结构预测,保存为pdb格式。
1.5 克隆、表达与蛋白纯化取1μL 制备的菌株grc184基因组DNA 为模板(大约50 ng的DNA),已合成的3 对引物于相应的体系中分别在TaqDNA 聚合酶作用下进行扩增。PCR 扩增产物水解、T4连接酶连接、转化、鉴定按照文献[1,11]进行。质粒是经过改造的T7启动子p ET28a,组氨酸标签后面是麦芽糖结合蛋白(maltose binding protein,MBP)标签,接下来TEV 酶水解位点后面是连接试验需要克隆表达的目的蛋白。通过测序确认后转化于大肠杆菌ER2566感受态细胞中、涂板、菌落PCR 鉴定按照文献[11]进行。同时,将含有重组质粒的大肠杆菌接种于STUDIER FW 开发的培养基培养过夜表达目的蛋白,该培养基是1种免异丙基硫代半乳糖苷(IPTG)、可自动诱导的用于重组蛋白表达的专用培养基[12]。离心收集菌体,超声波破碎细胞,Ni-NTA 柱纯化蛋白(按照Ni-NTA 树脂蛋白纯化说明书操作,Ta KaRa)。
1.6 蛋白聚丙烯酰胺凝胶电泳将纯化得到的海藻糖比伯斯坦杆菌Tbp B20-581In-tact、N-lobe、C-lobe分离蛋白样品,同时将作为对照的副猪嗜血杆菌、牛睡眠嗜血杆菌、禽禽杆菌TbpB(以上均为带MBP的In-tact)与MBP SDS-聚丙烯酰胺凝胶100 V 电泳(浓度12%)1 h,凝胶经过考马斯亮蓝染色,照相保存图片。
1.7 HRP连接转铁蛋白将HRP 溶于无菌双蒸水中,使其质量浓度为4 g/L,加入0.2 m L 0.1mol/L的碘酸钠溶液,室温中搅拌20 min后透析除去多余的碘酸钠,用p H9.5的碳酸钠缓冲液调整其p H,加入-山羊转铁蛋白(实验室制备,未发表),室温下搅拌2 h,反应后的混合物经过葡聚糖凝胶过滤层析得到HRP-goat Tf。
1.8 转铁结合蛋白特异性结合点阵杂交试验将纯化的海藻糖比伯斯坦杆菌Tbp B 的In-tact、Nlobe、C-lobe连同实验室保存的猪胸膜肺炎放线杆菌Tbp B、牛睡眠嗜血杆菌Tbp B、禽禽杆菌Tbp B(以上均为带MBP 的In-tact)2μL 点于膜上(HApaper,Milipore),干燥20 min,将膜置于暗盒,加入15 m L 用TBS缓冲液配置的1%脱脂奶溶液,分别加入适量HRP-山羊转铁蛋白、HRP-绵羊转铁蛋白、HRP-猪转铁蛋白、HRP-牛转铁蛋白、HRP-鸡转铁蛋白,4℃震荡过夜后,加入HRP显色液,观察结果。
2 结果
2.1 海藻糖比伯斯坦杆菌Tbp B序列与进化分析
海藻糖比伯斯坦杆菌Tbp B 包含1 743碱基对,编码581个氨基酸,略长于猪胸膜肺炎放线杆菌Tbp B(528个氨基酸),但短于脑膜炎奈氏菌和禽禽杆菌Tbp B。海藻糖比伯斯坦杆菌Tbp B 与猪胸膜肺炎放线杆菌、脑膜炎奈氏菌、禽禽杆菌、副猪嗜血杆菌等TbpB的N-J进化树如图1所示。
从图1可以看出,我们分离海藻糖比伯斯坦杆菌菌株grc184 TbpB 与溶血性曼氏杆菌相似性最高,它们序列一致性约为85%。海藻糖比伯斯坦杆菌Tbp B与溶血性曼氏杆菌Tbp B展现了与其他菌株Tbp B较高的变异性。海藻糖比伯斯坦杆菌TbpB与禽禽杆菌TbpB 相似性最低,即亲缘关系最远。草食动物源的海藻糖比伯斯坦杆菌、溶血性曼氏杆菌、牛莫拉氏菌、睡眠嗜血杆菌Tbp B形成1个分支,区别与人源脑膜炎奈氏菌和猪源副猪嗜血杆菌、胸膜肺炎放线杆菌和猪放线杆菌Tbp B。

图1 海藻糖比伯斯坦杆菌TbpB N-J进化树
2.2 结构模型海藻糖比伯斯坦杆菌Tbp B蛋白三维结构模型显示如图2。跟已经发表的其他细菌的Tbp B类似,海藻糖比伯斯坦杆菌Tbp B蛋白仍然是双叶组成的:N-lobe 和C-lobe。图中上面黄色是C-lobe,下面蓝色是N-lobe。绿色穿过了C-lobe的线状结构是该蛋白的N 末端,大约60个氨基酸残基,这60个氨基酸称为锚定(anchor)结构,Tbp B靠这部分结构插入细菌的外膜。C-lobe包含744碱基对,编码248个氨基酸。N-lobe大约包含999碱基对,编码333个氨基酸。每个小叶有8条折叠链肽段组成β筒。
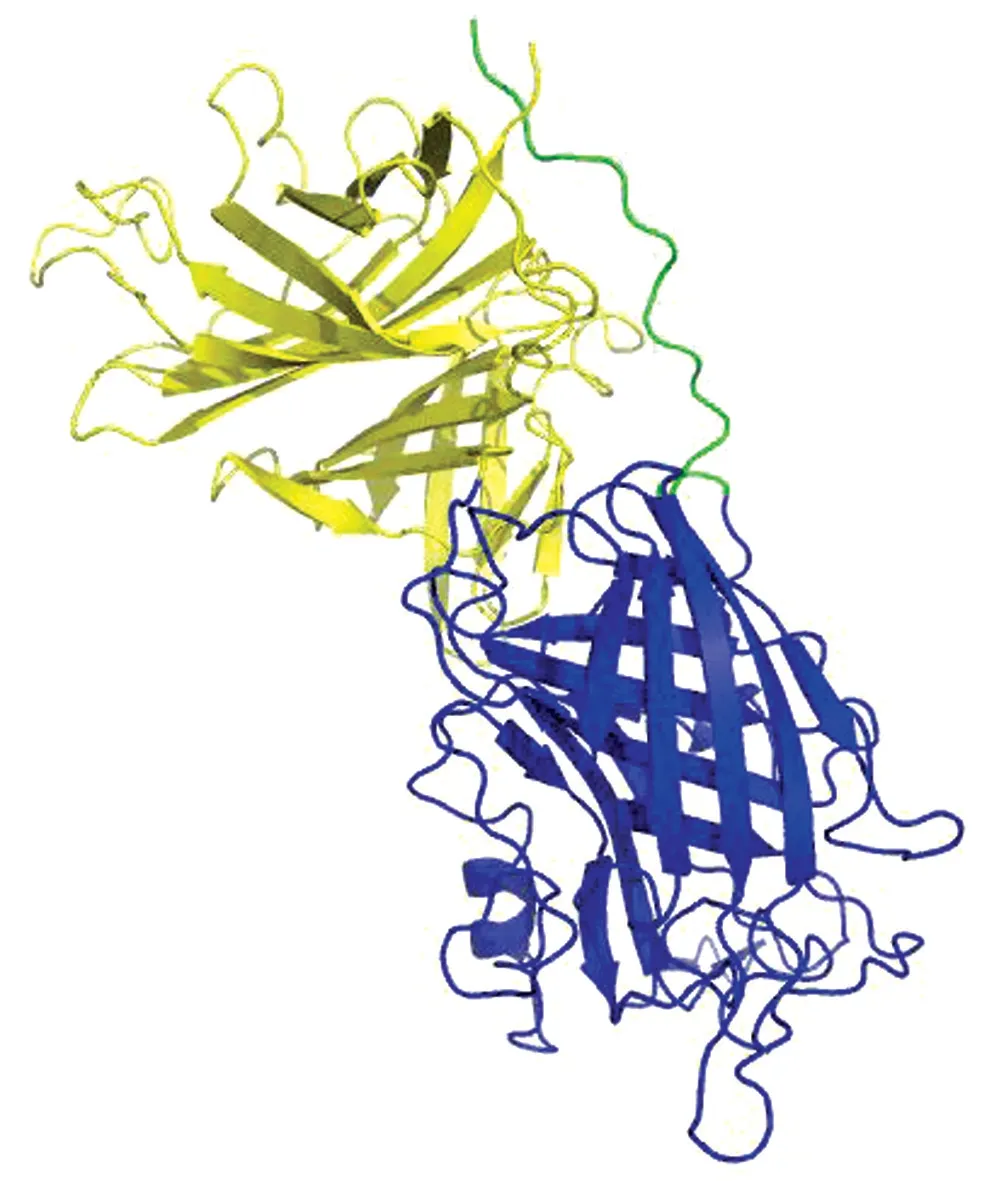
图2 海藻糖比伯斯坦杆菌TbpB 预测结构模型
2.3 蛋白克隆与表达、纯化本研究中克隆的海藻糖比伯斯坦杆菌TbpB20-581In-tact是20~581位氨基酸,N-lobe是20~333位氨基酸,C-lobe是333~581位氨基酸,将表达出的海藻糖比伯斯坦杆菌Tbp B20-581In-tact、N-lobe、C-lobe进行SDS-PAGE,为了使蛋白更稳定,组氨酸后面有MBP,所以电泳结果是TbpB20-581In-tact、N-lobe、C-lobe分别再加MBP(约42 000)。电泳结果如图3所示。从图3可以看出Tbp B20-581In-tact加MBP 大小是106 000,TbpB N-lobe加MBP 大小约是74 000,TbpB Clobe加MBP大小约是68 000,均符合预期大小。

图3 海藻糖比伯斯坦杆菌TbpB20-581 In-tact、N-lobe、C-lobe蛋白电泳图 M.蛋白质相对分子质量Marker,1~3.分别为海藻糖比伯斯坦杆菌TbpB20-581 In-tact、Nlobe、C-lobe;4~7.分别为副猪嗜血杆菌TbpB、禽禽杆菌TbpB、牛睡眠嗜血杆菌TbpB和MBP作为对照

图4 海藻糖比伯斯坦杆菌TbpB In-tact、N-lobe、C-lobe转铁蛋白结合点阵斑点图 A.海藻糖比伯斯坦杆菌TbpB20-581 In-tact;B.海藻糖比伯斯坦杆菌TbpB N-lobe;C.海藻糖比伯斯坦杆菌TbpB C-lobe;D.副猪嗜血杆菌TbpB;E.禽禽杆菌TbpB;F.牛睡眠嗜血杆菌TbpB;G.MBP
2.4 特异性鉴定加入HRP 显色液室温反应15 min 后,从图4可以看出,海藻糖比伯斯坦杆菌Tbp B In-tact、N-lobe 均能与山羊转铁蛋白(goat transferrin,goat Tf)、绵羊转铁蛋白(sheep tansferrin,sheep Tf)反应,但与猪转铁蛋白(porcine transferring,porcine Tf)、鸡转铁蛋白(chicken Tf,chicken Tf)均不能反应。而海藻糖比伯斯坦杆菌TbpB的C-lobe不能与山羊转铁蛋白反应,也不能与猪转铁蛋白、牛转铁蛋白和鸡转铁蛋白反应。作为对照的副猪嗜血杆菌、牛睡眠嗜血杆菌、禽禽杆菌Tbp B 均能与各自宿主转铁蛋白结合。MBP 不能与所有的转铁蛋白有结合反应。同时我们也注意到,海藻糖比伯斯坦杆菌Tbp B In-tact、N-lobe与牛转铁蛋白(bovine transferring,bovine Tf)有交叉反应,牛睡眠嗜血杆菌TbpB 与山羊和绵羊转铁蛋白也有弱交叉反应,这在一些其他牛病原菌如溶血性巴氏杆菌(Pasteurella haemolytica)也有报道:既能与牛的转铁蛋白反应,也能与山羊转铁蛋白反应[13]。
3 讨论
一些细菌的转铁结合蛋白B 是暴露于细菌外膜的蛋白,因为是一个良好设计疫苗的抗原靶点,引起广泛的研究兴趣[14],本研究在山羊源海藻糖比伯斯坦杆菌中克隆与鉴定了TbpB,证明了该菌具备转铁蛋白受体的铁吸收系统,推测该菌可以在铁缺乏环境中表达Tbp B,“劫持”宿主的铁,为后面开发以Tbp B为靶点的山羊源海藻糖比伯斯坦杆菌亚单位疫苗研发提供了理论依据。在本研究中,该菌TbpB结构模型包含了N-lobe 和C-lobe,显示了Tbp B三级结构的保守性[15]。
本研究首次克隆了海藻糖比伯斯坦杆菌Tbp B并鉴定其功能。克隆了海藻糖比伯斯坦杆菌TbpB全长蛋白、N-lobe和C-lobe。载体采用T7 启动子系统,组氨酸标签后面加上MBP,可以提高表达的产量和稳定性。在我们研究中也发现,如果不带MBP,Tbp B产量较低,且容易水解。在后期疫苗开发中,也可以在克隆中先表达MBP融合蛋白,再用TEV 酶水解。在克隆试验中,TbpB In-tact是去除了前面19个氨基酸,这也是为了让表达的蛋白更稳定,因为在克隆不去除氨基酸的全长Tbp B时,纯化过程中不能得到稳定的足够目的蛋白。
点阵杂交试验可以很方便地检测蛋白之间相互作用,特异性和敏感性都很高。本研究中,点阵杂交试验可以用来检测克隆纯化的目标蛋白能否与转铁蛋白发生特异性结合反应,为了防止假阴性结果的产生,在进行该试验时需要同时SDS-PAGE 电泳检测蛋白质,同时使用其他细菌转铁蛋白受体作为对照。在本研究中,海藻糖比伯斯坦杆菌Tbp B的Intact和N-lobe均能与山羊转铁蛋白特异结合,而Clobe不能与山羊转铁蛋白特异结合,证明了海藻糖比伯斯坦杆菌这个基因编码的蛋白可能参与了铁的传递,而且与山羊转铁蛋白结合的位点在N-lobe上,这与相关报道是一致的[1]。而C-lobe不参与铁的传递。我们可以同时发现,海藻糖比伯斯坦杆菌TbpB也能与牛转铁蛋白发生弱交叉反应,在有些草食动物来源的细菌转铁蛋白受体中也发现类似现象,如导致牛红眼病的牛溶血性巴氏杆菌(Pasteurella haemolytica)[13],这也在提示我们,可能开发同时免疫多种动物的基于转铁蛋白受体的亚单位疫苗。
