莰烯醛O-取代肟的合成及其抗肿瘤活性
2020-03-09刘辰婧罗金岳
黄 静,刘辰婧,罗金岳
(南京林业大学 化学工程学院,江苏 南京 210037)
中国作为松节油产量大国,松节油深加工得到的产品如松油醇、冰片、樟脑等在中国各个行业中都有广泛的用途,由于中国研究利用松节油较晚,开发的高附加值产品较少,需要进一步对其进行深加工利用;而莰烯作为松节油异构化反应的主要产物[1],其精深加工利用也十分广泛[2-3]。肟及肟醚类化合物具有杀虫[4]、灭菌[5]、抗病毒[6]以及抗肿瘤[7]等优良生物活性,同时具有高效、低毒以及低残留等优点,在医药应用方面具有很大的发展前景[8-9]。肟醚类化合物主要有两种合成方法:一种为常见的合成肟醚方法,即醛或酮直接或间接合成[10-11];另一种为亚甲基氧化法制备肟醚[12]。陈玉等[13]以邻羟基苯甲醛、丙酮以及2-噻吩甲醛为原料,利用活性基团拼接原理,在1,4-戊二烯-3-酮结构中引入肟醚基团,合成了一系列具有抗烟草花叶病毒(TMV)活性的酮肟醚衍生物。Jindal等[14]使用甾体肟合成了一系列雄甾烷类化合物,发现具有肟醚结构的化合物对结肠癌细胞(SW-620)以及肝癌细胞(NCI-H23)等有明显抗肿瘤活性。本研究利用自制的莰烯衍生物莰烯醛肟[15]为原料,在催化剂四丁基溴化铵与氢氧化钠提供的碱性条件下,与卤代烷进行烷基化反应得到9个未见文献报道的肟醚类化合物,并考察了化合物对肝癌细胞HepG2和乳腺癌细胞MCF7的抗肿瘤活性。
1 实 验
1.1 主要试剂与仪器
2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛肟(莰烯醛肟),质量分数≥98%,自制;氯化苄、溴代正丁烷、 1,4-二氯丁烷、3-溴溴苄、 2,6-二氯苄基氯、邻氟氯苄、 4-氰基苄氯、 4-叔丁基苄氯、 4-氯苄基氯、N,N-二甲基甲酰胺(DMF)、二甲亚砜(DMSO)、甲苯、乙腈(ACN)、四丁基溴化铵(TBABr)和四氢呋喃(THF),均为市售分析纯,未做任何处理直接使用。层析硅胶(54~74 μm)、硅胶板(GF-254)均购于青岛康业馨药硅胶干燥剂有限公司。DMEM高糖培养基购于美国GIBCO公司。
GC-7890A气相色谱(GC)分析仪、7890-A-5975C气相色谱-质谱联用(GC-MS)仪均为美国Aglient公司;Nicolet 380红外光谱(FT-IR)仪,美国赛默飞世尔科技公司;Bruker 300 MHz/500 MHz核磁共振波谱(NMR)仪,瑞士Bruker公司。
1.2 莰烯醛O-取代肟的合成
在50 mL的圆底烧瓶中加入1 mmol莰烯醛肟,2 mmol 25%氢氧化钠溶液和10 mL甲苯,并加入一定量的卤代烃和四丁基溴化铵,一定温度下磁力搅拌。反应结束后,冷却,分液,依次用饱和碳酸氢钠、15%氨水洗涤两次,洗涤后的有机层用无水氯化钠干燥,过滤,减压浓缩,使用石油醚/乙酸乙酯(体积比15 ∶1)为淋洗剂,将粗产物经柱层析纯化,再经真空干燥得到目标产物2a~2i。合成路线如图1所示:
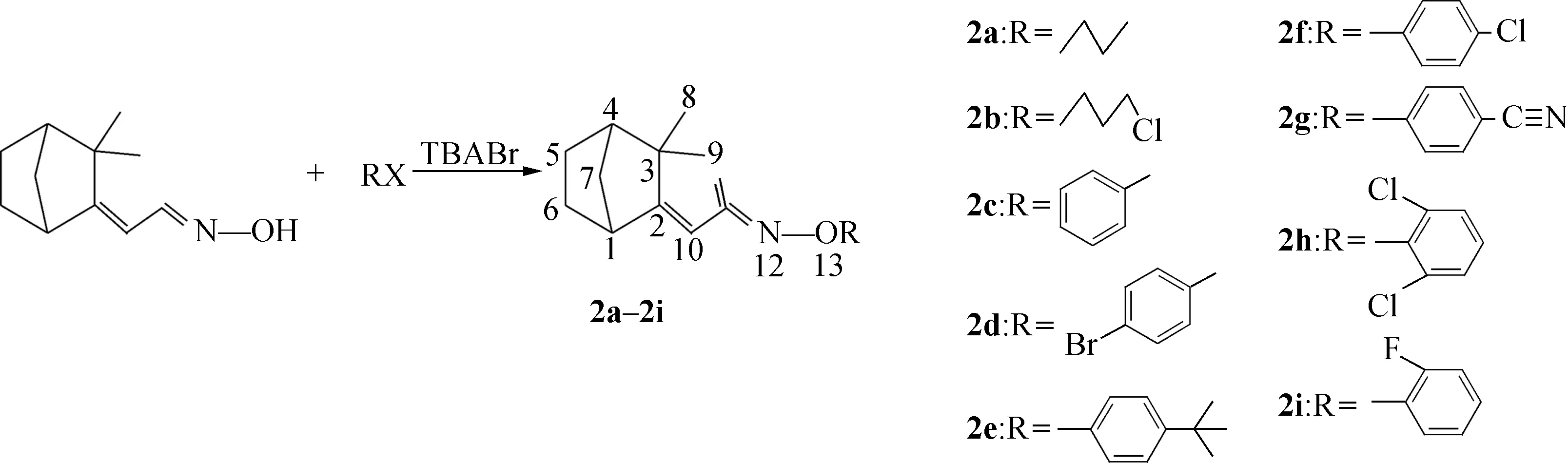
图1 2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-取代肟的合成路线
以合成目标化合物2a为例,探索了不同溶剂、四丁基溴化铵用量、氯化苄用量、反应温度以及反应时间等因素对合成2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-苄基肟得率的影响。
1.3 抗肿瘤活性测试
选取对数生长期的肝癌细胞HepG2和乳腺癌细胞MCF7制成细胞悬液,浓度为106个/mL,分别在两种菌的96孔板上每个孔接种100 μL,在36个边缘孔中每孔加入100 μL的磷酸盐缓冲液(PBS)。培养24 h,使细胞贴壁。然后吸去旧培养基,分别加入100 μL的100、50和25 mg/L质量浓度的DMEM培养基。每个浓度设置3个复孔,另设空白对照和依托泊甙阳性对照组。48 h后,每孔中加入10 μL 噻唑蓝(MTT)溶液,继续在培养箱中孵育,4 h后,吸去培养液,每孔加入100 μL DMSO,振荡9 min,在波长570 nm的条件下用酶标仪测定每孔的吸光值并计算细胞生长抑制率,采用改良寇式法计算IC50值,公式如下:
IC50=lg-1[Xm-i(∑P-0.5)]
式中:Xm—设计的最大浓度的对数值;i—相邻两组浓度对数值; ∑P—各组生长抑制率之和; 0.5—经验常数。
2 结果与讨论
2.1 产物结构表征
通过莰烯醛肟与卤代物进行亲核取代反应,合成了9个2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-取代肟类化合物,对化合物2a~2i进行了结构表征。
化合物2a:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-苄基肟(C18H23NO),无色油状液体,得率84.1%。FT-IR(ν/cm-1):2959.57, 1653.64, 1457.00, 1019.37, 737.70, 698.27。GC-MS:m/z=269。1H NMR (500 MHz, CDCl3)δ:8.05 (d,J=10.4 Hz, 1H, C11—H), 7.39 (s, 2H, C16—H,C20—H), 7.36 (t,J=7.6 Hz, 2H, C17—H, C19—H), 7.30 (t,J=7.0 Hz, 1H, C18—H), 5.75 (d,J=10.4 Hz, 1H, C10—H), 5.09 (s, 2H, C14—H), 3.11 (d,J=4.5 Hz, 1H, C11—H), 1.96 (s, 1H, C4—H), 1.70~1.44 (m, 4H, C5—H, C6—H), 1.31~1.20 (m, 2H, C7—H), 1.08 (s, 3H, C8—H), 1.05 (s, 3H, C9—H)。13C NMR (125 MHz,CDCl3)δ:169.03, 149.25, 137.69, 128.41, 128.27, 127.85, 109.37, 75.91, 47.59, 43.25, 42.27, 37.42, 28.51, 28.08, 25.37, 23.67。
化合物2b:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-丁基肟(C15H25NO),无色油状液体,得率70.7%。FT-IR(ν/cm-1):2959.00, 1654.72, 1462.65, 1035.53, 943.69, 743.35。GC-MS:m/z=235。1H NMR(500 MHz, CDCl3)δ: 7.99 (d,J=10.4 Hz, 1H, C11—H), 5.76 (d,J=10.4 Hz, 1H, C10—H), 4.07 (t,J=6.7 Hz, 2H, C14—H), 3.15 (d,J=4.6 Hz, 1H, C1—H), 1.99 (d,J=2.3 Hz, 1H, C4—H), 1.77~1.72(m, 2H, C5—H), 1.72~1.68 (m, 2H, C6—H), 1.66~1.46 (m, 2H, C7—H), 1.44 (q,J=7.5, 6.7 Hz, 2H, C15—H), 1.33~1.24 (m, 2H, C16—H), 1.11 (s, 3H, C8—H), 1.08 (s, 3H, C9—H), 0.97 (t,J=7.4 Hz, 3H, C17—H)。13C NMR (125 MHz,CDCl3)δ: 168.26, 148.39, 109.56, 73.63, 47.59, 43.17, 42.21, 37.42, 31.17, 28.53, 28.08, 25.37, 23.67, 19.15, 13.88。
化合物2c:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(4-氯丁基) 肟(C15H24ClNO),无色油状液体,得率63.9%。FT-IR(ν/cm-1):2959.29, 2872.18, 1652.76, 1061.31, 944.39, 649.16。GC-MS:m/z=269。1H NMR(500 MHz, CDCl3)δ:7.94 (d,J=10.4 Hz, 1H, C11—H), 5.71(d,J=10.4 Hz, 1H, C10—H), 4.06(t,J=6.2 Hz, 2H, C17—H), 3.56 (t,J=6.5 Hz, 2H, C14—H), 3.11 (d,J=4.6 Hz, 1H, C1—H), 1.95 (d,J=2.0 Hz, 1H, C4—H), 1.90~1.86 (m, 2H, C16—H), 1.82 (t,J=6.2 Hz, 2H, C5—H), 1.69~1.43(m, 4H, C6—H, C7—H), 1.30~1.18 (m, 2H, C15—H), 1.06 (s, 3H, C8—H), 1.04 (s, 3H, C9—H)。13C NMR (125 MHz,CDCl3)δ:168.74, 148.71, 109.37, 72.79, 47.58, 44.79, 43.21, 42.24, 37.42, 29.32, 28.52, 28.09, 26.55, 25.36, 23.66。
化合物2d:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(3-溴苄基) 肟(C18H22BrNO),淡黄色液体,得率72.3%。FT-IR(ν/cm-1):2959.20, 2870.35, 1653.40, 1465.63, 1020.87, 940.75, 698.48。GC-MS:m/z=347。1H NMR(500 MHz, CDCl3)δ:8.08 (d,J=10.4 Hz, 1H, C11—H), 7.58 (s, 1H, C18—H), 7.47 (d,J=7.9 Hz, 1H, C16—H), 7.34 (d,J=7.6 Hz, 1H, C20—H), 7.26 (t,J=7.7 Hz, 1H, C19—H), 5.77 (d,J=10.4 Hz, 1H, C10—H), 5.08 (s, 2H, C14—H), 3.16 (d,J=4.6 Hz, 1H, C1—H), 2.01 (s, 1H, C4—H), 1.75 (t,J=4.6 Hz, 2H, C5—H), 1.52~1.44 (m, 2H, C6—H), 1.36 (d,J=9.7 Hz, 2H, C7—H), 1.12 (s, 3H, C8—H), 1.09 (s, 3H, C9—H)。13C NMR (125 MHz,CDCl3)δ:169.43, 149.55, 140.24, 131.06, 130.83, 129.95, 126.58, 122.53, 109.19, 74.85, 47.57, 43.28, 42.28, 37.42, 28.50, 28.08, 25.36, 23.66。
化合物2e:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(4-叔丁基苄基) 肟(C22H31NO),白色固体,m.p.93.6~94.0 ℃,得率65.9%。FT-IR(ν/cm-1):2960.40, 1653.53, 1462.56, 1014.10, 940.28, 641.83。GC-MS:m/z=325。1H NMR(500 MHz, CDCl3)δ:8.09 (d,J=10.4 Hz, 1H, C11—H), 7.44 (d,J=8.3 Hz, 2H, C17—H, C19—H), 7.38 (d,J=8.3 Hz, 2H, C16—H, C20—H), 5.80 (d,J=10.4 Hz, 1H, C10—H), 5.11 (s, 2H, C14—H), 3.15 (d,J=4.6 Hz, 1H, C1—H), 2.01 (d,J=2.6 Hz, 1H, C4—H), 1.75~1.52(m, 4H, C5—H, C6—H), 1.38 (d,J=1.3 Hz, 9H, C22—H, C23—H, C24—H), 1.34~1.2 2(m, 2H, C7—H), 1.13 (s, 3H, C8—H), 1.10 (s, 3H, C9—H)。13C NMR (125 MHz,CDCl3)δ:168.85, 150.87, 149.15, 134.57, 128.17, 127.87, 125.39, 125.29, 109.46, 75.79, 47.61, 43.25, 42.26, 37.44, 34.58, 31.38, 28.56, 28.09, 25.39, 23.68。
化合物2f:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(4-氯苄基) 肟(C18H22ClNO),无色油状液体,得率70.3%。FT-IR(ν/cm-1):2958.77, 1653.48, 1491.97, 1089.83, 943.81, 801.22, 646.81。GC-MS:m/z=303。1H NMR (500 MHz, CDCl3)δ:8.02 (d,J=10.4 Hz, 1H, C11—H), 7.32 (s, 4H, C16—H, C17—H, C19—H, C20—H), 5.72 (d,J=10.4 Hz, 1H, C10—H), 5.04 (s, 2H, C14—H), 3.11 (d,J=4.4 Hz, 1H, C1—H), 1.95 (s, 1H, C4—H), 1.73~1.45 (m, 4H, C5—H, C6—H), 1.30~1.20 (m, 2H, C7—H), 1.07 (s, 3H, C8—H), 1.04 (s, 3H, C9—H)。13C NMR (125 MHz, CDCl3)δ:169.32, 149.45, 136.36, 133.64, 129.55, 128.57, 109.23, 74.96, 47.57, 43.27, 42.27, 37.42, 28.50, 28.08, 25.36, 23.66。
化合物2g:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(4-氰基苄基) 肟(C19H22N2O),淡黄色油状液体,得率67.6%。FT-IR(ν/cm-1):2960.08, 2228.73, 1652.47, 1057.09, 901.88, 704.16;GC-MS:m/z=294。1H NMR (500 MHz, CDCl3)δ:8.08 (d,J=10.4 Hz, 1H, C11—H), 7.67 (d,J=7.9 Hz, 2H, C17—H, C19—H), 7.50 (d,J=7.8 Hz, 2H, C16—H, C20—H), 5.73 (d,J=10.4 Hz, 1H, C10—H), 5.14 (s, 2H, C14—H), 3.16 (s, 1H, C1—H), 1.99 (s, 1H, C4—H), 1.74~1.45 (m, 4H, C5—H, C6—H), 1.35~1.22 (m, 2H, C7—H), 1.10 (s, 3H, C8—H), 1.07 (s, 3H, C9—H)。13C NMR (125 MHz, CDCl3)δ:169.83, 149.78, 143.60, 132.14, 128.19, 118.74, 111.42, 108.94, 74.49, 47.49, 43.26, 42.25, 37.37, 28.43, 28.04, 25.29, 23.59。
化合物2h:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(2,6-二氯苄基)肟(C18H21Cl2NO),黄色油状液体,得率52.7%。FT-IR(ν/cm-1):2960.49, 1653.24, 1436.85, 1027.03, 934.16, 74.00, 634.35。GC-MS:m/z=338。1H NMR(500 MHz, CDCl3)δ:8.02 (d,J=10.4 Hz, 1H, C11—H), 7.35 (d,J=8.0 Hz, 2H, C17—H, C19—H), 7.20 (d,J=8.5 Hz, 1H, C18—H), 5.76 (d,J=10.4 Hz, 1H, C10—H), 5.40 (d,J=14.6 Hz, 2H, C14—H), 3.11 (d,J=4.5 Hz, 1H, C1—H), 1.96 (d,J=2.0 Hz, 1H, C4—H), 1.73~1.44 (m, 4H, C5—H, C6—H), 1.30~1.21 (m, 2H, C7—H), 1.09 (s, 3H, C8—H), 1.06 (s, 3H, C9—H)。13C NMR (125 MHz, CDCl3)δ: 169.22, 149.46, 147.02, 137.22, 132.54, 130.10, 128.37, 109.32, 105.23, 70.15, 47.60, 43.26, 42.29, 37.42, 28.51, 28.04, 25.37, 23.67。
化合物2i:2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-(邻氟苄基)肟(C18H22FNO),淡黄色油状液体,得率63.4%。FT-IR(ν/cm-1):2961.55, 1653.79, 1458.47, 1023.21, 941.81, 756.79, 704.89。GC-MS:m/z=287。1H NMR (500 MHz,CDCl3)δ:8.08 (d,J=10.4 Hz, 1H, C11—H), 7.49 (d,J=7.6 Hz, 1H,C18—H), 7.33 (d,J=5.0 Hz, 1H, C17—H), 7.18 (s, 1H, C20—H), 7.10 (s, 1H, C19—H), 5.78 (d,J=10.4 Hz, 1H, C10—H), 5.20 (d,J=1.3 Hz, 2H, C14—H), 3.15 (d,J=4.6 Hz, 1H, C1—H), 2.00 (d,J=2.2 Hz, 1H, C4—H), 1.74~1.48(m, 4H, C5—H, C6—H), 1.35~1.22 (m, 2H, C7—H), 1.12 (s, 3H, C8—H), 1.09 (s, 3H, C9—H)。13C NMR (125 MHz, CDCl3)δ:169.18, 161.94, 149.40, 146.61, 130.66, 124.00, 115.24, 109.30, 105.16, 69.43, 47.59, 43.53, 43.26, 42.27, 37.42, 28.51, 28.07, 25.36, 23.66。
2.2 合成条件优化
2.2.1溶剂种类的影响 加入莰烯醛肟1 mmol,氯化苄用量为n(莰烯醛肟) ∶n(氯化苄)=1.0 ∶1.2,2 mmol 25%NaOH溶液,四丁基溴化铵0.1 mmol,反应温度为60 ℃,反应时间22 h,加入20 mL反应溶剂,在此条件下反应的转化率及选择性如表1所示。

表1 溶剂种类对产物的影响
由表1可以看出,溶剂效应对肟生成肟醚的反应速度会产生很大的影响,在DMF、DMSO以及ACN这些极性非质子性溶剂中反应得率也具有一定差异,其中当溶剂为ACN时,产物得率最低为56.67%,溶剂为DMSO时,反应得率最高为71.63%。THF和甲苯这些低极性溶剂,对产物得率的影响也不同,其中甲苯作溶剂时,莰烯醛肟的转化率较高。考虑到产物的纯化及经济效果,选择甲苯作为溶剂较好。
2.2.2催化剂用量的影响 加入莰烯醛肟1 mmol,氯化苄用量为n(莰烯醛肟) ∶n(氯化苄)=1.0 ∶1.2,2 mmol 25% NaOH溶液,一定量的四丁基溴化铵,反应温度为60 ℃,反应时间22 h,20 mL甲苯,在此条件下反应的转化率及选择性如图2所示。
由图2可知,随着四丁基溴化铵用量的不断增加,目标产物的得率在四丁基溴化铵用量为0.10 mmol 时达到最高,当四丁基溴化铵用量逐渐再增加时,目标产物的得率趋于下降,可能是反应体系中水较少,不能完全溶解。因此,催化剂四丁基溴化铵用量为0.10 mmol较为合适。
2.2.3氯化苄用量的影响 加入莰烯醛肟1 mmol,一定量的氯化苄,2 mmol 25% NaOH溶液,四丁基化铵用量为0.10 mmol,反应温度为60 ℃,反应时间22 h,20 mL甲苯,在此条件下反应的转化率及选择性如图3所示。
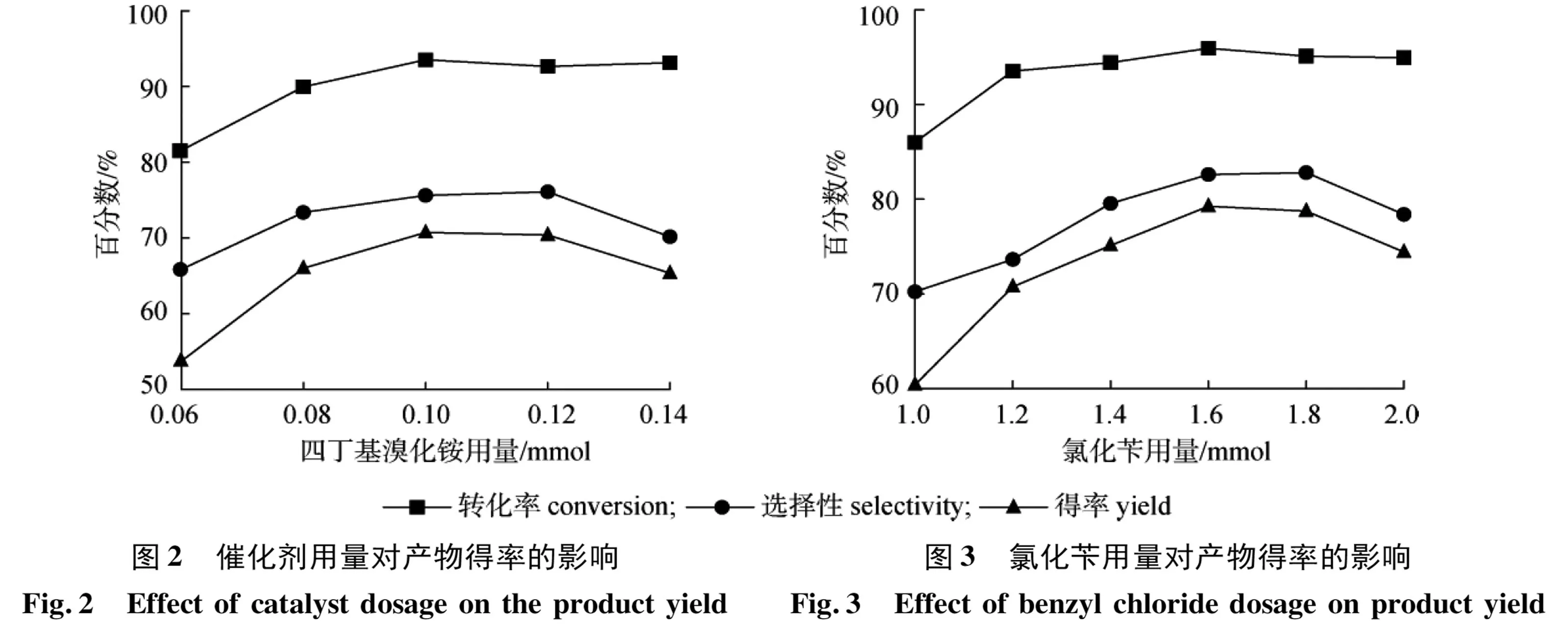
由于氯化苄比较便宜、易得,为提高莰烯醛肟的转化率,采用氯化苄过量进行反应。从图3可知,在氯化苄的用量为1.6 mmol时,目标产物的得率最大为79.24%,之后随着氯化苄用量的增加,莰烯醛肟的转化率趋向稳定,但反应的选择性则逐渐降低。因此,氯化苄用量为1.6 mmol较为合适。
2.2.4反应温度的影响 加入莰烯醛肟1 mmol,氯化苄和四丁基溴化铵的用量为n(莰烯醛肟) ∶n(氯化苄) ∶n(四丁基溴化铵)=1.0 ∶1.6 ∶0.1,2 mmol 25%NaOH溶液,反应时间22 h,加入20 mL甲苯溶剂,在不同反应温度下反应的转化率及选择性如表2所示。
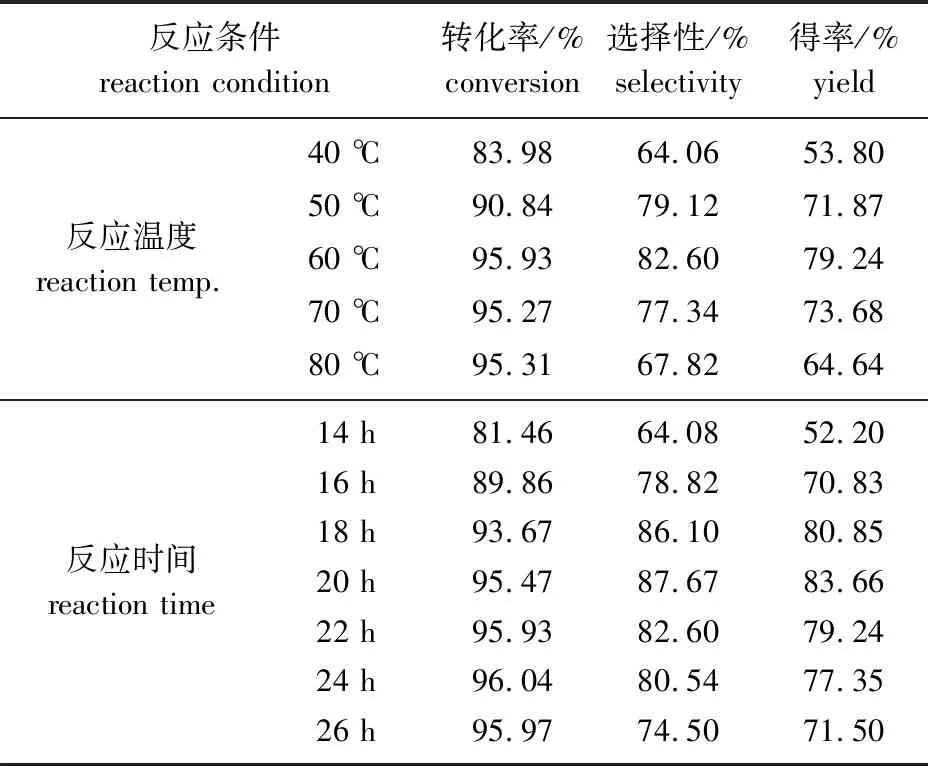
表2 反应条件对产物的影响
由表2可见,在40~60 ℃范围内,随着温度的升高,莰烯醛肟的转化率和产物的选择性不断提高,产物的得率也在提高,当温度达到60 ℃时,产物的得率达到最高为79.24%,在60 ℃后产物的选择性开始明显的降低,这是因为随着温度的升高,副产物硝酮的得率升高,从而导致目标产物得率下降。因此选60 ℃作为反应的适宜温度。
2.2.5反应时间的影响 加入莰烯醛肟1 mmol,氯化苄和四丁基溴化铵的用量为n(莰烯醛肟) ∶n(氯化苄) ∶n(四丁基溴化铵)=1.0 ∶1.6 ∶0.1,反应温度60 h,加入20 mL甲苯溶剂,在不同反应时间下反应的转化率及选择性数据见表2。
由表2所示,14~20 h范围内随着反应时间的不断增加,莰烯醛肟的转化率和产物的选择性不断提高。反应20 h后,原料的转化率趋于稳定,但产物的选择性在20 h时最高,此时反应得率最大为83.66%;20 h后延长反应时间,产物的选择性明显下降,可能是莰烯醛肟发生副反应生成硝酮。因此反应时间为20 h最合适。
2.2.6正交试验优化 在单因素试验基础上固定溶剂为甲苯,选择了较有代表性的4个因素进行L9(34)正交试验,其结果如表3所示。
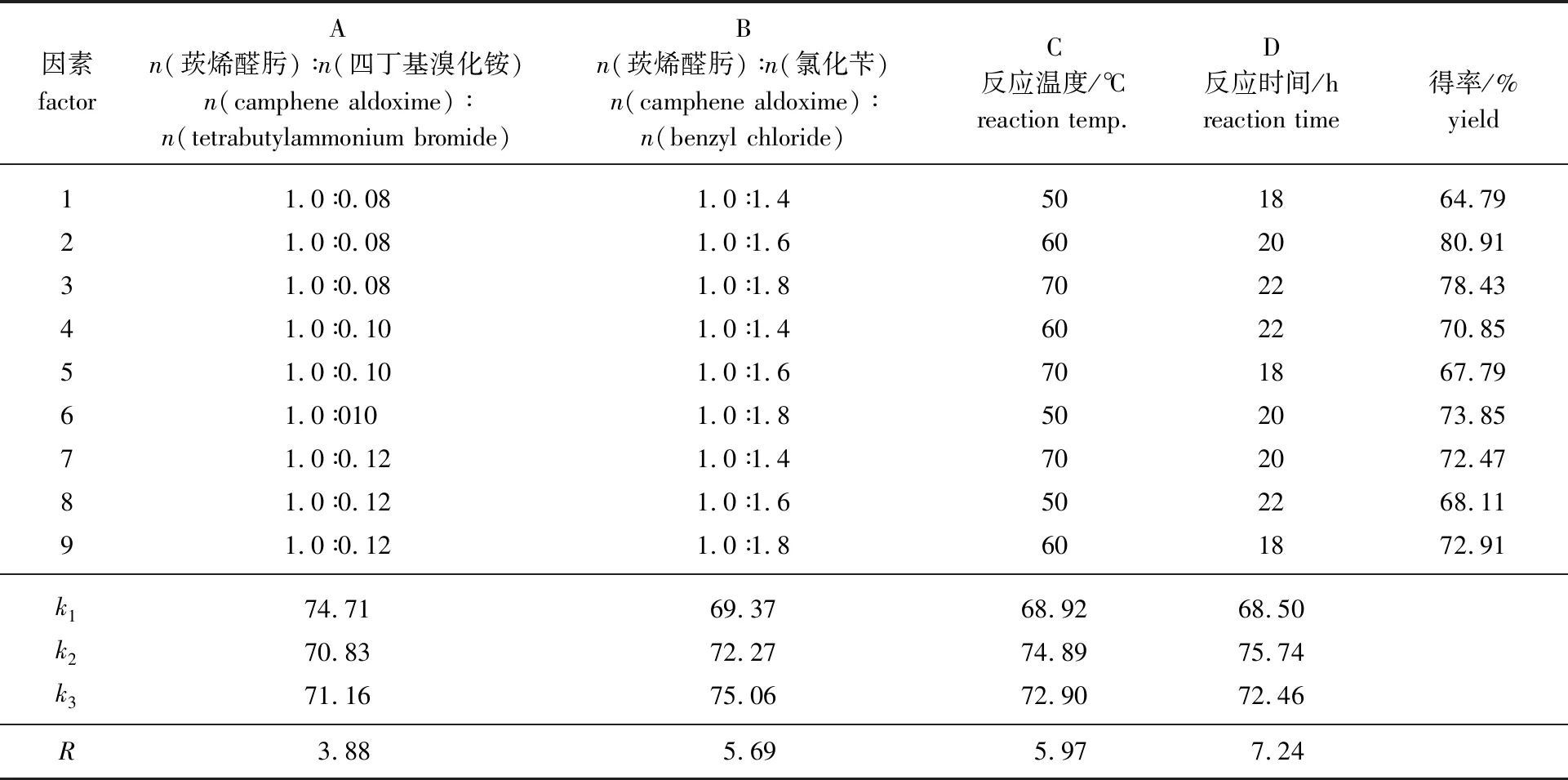
表3 正交试验设计及结果分析
从表3的极差分析可以看出主要因素是反应时间,其次是反应温度和氯化苄用量,最后是四丁基溴化铵用量。其最佳工艺条件为A1B3C2D2,即氯化苄和四丁基溴化铵用量为n(莰烯醛肟) ∶n(氯化苄) ∶n(四丁基溴化铵)=1.0 ∶1.8 ∶0.08,反应温度为60 ℃,反应时间为20 h。重复A1B3C2D2条件进行3组试验,产物得率分别为84.31%、83.96%和84.07%,平均得率为84.1%,得率相对偏差<0.5%,重现性好。
另外,其它8个化合物也参照上述优化条件进行了合成,但产物得率不同。可以看出当引入R基团为卤代烷烃时,如化合物2b、2c,烷基化剂碳链长度相同时,单取代卤代烷烃的反应活性明显好于双取代卤代烷烃,反应得率更高,如单取代物2a得率高。当引入基团R为取代芳基苄卤时,R基团的电负性和空间位阻都对烷基化反应有明显的影响,当R基团的供电性越强,越有利于反应的进行;R基团的空间位阻变大时,会不利于反应的进行,如2h得率最低。
2.3 产物抗肿瘤活性
采用MTT法对所合成的肟醚类衍生物进行抗肿瘤活性测试,采用治疗多种癌症的化疗药物依托泊甙为阳性对照物,活性评价结果见表4。
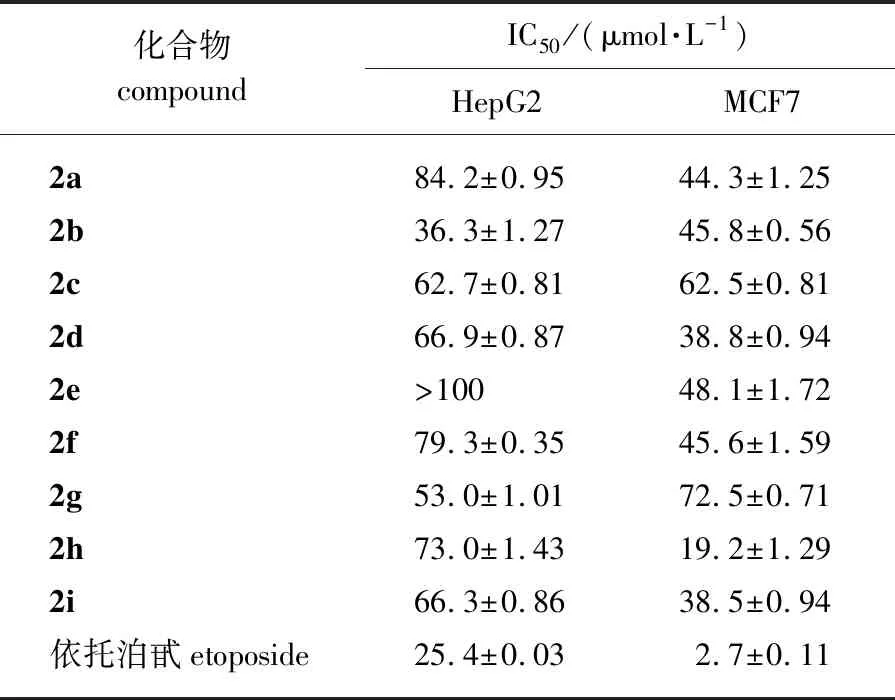
表4 化合物2a~2h抗肿瘤细胞的体外活性测试IC50值
由表4看出,化合物2b对HepG2肿瘤细胞有一定的抑制作用,其IC50值为36.3 μmol/L,但其它的肟醚类衍生物对HepG2肿瘤细胞活性较小,IC50值均大于50 μmol/L,说明取代物结构电负性越低,其抑制作用越好。对于人乳腺癌细胞MCF7,化合物中的2h的抑制作用最好,其IC50值为19.2 μmol/L,其次为化合物2i,2d,具有一定的抑制作用,其IC50值分别为38.5和38.8 μmol/L,说明取代物带苯环并且具有邻取代的氯、氟结构的化合物抑制作用好,双邻取代的抑制作用最好,但还远低于依托泊甙对乳腺癌细胞的抑制作用。结果还表明:同一化合物,对于肝癌细胞HepG2、人乳腺癌细胞MCF7的抑制活性相差较大,化合物2b对HepG2抑制作用好,但对MCF7抑制作用较差;化合物2h对MCF7较好,而对HepG2基本没有抑制作用。这些机制还需要进一步研究。
3 结 论
3.1以莰烯醛肟为原料,在四丁基溴化铵的作用下与卤代物发生反应合成肟醚类化合物。以氯化苄为例,探讨了溶剂种类、四丁基溴化铵的用量、氯化苄的用量、反应温度以及反应时间等因素对产物2a得率的影响,确定了最佳的工艺条件:溶剂为甲苯,四丁基溴化铵用量为n(莰烯醛肟) ∶n(四丁基溴化铵)=1.0 ∶0.08,氯化苄用量为n(莰烯醛肟) ∶n(氯化苄)=1.0 ∶1.8,反应温度为60 ℃,反应时间为20 h。在此条件下2-(3,3-二甲基双环[2.2.1]庚-2-亚基)乙醛O-苄基肟的得率为84.1%。
3.2在最佳工艺条件下将莰烯醛肟与不同卤代物反应共合成了9种肟醚类化合物(2a~2i),并通过红外色谱、气质色谱以及核磁共振等手段对这些化合物进行了表征,产物得率在52.7%~84.1%。
3.3通过体外抗肿瘤活性测试,研究肟醚衍生物对肝癌细胞HepG2和人乳腺癌细胞MCF7的抑制作用。结果表明:化合物2b对肝癌细胞HepG2的抑制作用较好,其IC50值为36.3 μmol/L。化合物2d、2h、2i对MCF7有一定的抑制作用,其中化合物2h对MCF7的抑制效果较好,其IC50值为19.2 μmol/L。
