钛网表面含hBMP-2的复合涂层制备及hBMP-2的释放研究
2020-03-08付亚康翁杰刘耀文张科宏
付亚康, 翁杰, 刘耀文, 张科宏
钛网表面含hBMP-2的复合涂层制备及hBMP-2的释放研究
付亚康1, 翁杰2, 刘耀文3, 张科宏1
(1. 雅安职业技术学院, 雅安 625000; 2. 西南交通大学 材料科学与工程学院, 材料先进技术教育部重点实验室, 成都 610031; 3. 四川农业大学 食品学院, 雅安 625014)
为提高骨接合钛网的骨整合性和生物活性, 本研究采用碱热处理法在钛网表面构建出具有多孔结构的钛酸盐纳米纤维, 利用电化学沉积技术在钛酸盐纳米纤维表面制备磷酸钙涂层, 并采用不同方法将人骨形态发生蛋白(hBMP-2)引入涂层, 制备了三种含hBMP-2分子的复合涂层(TmhB、TmHedhB和TmHhBed)。实验对各复合涂层的表面形貌、化学成分、相组成和hBMP-2的含量与释放性能进行了表征。研究发现: 各涂层都具有多孔纤维结构, TmHedhB和TmHhBed中的磷酸钙相为羟基磷灰石(HA), 呈“串珠”状包裹在钛酸盐纳米纤维表面, “串珠”状HA的引入促进了复合涂层对hBMP-2的吸附。电化学共沉积技术在钛酸盐纳米纤维表面制备的HA/hBMP-2复合涂层中hBMP-2的含量最大, 达886 ng/mg, 在6~48 h内具有明显的hBMP-2缓释性能。
钛; 碱热处理; 电化学沉积; 羟基磷灰石; 复合涂层; hBMP-2
钛及钛合金具有良好的生物相容性、适宜的力学强度, 已大量应用于人体承重部位骨缺损的修复和替换, 但由于钛/钛合金–骨界面不能形成生物活性结合而导致植入体与宿主骨的结合容易发生松动, 引起植入失败[1]。为解决这一问题, 在钛表面引入孔隙结构、引导骨组织长入孔隙、促进植入体与宿主骨整合的方略被寄予厚望[2]。该方略可结合酸碱处理、碱热处理、涂层处理、涂覆生物活性分子等表面活化技术提高钛表面的生物活性, 以诱导骨组织长入, 与植入体之间形成牢固的化学键合[3-5]。
钛网因特有的多孔结构和适宜的力学强度, 已被广泛运用于临床各类骨结核手术后的植骨、牙科植骨[6]、颅骨骨折修复[7]、眼眶骨折修复[8]等领域, 但也因上述缺点, 植入后容易出现钛网移位、露出、局部感染等现象[9-10]。因此有必要对钛网作表面活性处理, 以增强其与宿主骨之间生物活性结合。目前针对钛及钛合金作表面改性的研究较多[11], 但尚未见到专门针对钛网表面进行改性以促进与骨组织形成化学键合的研究报道。
天然骨组织中, HA矿化于胶原纤维结构间隙[12], 赋予骨组织特殊的生物学性能[13]。Habibovic等[14]发现具有微孔隙结构的生物材料能在非骨组织环境中诱导骨组织生长, 因而有研究通过人造带间隙的纳米纤维与HA结合, 模拟骨组织中胶原纤维与HA的结合方式, 如丝素蛋白支架[15-16]、高分子/HA复合材料[17-18]等。这些纳米纤维结构因具有内贯通[19]、大孔隙率等特点, 与骨组织中胶原蛋白的结构相似, 从而在植入后能够促进细胞粘附、成骨分化和血管长入[20-22]。因此, 如能在钛网表面引入纳米级纤维结构, 将很可能促进材料与骨组织间的化学键合。另一方面, 骨生物学研究[13,23-24]表明, 骨组织中HA的成核、生长受到骨形成蛋白(hBMP-2)的正向调控。在骨修复、植入材料中加入促骨生长因子取得了良好的修复效果[25-27]。
本研究拟在前期采用碱热处理技术在钛网表面制备具有多孔结构钛酸盐纳米纤维[28]的基础上, 探索利用电化学沉积技术进一步在钛酸盐纳米纤维表面沉积磷酸钙涂层, 并采用不同方法将hBMP-2引入涂层, 在钛网表面制备一系列含有hBMP-2的复合涂层, 研究不同复合涂层中hBMP-2的含量和释放行为, 以探索出促进钛网与骨组织牢固键合的新方法。
1 实验方法
1.1 实验材料
直径0.10 mm钛丝构成的钛网购于河北省安平县盛卓丝网制品有限公司, 含99.60% Ti、0.01% H、0.03% N、0.15% Fe、0.05% C、0.15% O, 以及0.01%其他元素。分析纯级模拟体液(SBF)、NaOH购自成都市科龙化工试剂厂。hBMP-2和hBMP-2免疫酶联试剂盒(hBMP-2 ELISA kit)购自武汉华美生物工程有限公司。
1.2 碱热处理法构建钛酸盐纳米纤维结构
将钛网裁剪成10 mm×10 mm的正方形, 依次用丙酮、乙醇及去离子水超声处理10 min, 烘干后置于1 mol/L的NaOH溶液中, 240 ℃条件下反应6 h, 降温至室温, 取出样品放入80 ℃鼓风干燥箱中干燥12 h, 取出, 用去离子水超声清洗至水不再浑浊为止, 烘干待用。
1.3 含hBMP-2的复合涂层制备
在上述1.2部分碱热处理后的钛网表面, 用不同方法制备3种含hBMP-2的复合涂层。
1.3.1 表面吸附hBMP-2的钛酸盐纳米纤维涂层
配置hBMP-2浓度为2 μg/mL的PBS(0.01 mol/L, pH=8.6) 200 mL, 加入碱热处理后的钛网100 mg, 在 37 ℃、97 r/min 下吸附2 h, 取出冲洗、晾干。样品记为TmhB。
1.3.2 表面吸附hBMP-2的钛酸盐纳米纤维/磷酸钙复合涂层
在三电极系统中, 将碱热处理后的钛网作为工作电极, 铂金片作为对电极, 饱和甘汞电极作为参比电极(图1); 加入电沉积液200 mL (37.5 ℃, pH= 8.6, NaCl: 8.00 g, CaCl2: 0.14 g, KCl: 0.40 g, NaHCO3: 0.35 g, glucose: 1.00 g, KH2PO4: 0.10 g, MgCl2·6H2O: 0.10 g, Na2HPO4·2H2O: 0.06 g, MgSO4·7H2O: 0.06 g[29])。采用脉冲沉积模式, 沉积电压–1.3 V, 脉宽100 s、脉冲周期200 s, 沉积2 h后, 取出冲洗、烘干。称取烘干样品100 mg, 置入200 mL hBMP-2浓度2 μg/mL的PBS (0.01 mol/L, pH=8.6), 在37 ℃、97 r/min 下吸附2 h, 取出冲洗、晾干。样品记为TmHedhB。
1.3.3 钛酸盐纳米纤维表面电化学共沉积hBMP-2/磷酸钙复合涂层
称取碱热处理后的钛网100 mg, 在1.3.2所述电沉积液中加入hBMP-2, 调节浓度为2 μg/mL, 在其他参数相同的条件下进行电化学沉积。所得样品记为TmHhBed。

图1 电化学共沉积技术在钛网表面制备复合涂层的示意图

表1 钛网经碱热处理后各样品的不同制备方法
1.4 hBMP-2的含量检测
将上述1.3.1、1.3.2吸附步骤后和1.3.3电化学共沉积步骤后剩余hBMP-2溶液在15000 r/min下离心10 min, 利用hBMP-2 ELISA kit在波长450 nm处检测离心后上清液中hBMP-2浓度, 分别计算不同涂层中hBMP-2的含量。
1.5 hBMP-2的释放
称取样品TmhB、TmHedhB和TmHhBed各100 mg, 加入100 mL 磷酸缓冲液(PBS, 0.01 mol/L, pH 5.0)中进行hBMP-2释放实验。在37.5 ℃、100 r/min条件下, 按一定时间间隔取样, 并补入等体积PBS。用hBMP-2 ELISA kit按上述方法进行浓度检测。
1.6 仪器与测试
采用电化学工作站(辰华CHI660C)进行电化学沉积实验; 采用SEM(QUANTA200)、XRD(Philips PW3040/60)和ATR-FTIR(Thermo Nicolet6700 and ATR parts)分别对支架的表面形貌、相组成和化学成分进行分析; 采用hBMP-2免疫酶联试剂盒(hBMP-2 ELISA kit)检测hBMP-2的浓度。
2 结果与讨论
2.1 样品的特征基团
由ATR-FTIR光谱可见(图2), TmHedhB、TmHhBed样品在565 cm–1处检测出PO43–的弯曲振动峰, 在1033 cm–1处检测出PO43–的伸缩振动峰; 在3411 cm–1处检测出OH–的吸收峰[30]; 在873、1456 cm–1处检测出CO32–的吸收峰[30]。由于红外吸收光谱分析一般要求待检样品不少于1 mg, 而本实验样品所用hBMP-2溶液的浓度较低(2 μg/mL), 样品中hBMP-2的含量远低于最低检测限, 因此三种样品中均未检测出N–H弯曲振动和C–N伸缩振动的吸收峰。
2.2 样品的晶型
由XRD光谱分析可知(图3), 三种涂层中均存在金属钛相(未发生反应的钛网)和钛酸盐相(碱热处理生成的钛酸盐纳米纤维)。TmHedhB、TmHhBed样品在2=25.8°、31.8°处的衍射峰与HA (002)、(112)晶面的衍射峰相对应, 结合TmHedhB、TmHhBed中已检测出PO43–、OH–和CO32–的吸收峰(图2), 说明样品TmHedhB、TmHhBed中“串珠”状颗粒成分为含CO32–的HA。衍射峰宽、交叠, 说明HA的结晶性较差, 与自然骨组织中HA的结晶性质一致。另外, TmHhBed中衍射峰比TmHedhB中衍射峰宽, 交叠现象更严重, 这可能是因为TmHhBed中HA电沉积环境中含有hBMP-2分子, hBMP-2成为HA异位成核的位点, 抑制HA晶体的长大, 并且hBMP-2成为HA晶体中的缺陷。

图2 钛网表面不同复合涂层的ATR-FTIR图谱

图3 钛网表面不同复合涂层的XRD图谱
2.3 表面形貌分析
在金属钛的植入应用研究中, 常常通过碱热处理以提高其亲水性[28]。碱热处理后, 钛网表面形成形状规则的钛酸盐纳米纤维, 纳米纤维远端自组装形成多孔结构(图4)。本课题组[28]先前研究认为这是由于钛酸盐纳米粒子向深层不断生长, 形成纳米纤维并逐渐延长, 导致远端纳米纤维缺乏力学稳定而坍塌, 从而形成多孔结构。TmHedhB、TmHhBed样品中纳米纤维及多孔结构清晰可见(图4(f, i)), HA呈“串珠”状均匀包裹在纳米纤维表面, HA颗粒长约100 nm, 宽约30 nm, 与骨组织中HA成分的尺寸相似[31]。
TmHhBed样品中HA沉积较多(图4(e, h)), 这可能是由于hBMP -2能够为HA提供更多成核位点, 促进HA的沉积。hBMP-2分子的理论尺寸为7 nm× 3.5 nm×3 nm[32], SEM照片中形貌为微米级, 因此未见hBMP-2的分子形貌。
2.4 钛网表面不同复合涂层中hBMP-2的含量
TmhB、TmHedhB和TmHhBed三种样品中hBMP-2的含量分别为295、610和886 ng/mg (图5)。TmHedhB中hBMP-2的含量高于TmhB中hBMP-2的含量, 可能是因为“串珠”状HA的引入导致TmHedhB表面亲水性和表面与hBMP-2之间静电作用增强[33]。如Pang等[34]通过制备β-TCP涂层提高金箔表面的亲水性, 进而提高材料对牛血清白蛋白(BSA)的吸附。Dong等[35]认为HA属于亲水材料, 与hBMP-2的–OH、–NH2形成氢键而发生吸附。研究表明[36-37]静电引力是导致hBMP-2在HA表面发生吸附的重要因素。如Dong等[35]发现BMP-2的COO–与HA (001)晶面之间存在静电引力而发生吸附。Zhou等[38]发现BMP-7的COO–与HA表面的Ca2+(I)之间存在静电引力而发生吸附。Kandori等[39]证明HA表面Ca2+是带负电荷的蛋白质的吸附位点。本实验中hBMP-2带负电荷(hBMP-2的等电点为7.9[40], 实验中hBMP-2溶液pH为8.6), hBMP-2与“串珠”状HA表面Ca2+之间存在静电引力而导致吸附的发生。

图4 钛网表面不同复合涂层的SEM照片
(a-c) TmhB; (d-f) TmHedhB; (g-i) TmHhBed
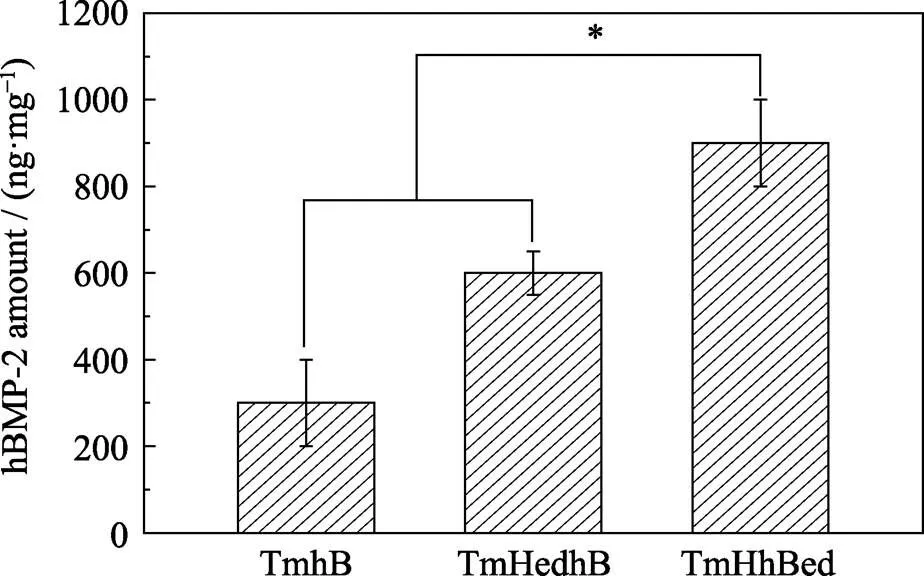
图5 钛网表面不同复合涂层中hBMP-2的含量
TmHhBed中hBMP-2的含量高于 TmHedhB中hBMP-2的含量可能是因为TmHedhB中的hBMP-2仅吸附于表面, 而TmHhBed中的hBMP-2参与了电化学沉积中HA晶粒的成核与生长过程。hBMP-2为HA提供了成核位点, 促进HA异位成核; 新形成的HA晶面为hBMP-2提供吸附位点, 促进hBMP-2的吸附, hBMP-2进入HA内部, 导致hBMP-2含量提高。
2.5 钛网表面不同复合涂层中hBMP-2的释放
hBMP-2的释放曲线(图6)显示, TmhB、TmHedhB样品在6 h的hBMP-2释放量达94%, 具有明显的突释特点。这可能是因为hBMP-2吸附于TmhB、TmHedhB涂层的表面, 容易发生脱附。作者前期在有关HA表面BSA、溶菌酶(LYS)的释放研究中也得到类似的结论[41-42]。
TmHhBed样品在6 h的hBMP-2释放量为74%, 48 h的释放量为86%, 在6~48 h内表现明显的hBMP-2缓释性能。这主要是因为TmHhBed表面为电化学共沉积技术制备的hBMP-2/HA复合涂层, hBMP-2和HA之间的作用机制与骨形成相关蛋白[43]和骨矿物质之间的作用机制类似[13], hBMP-2为HA提供成核位点, 新沉积HA表面吸附hBMP-2, hBMP-2的吸附与HA沉积交替、动态进行, 导致hBMP-2分布于TmHhBed样品的表面和HA晶体内部[13]。吸附于样品表面的hBMP-2分子容易脱附, 表现出hBMP-2的突释现象; 随着HA的溶解, HA内部的hBMP-2逐渐释放, 表现出hBMP-2的缓释现象。

图6 钛网表面不同复合涂层中hBMP-2的释放曲线
3 结论
本研究结合碱热处理、电化学沉积, 引入促骨生长活性蛋白因子等技术, 在骨接合钛网表面制备了三种含有hBMP-2修饰的复合涂层, 系统研究了不同样品的表面形貌、化学成分、相组成、hBMP-2含量及释放情况。研究发现:
1) 钛网在NaOH浓度1 mol/L, 240 ℃条件下碱热处理6 h, 可以在表面构建出具有多孔结构的钛酸盐纳米纤维结构。
2) 采用电化学沉积技术(脉冲沉积模式、沉积电压–1.3 V、脉宽100 s、脉冲周期200 s, 沉积时间2 h)在钛酸盐纳米纤维表面沉积形成了“串珠”状HA颗粒, 颗粒长约100 nm, 宽约30 nm, “串珠”状HA均匀包裹在钛酸盐纳米纤维表面。
3) TmhB、TmHedhB和TmHhBed样品中hBMP-2的含量分别为295、610、886 ng/mg。电化学共沉积技术制备的TmHhBed中hBMP-2进入到HA涂层内部, 导致其hBMP-2的含量最高。
4) TmhB、TmHedhB具有明显的hBMP-2突释行为, 6 h hBMP-2的释放量达94%; TmHhBed表面吸附的hBMP-2突释后, “串珠”状HA中的hBMP-2伴随HA的溶解逐渐释放, 在6~48 h范围内具备明显的hBMP-2缓释性能。
[1] BUSER D, SCHENK R K, STEINEMANN S,Influence of surface characteristics on bone integration of titanium implants. a histomorphometric study in miniature pigs., 1991, 25(7): 889–902.
[2] DABROWSKI B, SWIESZKOWSKI W, GODLINSKI D,Highly porous titanium scaffolds for orthopaedic applications., 2010, 95B(1): 53–61.
[3] CARINE V, YANN C, DIDIER L O,Surface modification of titanium with phosphonic acid to improve bone bonding: characterization by XPS and ToF-SIMS., 2002, 18(7): 2582–2589.
[4] WANG X H, LI J S, HU R,Mechanical properties and bioactive surface modificationalkali-heat treatment of porous titanium for biomedical applications., 2013, 647: 511–517.
[5] DAS K, BALLA V K, BANDYOPADHYAY A,Surface modification of laser-processed porous titanium for load-bearing implants., 2008, 59(8): 822–825.
[6] RAKHMATIA Y D, AYUKAWA Y, FURUHASHI A,Current barrier membranes: titanium mesh and other membranes for guided bone regeneration in dental applications., 2013, 57(1): 3–14.
[7] MARBACHER S, ANDRES R H, FATHI A R,Primary reconstruction of open depressed skull fractures with titanium mesh., 2008, 19(2): 490–495.
[8] SCH N R, METZGER M C, ZIZELMANN C,Individually preformed titanium mesh implants for a true-to-original repair of orbital fractures., 2006, 35(11): 990–995.
[9] NAKASE H, PARK Y S, KIMURA H,Complications and long-term follow-up results in titanium mesh cage reconstruction after cervical corpectomy., 2006, 19(19): 353–357.
[10] MARTIN M P, OLSON S. Post-operative complications with titanium mesh., 2009, 16(8): 1080–1081.
[11] CARRAD A. Development of bioactive hydroxyapatite coatings on titanium alloys., 2012, 533: 183–193.
[12] LANGELIER B, WANG X, GRANDFIELD K. Atomic scale chemical tomography of human bone., 2017, 7: 39958.
[13] KANE R, MA P X. Mimicking the nanostructure of bone matrix to regenerate bone., 2013, 16(11): 418–423.
[14] HABIBOVIC P, YUAN H, VAN D D M,Relevance of osteoinductive biomaterials in critical-sized orthotopic defect., 2010, 24(5): 867–876.
[15] LI C, VEPARI C, JIN H J,Electrospun silk-BMP-2 scaffolds for bone tissue engineering., 2006, 27(16): 3115–3124.
[16] MURPHY C M, SCHINDELER A, GLEESON J P,A collagen- hydroxyapatite scaffold allows for binding and co-delivery of recombinant bone morphogenetic proteins and bisphosphonates., 2014, 10(5): 2250–2258.
[17] GUO X, PARK H, YOUNG S,Repair of osteochondral defects with biodegradable hydrogel composites encapsulating marrow mesenchymal stem cells in a rabbit model., 2010, 6(1): 39–47.
[18] CHEN P C, XU Z K. Mineral-coated polymer membranes with superhydrophilicity and underwater superoleophobicity for effective oil/water separation., 2013, 3(6153): 2776.
[19] USINSKAS P, STANKEVICIUTE Z, BEGANSKIENE A,Sol-Gel derived porous and hydrophilic calcium hydroxyapatite coating on modified titanium substrate., 2016, 307: 935–940.
[20] CHA C, LIECHTY W B, KHADEMHOSSEINI A,Designing biomaterials to direct stem cell fate., 2012, 6(11): 9353–9358.
[21] LUTOLF M P, GILBERT P M, BLAU H M. Designing materials to direct stem-cell fate., 2009, 462(7272): 433–441.
[22] DOM NGUEZ-TRUJILLO C, PE N E, CHICARDI E,Sol-Gel deposition of hydroxyapatite coatings on porous titanium for biomedical applications., 2017, 333(15): 158–162.
[23] PENG H, USAS A, OLSHANSKI A,VEGF improves, whereas sFlt1 inhibits, BMP2-induced bone formation and bone healing through modulation of angiogenesis., 2010, 20(11): 2017–2027.
[24] CHEN L, JIANG W, HUANG J,Insulin-like growth factor 2(IGF-2) potentiates BMP-9-induced osteogenic differentiation and bone formation., 2010, 47(11): S432–S433.
[25] BOSE S, TARAFDER S. Calcium phosphate ceramic systems in growth factor and drug delivery for bone tissue engineering: a review., 2012, 8(4): 1401–1421.
[26] KHAN S N, BOSTROM M P, LANE J M. Bone growth factors., 2000, 31(3): 375–387.
[27] WANG Z, CHEN L, XU J,Bioadhesive microporous architectures by self-assembling polydopamine microcapsules for biomedical applications., 2015, 27(3): 848–856.
[28] ZHANG C D, XIAO D Q, FU Y K,Fabrication of nanostructured hierarchical coatings composed of calcium phosphate/ titanate on titanium substrate., 2014, 575–576: 253–258.
[29] ZHAO H, DONG W, ZHENG Y,The structural and biological properties of hydroxyapatite-modified titanate nanowire scaffolds., 2011, 32(25): 5837–5846.
[30] KOUTSOPOULOS S. Synthesis and characterization of hydroxyapatite crystals: a review study on the analytical methods., 2002, 62(4): 600–612.
[31] PALAZZO B, IAFISCO M, LAFORGIA M,Biomimetic hydroxyapatite-drug nanocrystals as potential bone substitutes with antitumor drug delivery properties., 2010, 17(13): 2180–2188.
[32] CAI L, LIN D, CHAI Y,MBG scaffold containing chitosan microspheres as binary delivery system of IL-8 and BMP-2 for bone regeneration., 2018, 6(27): 4453–4465.
[33] LU X, WANG Y B, LIU Y R,Preparation of HA/chitosan composite coatings on alkali treated titanium surfaces through Sol–Gel techniques., 2007, 61(18): 3970–3973.
[34] PANG D, HE L, WEI L,Preparation of a beta-tricalcium phosphate nanocoating and its protein adsorption behaviour by quartz crystal microbalance with dissipation technique., 2018, 162: 1–7.
[35] DONG X, WANG Q, WU T,Understanding adsorption- desorption dynamics of BMP-2 on hydroxyapatite(001) surface., 2007, 93(3): 750-759.
[36] WALLWORK M L, KIRKHAM J, ZHANG J,Binding of matrix proteins to developing enamel crystals: an atomic force microscopy study., 2001, 17(8): 2508–2513.
[37] ZHU X, FAN H, LI D,Protein adsorption and zeta potentials of a biphasic calcium phosphate ceramic under various conditions., 2007, 82(1): 65–73.
[38] ZHOU H, WU T, DONG X,Adsorption mechanism of BMP-7 on hydroxyapatite(001) surfaces., 2007, 361(1): 91–96.
[39] KANDORI K, FUDO A, ISHIKAWA T. Study on the particle texture dependence of protein adsorption by using synthetic micrometer- sized calcium hydroxyapatite particles., 2002, 24(2): 145–153.
[40] BOIX T, GOMEZ-MORALES J, TORRENT-BURGUES J,Adsorption of recombinant human bone morphogenetic protein rhBMP-2m onto hydroxyapatite., 2005, 99(5): 1043–1050.
[41] FU Y K, ZHOU X, XIAO D Q,Influence of micro-nano structure of haydroxyapatite particles on protein adsorption., 2015, 30(5): 523–528.
[42] FU Y K, LI X Z, XIA X,Effect of zeta potential of hydroxyapatite on protein adsorption., 2016, 16(19): 3610–3613.
[43] IMAMURA T, KAITO T. Homeostasis and disorder of musculoskeletal system.BMP and TGF signaling and locomotive tissues., 2018, 28(3): 313.
hBMP-2 Contained Composite Coatings on Titanium Mesh Surface: Preparation and hBMP-2 Release
FU Ya-Kang1, WENG Jie2, LIU Yao-Wen3, ZHANG Ke-Hong1
(1. Ya’an Polytechnic College, Ya’an 625000, China; 2. Key Laboratory of Advanced Technologies of Materials, Ministry of Education, School of Materials Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China; 3. School of food, Sichuan Agricultural University, Ya’an 625014, China)
Titanate nanofibers were prepared on titanium mesh by alkali-heat treatment, and calcium phosphate coating was fabricated on the porous titanate nanofibers by electrochemical deposition technology. Then hBMP-2 was introduced into the coating by different methods to improve its osteointegration and bioactivity. Three kinds of composite coatings modified by hBMP-2 were prepared (TmhB, TmHedhB and TmHhBed). Surface morphology, chemical composition, phase composition and hBMP-2 amounts and hBMP-2 release performance of the composite coatings were characterized by SEM, ATR-FTIR, XRD, and hBMP-2 ELISA kit, respectively. Results showed that all of the coatings display porous fiber structure, calcium phosphate phase in TmHedhB and TmHhBed samples was hydroxyapatite (HA), and bead-like HA particles formed on the surface of titanate nanofibers. Protein adsorption experiments showed that introduction of bead-like HA phase increased the hBMP-2 adsorption on the composite coatings, and composite coatings prepared by electrochemical co-deposition technique further enhanced hBMP-2 adsorption up to 886 ng/mg, which were supported hBMP-2 sustained release within 6-48 h.
titanium; alkali-heat treatment; electrochemical deposition; hydroxyapatite; composite coating; hBMP-2
R318; TQ174
A
1000-324X(2020)02-0173-06
10.15541/jim20190127
2019-03-25;
2019-05-04
国家自然科学基金(51572228); 四川省教育厅自然科学基金(16ZB0546); 雅安职业技术学院自然科学基金(2016yzk15)
National Natural Science Foundation of China (51572228); Natural Science Foundation Project of Sichuan Provincial Education Department (16ZB0546); Natural Science Foundation Project of Ya' an Polytechnic College (2016yzk15)
付亚康(1988–), 男, 硕士研究生, 讲师. E-mail: fykmail@163.com
FU Ya-Kang (1988–), male, Master candidate, lecturer. E-mail: fykmail@163.com
