川芎嗪对急性肺损伤的保护作用及其可能机制
2020-03-08林欣陆学芬杭黎华
林欣,陆学芬,杭黎华
(江苏大学附属昆山医院 麻醉科,江苏 昆山 215300)
肺损伤过程中,肺泡膜的完整性破坏及通透性的改变是导致急性肺损伤的根本原因[1]。细胞连接维持肺泡膜完整性和通透性,它主要包括黏附连接(adherent junction,AJ)和紧密连接(tight junction,TJ),其中TJ在维持肺泡黏膜上皮机械屏障和肺泡膜通透性中起着更加重要的作用[2]。TJ通常位于上皮细胞顶端相邻细胞间,对维护上皮细胞两侧物质的差异和保持细胞极性起着重要的作用。TJ蛋白是由一系列跨膜蛋白和外周蛋白相互作用而形成的复杂的蛋白质体系,主要包括跨膜蛋白家族(claudin和occludin)、连接黏附蛋白(junctional adhesion molecule,JAM),并与胞浆内的膜周蛋白(zonulae occludente,ZO)包括ZO-1、2、3,肌动蛋白与细胞骨架直接连接,是肺泡上皮屏障的重要组成成分[3]。occludin蛋白是其中重要的蛋白之一,上皮细胞通过occludin蛋白封闭细胞间隙,并与ZO-1等结合形成TJ的基础结构[4]。在occludin蛋白功能的调节中,丝/苏氨酸的磷酸化状态较为重要,其主要受蛋白激酶C(protein kinase C,PKC)的影响[5-6]。PKC能激活细胞质中的靶酶参与生化反应的调控,同时也能作用于细胞核中的转录因子,参与基因表达的调控,调节细胞的代谢、生长和分化。从以上研究我们发现,occludin蛋白的表达减少或磷酸化活性改变会导致TJ的破坏,肺泡通透性增加,引发肺水肿肺损伤,如果能增加occludin的表达或调节其活性也许会减轻或延缓肺损伤的发生发展。
川芎嗪(tetramethylpyrazine,TMP)是中药川芎的有效成分之一,化学结构为四甲基吡嗪,临床上主要用于治疗慢性顽固性哮喘、肺纤维化、闭塞性血管疾病等。基础研究[7]显示,TMP具有改善缺血部位血流速度、减轻血管外周阻力,从而改善局部血液微循环的作用,还能够降低前列腺素合成,抑制淋巴细胞、中性粒细胞等释放肿瘤坏死因子-α(TNF-α)及白细胞介素-1β(IL-1β)等,避免组织受到反复刺激产生炎症因子。TMP应用于肺缺血再灌注大鼠模型中,可以减少丙二醛(MDA)、髓过氧化物酶(MPO)、超氧化物歧化酶(SOD)等的释放,提高内源性清除氧自由基的能力,产生抗氧化应激,对抗肺缺血再灌注的病理损伤[8]。但TMP对肺组织作用的研究大多局限于炎症因子,对肺损伤过程中肺泡膜完整性及通透性缺乏更深层次的研究。
本研究拟探讨大鼠肺过度通气所致急性肺损伤模型中,TMP干预对气道血浆微渗漏、肺紧密连接蛋白occludin和ZO-1以及肺组织炎症因子表达的影响,探究TMP对急性肺损伤的保护作用及其机制。
1 材料与方法
1.1 动物及分组
健康SD大鼠(体重250~300 g)45只,随机分为单纯气管插管组(对照组)、肺通气组(模型组)及肺通气加TMP雾化吸入组(干预组)3组。实验动物由江苏大学附属昆山医院动物实验中心提供,本研究已获得医院伦理委员会批准。
1.2 大鼠实验方法
所有大鼠用3%戊巴比妥钠腹腔注射麻醉,置于仰卧位并固定四肢。气管切开后行气管插管。对照组单纯行气管插管;模型组使用RSP1002型小动物呼吸机行机械通气,通气设置:吸气呼气比(I∶E)1∶1,呼吸频率(RR)80次·min-1,通气量(VT) 10 ml·kg-1,氧浓度分数(FiO2)100%,通气2 h;TMP组在通气前氧气驱动雾化吸入TMP 20 mg·kg-1·h-1,驱动氧流量 5~6 L·min-1,吸入30 min。
1.3 大鼠气道血浆微渗漏检测
取上述每组大鼠各7只,行气道血浆微渗漏检测。参考文献[9],大鼠尾静脉注射伊文思蓝1 ml,10 min后剪开胸腔,左心房切一小口,从右室插入14 F针头入肺动脉灌注生理盐水250 ml以去除血管内的染料;取右支气管、右肺上叶,置于甲酰胺内24 h,于37 ℃水浴箱内提取伊文斯蓝染料,测定620 nm处吸光度。根据标准曲线测定组织内染料浓度。切取气管和左主支气管,行冰冻切片,直接荧光显微镜下观察伊文斯蓝荧光。
1.4 免疫蛋白印迹检测
取上述每组大鼠各8只,剪开胸腔取左肺组织,检测occludin(1∶500,Novus公司)和ZO-1(1∶800,Abcam公司)的表达。冰上操作,快速将肺组织剪成小块,提取总蛋白,用BCA法检测蛋白浓度。经过凝胶电泳、转膜、封闭、加入一抗和二抗后,在扫描仪上获取图像,应用Alpha软件处理系统分析条带灰度值,蛋白水平用目标蛋白与内参照3-磷酸甘油醛脱氢酶(GAPDH)条带灰度值比值表示。
1.5 酶联免疫吸附试验
将1.4中大鼠右肺组织取出,检测occludin、ZO-1、IL-1β、IL-6、TNF-α的含量。具体实验过程按试剂盒(美国Cayman公司)说明书进行。冰上操作,剪成小块组织匀浆。所有组织匀浆标本稀释10倍,加入标准稀释液至空白孔和零孔,加入标本和已稀释的不同浓度的标准品各100 μl至相应孔中。加入标志物,用膜把板封好,4 ℃孵育过夜。弃去废液,用洗液洗板5次,然后每孔加入200 μl显色剂,用膜封好,避光振荡60 min。在酶标仪上405 nm处测吸光度。根据试剂公司提供的方法绘制标准曲线,求出标本中含量。
1.6 统计学处理
所有数据以均数±标准差表示,采用SPSS 17.0软件分析。多组间比较采用单因素方差分析(ANOVA),进一步组间两两比较采用LSD-t检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠气道血浆微渗漏比较
见图1。与对照组比较,模型组大鼠气道伊文思蓝荧光亮度显著增强,而干预组大鼠气道伊文思蓝荧光亮度较模型组显著减弱;各组气道伊文思蓝荧光平均光密度值差异有统计学意义(F=10.234,P=0.016),模型组显著高于对照组(2.85±0.67vs1.09±0.35,P=0.003),而干预组显著低于模型组(2.12±0.44vs2.85±0.67,P=0.031);肺组织内伊文思蓝浓度各组差异有统计学意义(F=5.897,P=0.009),模型组显著高于对照组(69.45±19.87vs25.63±8.74,P=0.000),而干预组显著低于模型组(45.62±12.18vs69.45±19.87,P=0.012)。上述结果表明,机械通气可造成大鼠气道损伤,血浆微渗漏显著增加,而雾化吸入TMP可改善机械通气造成的气道血浆微渗漏的增加。
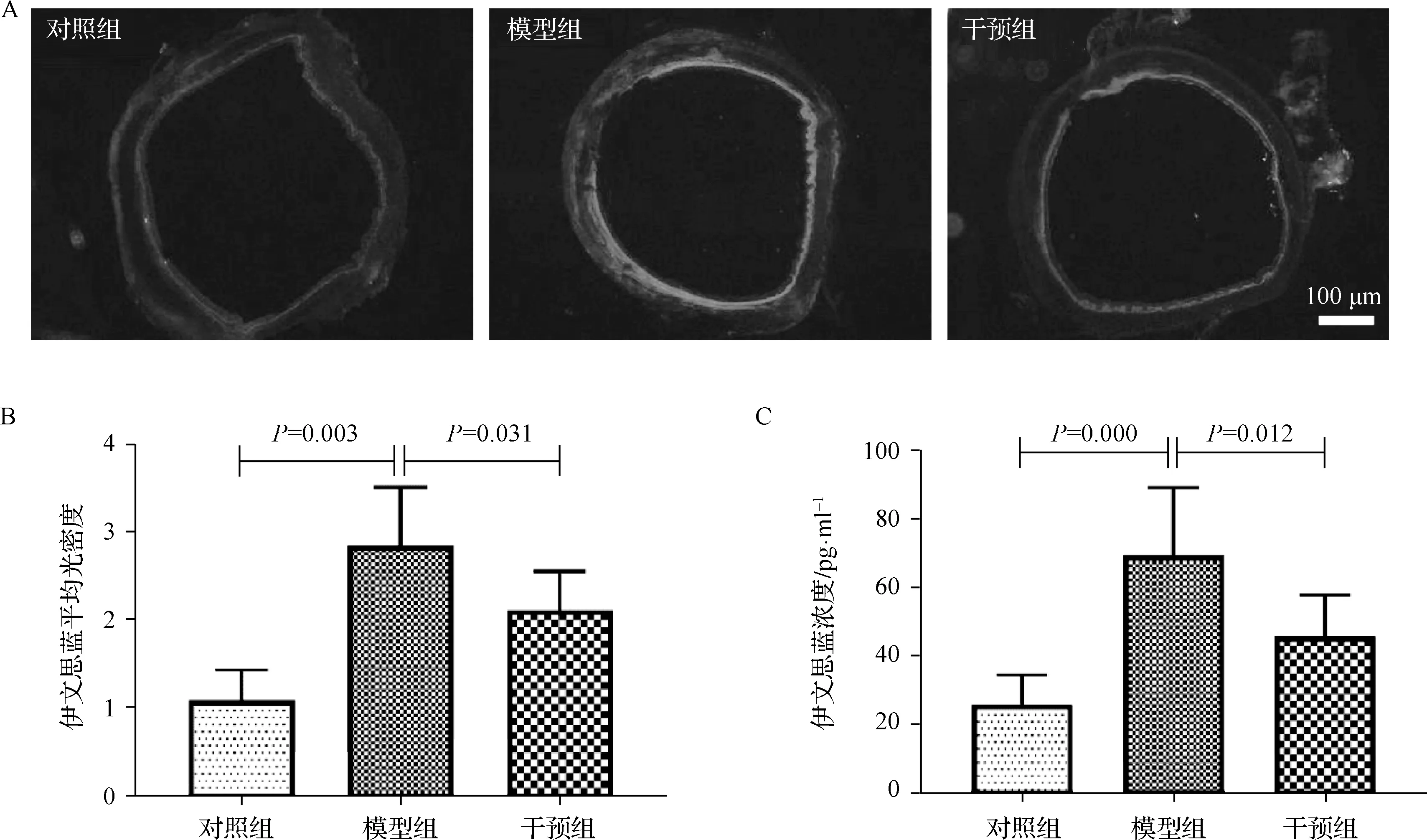
图1 各组大鼠气道血浆微渗漏情况 A.大鼠气道伊文思蓝荧光染色;B.大鼠气道伊文思蓝平均光密度值;C.大鼠肺组织伊文思蓝浓度
2.2 各组大鼠肺组织细胞间紧密连接蛋白比较
见图2。与对照组比较,模型组大鼠肺组织细胞间紧密连接蛋白ZO-1、occludin表达显著减少,而干预组较模型组显著增多;蛋白水平与GAPDH相比(ZO-1/GAPDH:F=12.119,P=0.023;occludin/GAPDH:F=13.412,P=0.026),模型组显著高于对照组(ZO-1:0.62±0.15vs1.23±0.22,P=0.012;occludin:0.59±0.14vs1.15±0.25,P=0.001),而干预组显著低于模型组(ZO-1:0.78±0.19vs0.62±0.15,P=0.046;occludin:0.81±0.22vs0.59±0.14,P=0.039);ELISA结果(ZO-1浓度:F=9.746,P=0.017;occludin浓度:F=11.264,P=0.013),模型组显著高于对照组(ZO-1:16.52±5.98vs38.64±12.18,P=0.009;occludin:48.12±11.98vs69.71±25.74,P=0.026),而干预组显著低于模型组(ZO-1:25.19±8.74vs16.52±5.98,P=0.022;occludin:59.21±15.72vs69.71±25.74,P=0.041)。上述结果表明,机械通气可造成大鼠肺泡间紧密连接破坏,而雾化吸入TMP可改善此现象。
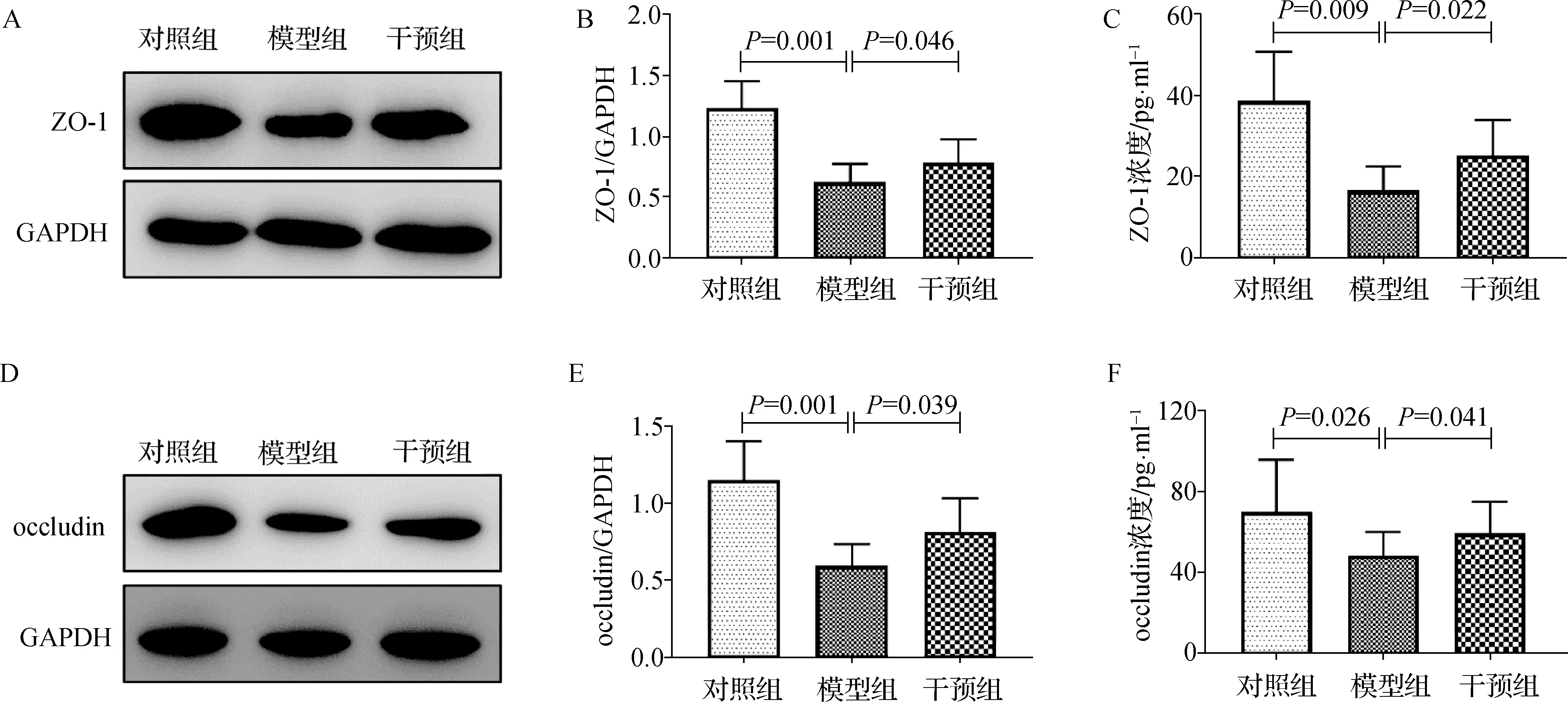
图2 各组大鼠肺组织紧密连接蛋白表达水平 A、D.大鼠肺组织ZO-1、Occludin表达;B、E.大鼠肺组织ZO-1、Occludin表达的比较;C、F.大鼠肺组织ZO-1、Occludin浓度的比较
2.3 各组大鼠肺组织炎症因子含量比较
见图3。肺组织炎症因子含量3组间差异有统计学意义(IL-1β:F=6.382,P=0.009;IL-6:F=7.778,P=0.011;TNF-α:F=9.956,P=0.015)。与对照组比较,模型组大鼠肺组织IL-1β(62.59±18.41vs26.74±9.41,P=0.002)、IL-6(32.11±7.42vs15.23±4.45,P=0.003)、TNF-α(98.67±25.47vs60.12±12.84,P=0.019)含量显著增高;与模型组比较,干预组大鼠肺组织IL-1β(50.13±15.67vs62.59±18.41,P=0.039)、IL-6(26.84 ±6.99vs32.11±7.42,P=0.037)、IL-6(85.61±20.13vs98.67±25.47,P=0.046)含量显著降低。上述结果表明,机械通气可诱导气道炎症,而雾化吸入TMP可改善炎症水平,减少炎症因子的释放。

图3 各组动物气道肺组织炎症因子水平 A.动物肺组织IL-1β的浓度;B.动物肺组织IL-6的浓度;C.动物肺组织TNF-α的浓度
3 讨 论
急性肺损伤发病急骤,死亡率高,包括各种抗炎/促炎因素、体液与细胞免疫因素、神经源性炎症以及环境因素等等,目前机制尚未完全清楚。不同机械通气量对呼吸循环系统都会造成影响[10],且机械通气诱发的急性肺损伤是其中的一个重要类型[11],主要是因为手术或者危重症患者在急性机械通气过程中,通气因素和患者肺部因素的相互作用,进而导致肺部损伤,产生一系列病理生理改变,包括肺泡的破坏即屏障功能的损伤,以及炎症因子的大量释放[12]。因此肺内炎症反应失控是诱发弥漫性急性肺损伤的重要因素。
我国传统中药对急性肺损伤的治疗目前已经有较多的基础和临床研究。比如葛根素、青蒿素、参脉等药物,在改善炎症、微循环等方面均有一定的疗效,但关于TMP在治疗急性肺损伤方面的研究较少。TMP是我国传统中药川芎的主要成分之一,既往研究发现其有多种药理作用[13],包括:(1) 免疫调节功能。TMP可抑制一些细胞因子特别是炎症因子的释放,因此具有抑制炎症反应作用。(2) 抗凝、抑制血栓形成以及扩张外周血管作用。TMP可以增加小微血管如微动脉、微静脉和毛细血管等的管径,因此可以增加血流量,使血流黏稠度降低。(3) 抗凝、抑制血小板聚集的作用,从而较少小血管内微血栓的形成,起到改善微循环的作用。(4) 改善氧化/抗氧化作用,部分有钙拮抗剂的特性,还可以促进能量合成。
单肺通气时采用的大潮气量通气使健侧肺肺泡受到过度机械牵张,而非通气侧肺不仅因缺氧引起肺泡萎陷,而且由于缺氧性肺血管收缩导致血流灌注不足;当萎陷肺复张时,肺组织恢复灌注,从而导致肺损伤[14]。造成急性肺损伤的分子机制较为复杂,比如巨噬细胞激活可增加肺损伤的程度[15],TLR4、Akt信号通路激活[9]及NF-κB、MAPK信号通路也起着重要的作用[16]。本研究中大鼠动物模型模拟了机械通气造成的急性肺损伤,基本符合人急性肺损伤的病理生理过程。研究发现,予大鼠机械通气,可导致气道血浆微渗漏增加,肺组织细胞间紧密连接破坏,肺组织内炎症因子释放增加,而提前给予TMP雾化吸入干预,可以改善上述现象,使气道血浆微渗漏程度降低,细胞间紧密连接破坏减少,炎症因子释放减少,故而可以认为TMP对机械通气造成的急性肺损伤具有保护作用,因此TMP在今后有可能作为治疗急性肺损伤的新药而应用于临床。
综上所述,TMP可以减轻机械通气诱发的急性肺损伤中炎症反应,减少肺组织细胞间紧密连接破坏以及炎症因子释放,降低肺血管通透性,减轻肺组织损伤。
