粗壮脉纹孢菌孢子中类胡萝卜素的体外发酵特性
2020-03-06许艳萍邓泽元
杜 佳 梁 莎 陈 莉 许艳萍 邓泽元 李 静
(1 南昌大学 食品科学与技术国家重点实验室 南昌330047
2 江苏省镇江市产品质量监督检验中心 江苏镇江212312
粗壮脉纹孢菌(Neurospora crassa),属真菌门,子囊菌门(Ascomycoya),子囊菌纲(Ascomycetes),粪壳目(Sordariales),粪壳菌科(Sordariaceae),脉纹孢菌属(Neurospora)[1]。粗壮脉纹孢菌为好氧性丝状真菌,可产较高活力的纤维素酶,同时可代谢产生类胡萝卜素,特别是其成熟孢子中色素含量较高[2]。有研究[3]报道粗壮脉纹孢菌每100 g孢子中含有17.18 g水分、29.91 g粗纤维、0.31 g粗脂肪、28.32 g蛋白质、0.66 g几丁质、0.078 g总类胡萝卜素。其中类胡萝卜素对DPPH自由基、超氧自由基、羟基自由基均有较强的清除能力,比同浓度的番茄红素、β-胡萝卜素清除自由基能力强,此外,还具有较高的总抗氧化能力和较强的金属螯合能力[4]。杜佳等[3]报道了粗壮脉纹孢菌孢子中类胡萝卜素在体外消化后其含量和抗氧化活性的变化。杨凤玲等[5]报道了孢子中类胡萝卜素体外发酵特性,而对于消化后粗壮脉纹孢菌孢子粉所产类胡萝卜素体外发酵特性方面的研究尚未见报道。
本研究模拟体外发酵条件,分析发酵液的pH、产气量、NH3-N值、短链脂肪酸和肠道微生物的变化,比较消化前、后孢子粉体所产类胡萝卜素体外发酵特性,获得富含类胡萝卜素的粗壮脉纹胞菌孢子粉中类胡萝卜素对人体肠道健康的影响,为其潜在的功能特性提供科学依据。
1 材料与方法
1.1 材料与试剂
粗壮脉纹孢菌(Neurospora crassa)CGMCC NO.3088,由南昌大学重点实验室筛选分离;豆渣,南昌市校区菜市场;KCl、Na2CO3、CaCl2、CoCl2·6H2O、NaCl、NaHPO3·12H2O、Na2SO4、MnSO4·7H2O和HCl,西陇科学股份有限公司;KH2PO4、苯酚、NaClO,天津市大茂化学试剂厂;Mo7(NH4)6O2·4H2O,天津市化学试剂厂凯达化工厂;FeSO4·7H2O,上海振兴化工一厂;ZnSO4·7H2O,上海试剂二厂;尿素,上海试剂一厂。
1.2 溶液配制
1)体外发酵培养液 参考Barry等[6]的方法配制。微量培养液(g/L):NaHCO3(9.240)、NaHPO3·12H2O(7.125)、NaCl(0.470)、KCl(0.450)、Na2SO4(0.100)、CaCl2(0.055)、MgCl2(0.047)、尿素(0.400),加蒸馏水定容1 000mL,混匀。痕量缓冲液(mg/L):FeSO4·7H2O(3 680)、MnSO4·7H2O(1 900)、ZnSO4·7H2O(440)、CoCl2·6H2O(120)、CuSO4·5H2O(98)、Mo7(NH4)6O2·4H2O(17.4),加蒸馏水定容1 000mL,混匀。使用前在烧杯中配制微量培养液与痕量缓冲液混合液,其比例为微量培养液∶痕量缓冲液=100∶1,V/V,混匀备用。
2)肠道菌群发酵液 取1个塑料烧杯,40~50℃水浴温热,健康成人新鲜粪便直接收集入其中(要求两个月内未服用抗生素,且无肠道疾病),立即充入CO2气体密封,备用[7]。按照粪便∶培养液1∶5(m/V)的比例向烧杯中加入37℃的体外发酵培养液稀释,期间持续向其中中充入CO2气体保持厌氧环境,用玻璃棒搅匀,调整pH值至6.9~7.0,用4层医用无菌纱布过滤,即得肠道菌群发酵液,密封于无菌器皿中,置于37℃的恒温环境中备用[8]。在发酵液中加入20mg/mL的胆酸盐[9]促进类胡萝卜素的溶解。
3)SSF电解质溶液[10]将15.1mL KCl(0.5 mol/L)、3.7mL KH2PO4(0.5mol/L)、6.8mL NaHCO3(1 mol/L)、0.5 mL MgCl2·6H2O(0.15 mol/L)、0.6 mL(NH4)2CO3(0.5mol/L)、0.09mL NaCl(2mol/L)、0.09mL HCl(1mol/L)依次加入烧杯中搅拌并混合均匀,然后转移至500mL容量瓶中,储藏备用。
4)SGF电解质溶液[10]将6.9 mL KCl(0.5 mol/L)、0.9mL KH2PO4(0.5mol/L)、12.5mL NaHCO3(1mol/L)、0.4mL MgCl2·H2O(0.15 mol/L)、0.5 mL(NH4)2CO3(0.5 mol/L)、11.8 mL NaCl(2 mol/L)、1.3mL HCl(1mol/L)依次加入烧杯中搅拌并混合均匀,然后转移至500mL容量瓶中,储藏备用。
5)SIF电解质溶液[10]将6.8mL KCl(0.5mol/L)、0.8mL KH2PO4(0.5mol/L)、42.5mL NaHCO3(1mol/L)、1.1mL MgCl2·H2O(0.15mol/L)、9.6mL NaCl(2mol/L)、0.7mL HCl(1mol/L)依次加入烧杯中搅拌并混合均匀,然后转移至500mL容量瓶中,储藏备用。
1.3 设备与仪器
LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗机械厂;SHZ-A水浴恒温振荡器,上海博迅实业有限公司医疗设备厂;循环水式多用真空泵SHZ-ⅢB,临海市谭氏真空设备有限公司;TDL-5-A飞鸽牌系列离心机,上海安亭科学仪器厂;数显恒温水浴锅HH-2,常州国华电器有限公司;pHs-2型酸度计,上海雷磁仪器厂;ZUV-2800 AH型紫外分光光度计,尤尼柯仪器有限公司;Agilent 6890型气相色谱仪,美国安捷伦科技有限公司
1.4 方法
1.4.1 试验前期准备 将30斤新鲜豆渣121℃灭菌30min,接种粗壮脉纹孢菌,30℃培养,72 h后取孢子。分别称取0.5 g和1 g孢子粉,然后按照Failla等[11]的方法采用口腔、胃及肠3段式来模拟体外消化。
消化后过滤得到的消化上清液和消化残渣采用酸热法[12]分别提取其中的类胡萝卜素。0.5 g孢子粉消化上清液、0.5 g孢子粉消化残渣、1g孢子粉消化上清液、1 g孢子粉消化残渣内的类胡萝卜素含量分别为91.5,113,183,226μg。同时,另外称取0.5 g孢子粉按酸热法浸出其中的类胡萝卜素,即0.5 g未消化孢子粉试验组。根据所测类胡萝卜素总含量561μg/g,0.5 g孢子粉中类胡萝卜素含量为280.5μg。
1.4.2 产气量测定 设计7个处理组,分别为0 g(空白对照)、0.5 g未消化孢子粉组(280.5μg类胡萝卜素)、0.5 g孢子粉消化上清液组(91.5μg类胡萝卜素)、0.5 g孢子粉消化残渣组(113μg类胡萝卜素)、1 g孢子粉消化上清液组(183μg类胡萝卜素)、1 g孢子粉消化残渣组(226μg类胡萝卜素)和1 g葡萄糖组。取300mL新鲜的肠道菌群发酵液均分在7个无菌且遮光的100mL容器中,分别与7个处理组混合摇匀得混合液。使用注射器于每种混合液中吸取5mL混合液,无菌密封后置于37℃,120 r/min的摇床中振荡发酵,记录接种后2,6,12,18 h和24 h时的累积产气量。
1.4.3 发酵终产物测定 分别收集发酵2,6,12,18μ和24 h等5个时间段的发酵液,置于-80℃冰箱保存。将收集到的发酵液于1 000 r/min离心10min,取上清液,采用酸度计法[15]测定发酵上清液的pH值。在发酵上清液中依次加入苯酚显色液、次氯酸盐溶液显色,30 s内不变色,即呈色稳定后用ZUV-2800 AH型紫外-可见分光光度计在波长550 nm处测定NH3-N含量。根据Broderick等[13]方法,取10mL发酵上清液,加入2.5mL 25%偏磷酸溶液,离心得上清液,用Agilent 6890型气相色谱仪测定乙酸、丙酸和丁酸含量。气相色谱操作条件参考黄晓流等[14]的方法并加以优化,具体如下:
他们有什么不敢收的?你以为李天明把芝水县搞了一场小地震他们就害怕了?周书记明确表示,一场小地震不能改变什么,官场上的一些规则他还是要遵守的。颖春瞪着流泪的眼睛望着我。
气相色谱柱为Agilent 19091F-413 HPFFAR(30m×0.32mm×0.25μm);检测器为FID火焰离子,检测器温度250℃;进样口温度200℃,柱温度90℃;载气为N2,流量17.6 mL/min,分流比7.8∶1;燃气为H2,流量为40 mL/min,空气流量为400mL/min;程序升温设置为初始温度90℃保持1min,后以60℃/min升温到170℃,再以15℃/min升温到200℃,最后以20℃/min升温到220℃保持6.33min。
1.4.4 肠道菌群多样性检测 PCR测序:利用1%琼脂糖凝胶电泳检测抽提的基因组DNA,使用ABI GeneAmp9700型PCR仪进行PCR扩增,用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,然后通过荧光定量、Miseq文库构建等过程得到序列长度[16-18]。
肠道菌群多样性检测:通过Miseq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析。基于OTU可以进行多种多样性指数分析,基于OTU聚类分析结果,对OTU进行多种多样性指数分析,以及对测序深度的检测;基于分类学信息,在各个分类水平上进行群落结构的统计分析[19-21]。在上述分析的基础上,对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学和可视化分析。
1.5 统计分析
用SPSS20.0对数据进行分析以及图表绘制,检测结果用Mean±SD表示。所有试验均重复3次以上,用单因素方差分析比较均值,P<0.05为显著性差异。
2 结果与讨论
2.1 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液产气量的影响
由图1得出产气量随着发酵时间的延长而增加。发酵24 h时,葡萄糖组产气量最大,为3.03 mL;而0.5 g孢子粉消化上清液组产气量最低,仅为0.11mL。消化后孢子组产气量显著性低于未消化孢子组产气量(P<0.05)。消化上清液组产气量显著低于消化残渣组产气量(P<0.05)。与杨风玲等[5]报道的结果相比,产气量的变化趋势与本试验相同,其各组产气量均高于本试验各组产气量。本试验中各组所产NH3-N的值显著大于杨风玲等[5]在未经口、胃、小肠消化的纯类胡萝卜素组中的测量值。通过此试验可知,经消化的孢子粉中类胡萝卜素仍具有促进发酵的特性,适当增加孢子粉含量,提高类胡萝卜素浓度,促进发酵效果显著,说明富含类胡萝卜素的孢子粉可作为一种理想的肠道微生物碳源。0.5 g未消化孢子粉,0.5 g孢子粉经消化残渣和0.5 g孢子粉消化上清液3组的产气量依次递减。由此可知,产气量随着消化程度的增加而减少,孢子中的类胡萝卜素在体内完全消化后不易使人体产生胀气。
2.2 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液pH的影响
由图2得出,在24 h内,各组的pH值均呈现出先降低后升高的状态,在2 h时pH值最高值在6.50~7.23范围,12 h时pH时最低值在5.59~6.93范围。其原因可能为:孢子粉中的类胡萝卜素有降低人体肠道环境pH的作用,由于发酵程度随发酵时间的增长而增大,因此各组降低pH值的作用随着时间的增长而更明显,12 h时各组降低pH的程度最大,12 h后在人体肠道自身调节作用下,肠道pH逐渐恢复最初状态。肠道pH值的变化趋势与杨风玲[5]的测量结果类似,但其各组pH值范围(4.7~5.1)均低于本试验各组pH值范围(5.5~7.3)。葡萄糖组pH最低(5.51~6.59),0.5 g孢子粉消化上清液(6.87~7.25)和1g孢子粉消化上清液(6.28~6.76)pH值接近中性的状态,且与空白对照组6.76~7.15比较接近。未消化孢子组pH值显著性低于消化后孢子组pH值(P<0.05)。消化后上清液组pH值显著性高于残渣组pH值(P<0.05)。其原因可能为:未消化孢子组、消化残渣组、消化上清液组中类胡萝卜素含量依次递减,依次降低肠道pH值的能力依次减弱。
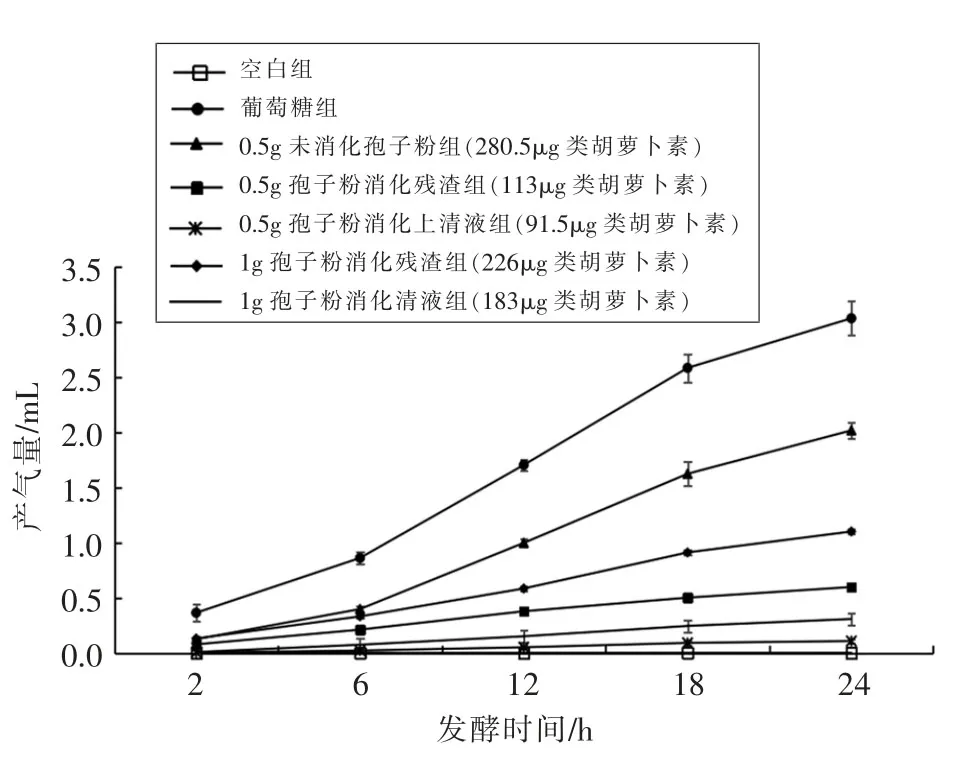
图1 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液产气量的影响Fig.1 Effect of carotenoid produced by Neurospora spore on gas volume of fermentation

图2 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液pH值的影响Fig.2 Effect of carotenoid produced by Neurospora spore on pH value of fermentation
2.3 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液NH3-N的影响

图3 粗壮脉纹孢菌孢子中类胡萝卜素经对发酵液NH3-N的影响Fig.3 Effect of carotenoid produced by Neurospora spore on NH3-N content of fermentation
由图3可看出,各试验组NH3-N含量变化总体趋势一致,均为先上升后下降再上升,发酵12 h达到最高值,发酵18 h达到最低值,发酵24 h后各试验组NH3-N含量均较初始发酵时有所升高。未经消化的孢子粉所产NH3-N含量显著高于已消化的孢子粉(P<0.05),经小肠消化的残渣NH3-N含量显著高于相同剂量对应的上清消化液(P<0.05)。本试验中各组产NH3-N的值显著大于杨风玲等[5]报道的数据。由此可知,NH3-N产量与类胡萝卜素含量成正比。
肠道NH3-N含量代表肠道微生物代谢产生的不利机体健康的有害代谢物,它们在体内的含量直接影响生理功能。研究表明较低的NH3-N含量有利于抑制肠道内有害菌群的生长及避免NH3-N含量过高导致氨代谢负荷加重或氨中毒[25]。消化后的粗壮脉纹孢菌孢子粉在发酵过程中产生的NH3-N含量均低于未消化的孢子粉发酵时产生的NH3-N含量。消化后的类胡萝卜素具有抑制肠道内有害菌群的生长的功效。
2.4 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中短链脂肪酸的影响
2.4.1 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中乙酸的影响 由图4可看出,在体外发酵的24 h内,各组的乙酸含量均为先升高后缓慢下降,在发酵12 h达到最高值,在发酵24 h后各试验组乙酸含量均较初始发酵时稍有升高。乙酸能为肌肉供能及被外周组织利用或促进脂肪组织的合成,乙酸产生的越多提供给机体的能量越多,粗壮脉纹孢菌孢子中类胡萝卜素经消化后有助于产生乙酸,有利于供能肠道细胞[22]。

图4 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中乙酸含量的影响Fig.4 Effect of carotenoid produced by Neurospora spore on acetic acid content of fermentation
2.4.2 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中丙酸的影响 由图5可看出,在体外发酵的24 h内,各试验组的丙酸含量均呈上升趋势。葡萄糖组和未经消化组高于经小肠消化后剩余残渣两组,显著高于经小肠消化后提取物两组和空白对照组。丙酸具有抑制3-羟基-3-甲基戊二酸单酰辅酶A活性,降低胆固醇合成的功效。粗壮脉纹孢菌孢子中类胡萝卜素经消化后丙酸含量增加,有助于降低胆固醇和血糖。
2.4.3 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中丁酸的影响 由图6可看出,体外发酵前期,各组的丁酸含量均明显多于对照组。继续发酵丁酸含量持续增高,发酵时间12 h左右,丁酸含量出现缓慢减小趋势,24 h后各试验组丁酸含量明显高于初始值。丁酸有助于结肠细胞的分化和增殖,是结肠细胞所需能量的最重要来源。近期研究表明丁酸与预防结肠癌有密切相关[23-25]。粗壮脉纹孢菌孢子中类胡萝卜素经消化后产生丁酸,有助于预防结肠癌。

图5 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中丙酸含量的影响Fig.5 Effect of carotenoid produced by Neurospora spore on propionic acid content of fermentation

图6 粗壮脉纹孢菌孢子中类胡萝卜素对发酵液中丁酸含量的影响Fig.6 Effect of carotenoid produced by Neurospora spore on butyric acid content of fermentation
2.5 粗壮脉纹孢菌孢子粉中类胡萝卜素对肠道菌群的影响
由于0.5 g孢子粉组与1 g孢子粉组成分相同,对人体肠道菌群的影响相似,为提高实验效率,选择空白组、葡萄糖对照组和0.5 g孢子粉对应的3个试验组进行试验。
2.5.1 肠道菌群的测序信息 由表1可看出,除0.5 g未消化孢子粉组外,各组序列平均长度均在439~440 bp之间,其中空白组、葡萄糖组以及0.5 g孢子粉消化上清液组测序的平均长度相似,0.5 g孢子粉消化残渣组与空白组对比有一定差距,0.5 g未消化孢子粉与空白对照组对比差异较大。序列长度相似的组别之间物种组成的相似度高。由此可知,粗壮脉纹孢菌孢子中类胡萝卜素在人体内完全消化后,有利于维持人体肠道的稳定与健康[26]。
2.5.2 肠道菌群的序列长度分布 由表2可知,5个样品的序列长度均集中在421~440 bp和441~460 bp的长度范围。大部分试验组在441~460 bp范围的序列数量约为在421~440 bp范围序列数量的两倍,其中0.5 g未消化孢子粉在441~460 bp范围的序列数量约为其在421~440 bp范围序列数量的3倍。

表1 肠道菌群的测序信息Table1 The sequencing information of intestinal flora

表2 肠道菌群的测序长度分布Table2 The sequencing lenth of intestinal flora
2.5.3 肠道菌群的物种多样性指数 多样性指数是用简单的数值表示群落内种类多样性的程度,用来判断群落或生态系统的稳定性指标,是反映丰富度和均匀度的综合指标,多样性指数越大,种群的多样性程度越高,不稳定性就越大。由表3可知,0.5g孢子粉消化上清液物种多样性指数最低为191.59,与空白对照组的195.87接近。0.5 g未消化孢子粉物种多样性指数最高为208.18,完全消化后的孢子粉中的类胡萝卜素对人体肠道菌群多样性的干扰较小,有利于维持人体肠道的稳定,使人体肠道保持在健康状态。

表3 肠道菌群的物种多样性指数Table3 The species diversity index of intestinal flora
2.5.4 肠道菌群的稀释曲线 图7反映样本微生物多样性,比较测序数量不同时样本中物种的丰富度、多样性和均一性。空白对照组所含物种的丰富度最低,0.5 g孢子粉消化残渣中所含物种的丰富度最高。葡萄糖组所含物种的丰富度与0.5 g未消化孢子粉组相近。由此表明,若类胡萝卜素食物在体内未消化,则会使肠道菌群物种数大幅度增长,从而影响肠道菌群原本的稳定性。完全消化的类胡萝卜素,对人体肠道环境的稳定性影响较小。
2.5.5 不同菌种的分布比例 图8显示不同组别中几种常见的肠道菌种的分布比例。
厚壁菌门细菌多为革兰式阳性菌,一般分为芽孢杆菌纲、梭菌纲、柔膜菌纲3个纲,人体健康优势菌群乳杆菌、可产生有益产物丁酸的梭菌、致病能力较强的肠球菌、葡萄球菌都属于厚壁菌门[27]。与空白组相比,除0.5 g未消化孢子粉组外,其它各组的厚壁菌门菌群数量都有所增加,结合前文中短链脂肪酸的测定情况,可初步判断类胡萝卜素使人体肠道中的有益菌梭菌增加,有助于提高人体抵抗结肠疾病的能力,有利于人体健康。
拟杆菌门分为拟杆菌纲、黄杆菌纲、鞘脂杆菌纲3类细菌,人体肠道中的拟杆菌门多为拟杆菌纲类细菌[28]。有研究[29-30]表明,拟杆菌具有维持肠道正常生理以及参与人体的营养吸收功能,膳食中不能被人体吸收的很多种植物多糖能被拟杆菌吸收和降解,并参与脂肪的代谢;此外,能增强宿主固有的免疫反应和调节细菌毒素的产生等。试验结果显示,0.5 g孢子粉消化上清液组拟杆菌门菌群数量与空白组接近,并多于其它试验组。这表明,粗壮脉纹孢菌中的类胡萝卜素发酵性能优于葡萄糖,且消化越完全,拟杆菌门菌群数量越多,对人体健康的不利影响越小。由此说明食用孢子粉时根据个人消化能力来确定合理进食量的重要性。
变形菌门在人体肠道内的代表菌属为肠杆菌属,绝大部分肠杆菌是正常菌群,只有少数为致病菌,例如:致病性大肠杆菌[30]。0.5 g孢子粉消化上清液组的变形菌门菌群数量与空白组接近,并少于其它试验组。这表明在体内完全消化的类胡萝卜素有利于维持人体肠道环境的稳定。0.5 g未经消化孢子粉组和葡萄糖组的变形菌门显著增加,可能会导致人体肠道环境紊乱,人体患病风险增加。
放线菌门仅有放线菌纲和5个亚纲,导致人体患结合病的结合分枝杆菌和导致人体患麻风病的麻风分枝杆菌都属于放线菌门[31]。0.5g孢子粉消化上清液、0.5g孢子粉消化残渣和0.5g未消化孢子粉3组的变形菌门菌群数量与空白组相比均有所减少,且减少程度依次增加,此现象表明类胡萝卜素使人体肠道内的放线菌门菌群减少,从而减少人体的患病风险。

图7 肠道菌群的稀释曲线Fig.7 The dilution curve of intestinal flora

图8 不同菌种的分布比例Fig.8 The distribution proportion of different bacterium
3 结论
通过对产气量、pH、NH3-N、短链脂肪酸以及肠道菌群多样性的测定,探究粗壮脉纹孢菌孢子中类胡萝卜素的体外消化特性。结果表明:消化后的孢子粉中的类胡萝卜素经体外发酵,pH值趋于6.0~7.2与人体肠道pH值接近,产气量较少,不易引起胀气,可产生的乙酸、丙酸、丁酸等有益于人的身体健康的短链脂肪酸,有利于改善人体肠道菌群,优化其中各菌属的比例,有益于人体的肠道健康。
