藜蒿叶中1,4-双咖啡酰奎宁酸的鉴定及双咖啡酰奎宁酸类化合物体外抑制黄嘌呤氧化酶和抑制尿酸钠诱导IL-1β的构效关系
2020-03-06曹伟伟方雅静程玉鑫潘思轶徐晓云
曹伟伟 吴 婷 方雅静 程玉鑫 潘思轶 徐晓云
(华中农业大学食品科学技术学院 武汉430070)
黄嘌呤氧化酶(XOD)是嘌呤代谢过程中的关键酶,主要催化次黄嘌呤和黄嘌呤为尿酸。过高的XOD活性会导致尿酸的生成过多,进而诱发高尿酸血症、痛风等多种常见代谢性疾病[1]。当尿酸在机体的水平超过其饱和浓度时,导致其以尿酸钠(MSU)晶体形式沉积于组织中,进而引起促炎因子白细胞介素1β(IL-1β)的分泌等痛风炎症反应[2]。常见的XOD抑制剂别嘌醇和缓解痛风炎症药物秋水仙碱是临床上常用的降尿酸和抗痛风炎症的药物,然而,这些药物具有胃肠不适、肝肾损伤等副作用[3-4]。而天然植物化合物由于在抑制XOD活性和MSU介导的炎症方面具有双重效果、副作用小等优势而受到越来越多的关注[5-6]。筛选并评价天然膳食化合物对于XOD和痛风炎症的抑制具有重要意义。
藜蒿(Artemisia selengensis Turcz)属于菊科蒿属植物,是一种主要种植在我国南方区域的蔬菜,嫩茎常供食用。藜蒿富含多酚和三萜等活性成分,古籍中报道其可用于治疗发热、风湿病和肝炎等多种疾病[7]。近年的研究表明,藜蒿具有抑制XOD[8]、炎症因子白细胞介素6(IL-6)分泌[9]等多种药理活性。双咖啡酰奎宁酸(di-CQA)是一类常见的存在于咖啡、茶叶、蔬菜等植物中的多酚类化合物[10-12],由于咖啡酸的取代位置不同,共有6种同分异构体[13](结构如图1所示)。目前,已有关于藜蒿叶中的1,3-diCQA、3,4-diCQA、3,5-diCQA和4,5-diCQA抑制XOD的活性报道[14],然而藜蒿叶中是否存在其它结构的di-CQA,以及不同的di-CQA化合物抑制XOD活性的结构特征尚未见系统报道。
本研究首次从藜蒿叶中鉴定出1,4-diCQA,与其它di-CQA相比,1,4-diCQA在植物中分布较少,仅在朝鲜蓟(Cynara scolymus L.)[15]、蓖齿蒿(Artemisia pectinate)[16]等少数植物中有报道。目前1,4-diCQA仅有抑制黑色素生成的报道[17],而其它的活性研究鲜有报道。
研究表明di-CQA化合物具有抗炎活性。从藜蒿叶中分离的1,3-diCQA可抑制肿瘤坏死因子(TNF-α)刺激的MG-63细胞分泌IL-6[9]。富含3,4-diCQA、3,5-diCQA和4,5-diCQA的苦丁茶提取物可抑制脂多糖(LPS)诱导的RAW264.7巨噬细胞的炎症反应[18-19]。现有关于di-CQA的抗炎研究中,炎性的诱导方式、引发的炎症反应与MSU引起的炎症因子IL-1β并不相同。痛风炎症因子IL-1β的分泌由两条信号通路共同调节:首先,脂多糖(LPS)或者其它NF-κB激活剂作为第1刺激信号激活NF-κB通路;其次,MSU作为第2刺激信号激活NLRP3炎症小体,将pro-IL-1β前体蛋白切割成分泌的IL-1β[20]。目前di-CQA单体能否抑制MSU诱导的IL-1β分泌尚不清楚,其相关抑制作用的构效关系研究亦未见报道,这限制了膳食中di-CQA在降尿酸和抗痛风炎症方面的应用。
本文采用HPLC-Q/TOF-MS对藜蒿叶提取物中的di-CQA进行定性、定量分析,同时,研究了di-CQA抑制XOD和抑制MSU诱导的IL-1β的结构特征。本研究为藜蒿及其它膳食中分布广泛的di-CQA应用于预防高尿酸血症和痛风提供了借鉴。
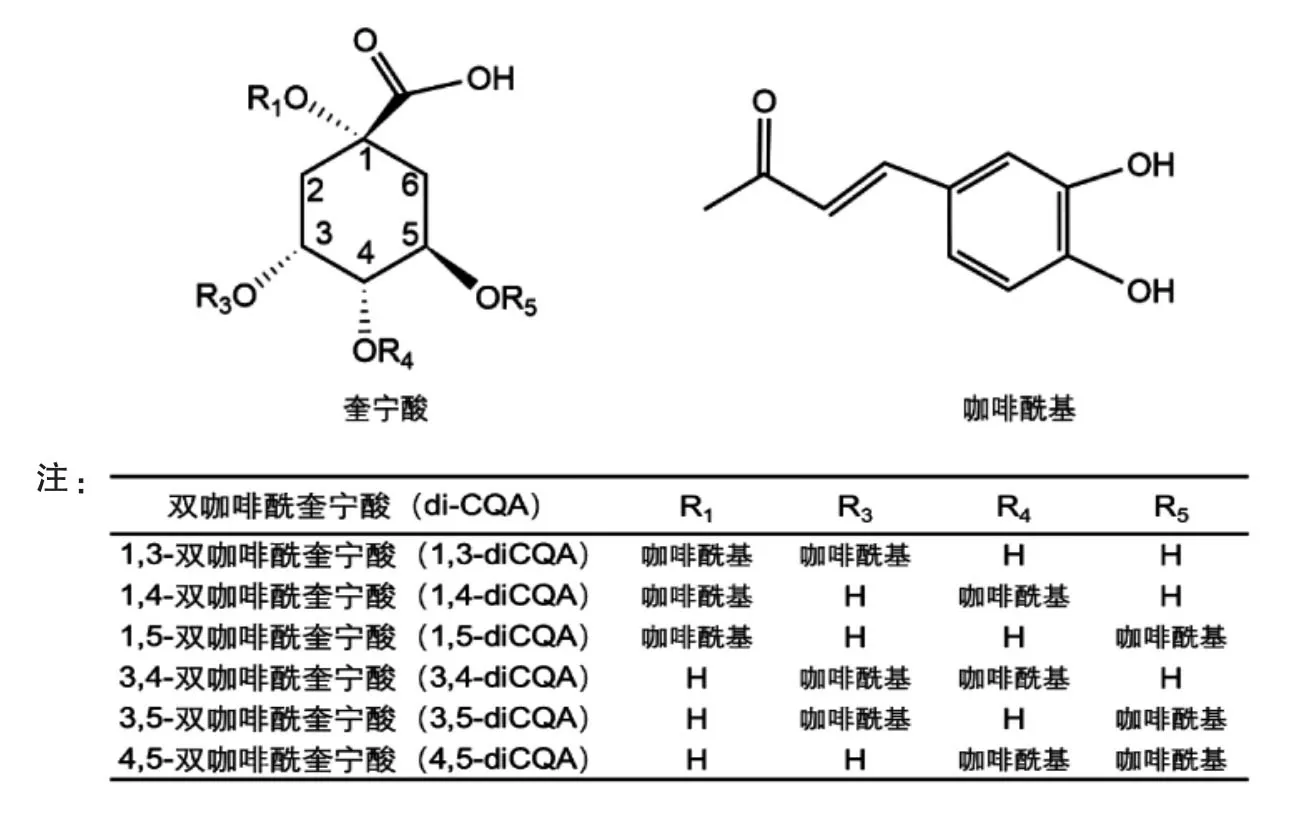
图1 不同di-CQA的结构Fig.1 Structures of different di-CQAs
1 材料和方法
1.1 试验材料及试剂
藜蒿叶由武汉荷香源农业发展有限公司提供。藜蒿叶经50℃烘箱干燥12 h后,用粉碎机粉碎,所得粉末样品于-20℃下保存。
XOD、黄嘌呤、LPS和佛波酯(PMA),美国Sigma-Aldrich公司;RPMI-1640培养基,美国Hyclone公司;别嘌醇(纯度>98%),上海源叶生物科技有限公司。乙腈和甲酸(色谱级),Thermo Fisher公司。3,4-diCQA、3,5-diCQA、4,5-diCQA和1,5-diCQA标准品(纯度>98%),上海源叶生物科技有限公司。IL-1β的酶联免疫吸附(ELISA)试剂盒,欣博盛生物科技有限公司。
1.2 主要仪器及设备
HPLC-Q/TOF-MS,美国Agilent公司;MULTISKAN GO多功能酶标仪,美国Thermo Fisher公司;R-1001VN旋转蒸发仪,郑州长城科工贸有限公司;KQ-300DA超声波清洗器,昆山市超声仪器有限公司;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司。
1.3 试验方法
1.3.1 藜蒿叶提取物的制备 藜蒿叶用50%乙醇(料液比1∶15)在室温下超声提取2次,然后真空浓缩,将浓缩提取物依次用石油醚、乙酸乙酯进行萃取分离,弃石油醚相,保留乙酸乙酯相,将其在真空条件下蒸发完全,然后冷冻干燥即得藜蒿叶提取物。
1.3.2 藜蒿叶提取物di-CQA的定性、定量分析 采用HPLC-Q/TOF-MS对藜蒿叶提取物中的di-CQA进行定性、定量分析。色谱柱:安捷伦Zorbax SB-C18柱(250mm×4.6mm,5μm);柱温:25°C,流速:1mL/min。流动相:0.1%(体积分数)甲酸/水A和乙腈B。洗脱方法:0~10min,10%B;10~15min,15%B;15~17min,18%B;17~37min,18%B;37~42 min,50%B;42~48 min,65%B;48~52 min,80%B;52~58min,80%B;58~62min,10%B,检测波长:325 nm,进样体积:8μL。根据1,5-diCQA标准曲线(y=107x-91633,R2=0.9997),藜蒿叶提取物中各di-CQA的含量均用1,5-diCQA物质的量表示。
负离子模式下采集质谱数据,参数如下:质荷比m/z:100~1 100;毛细管电压:3.5 kV;雾化器压力:3.4×105Pa;干燥气流:10.0 L/min;去溶剂温度:325℃;碎裂电压:175V;碰撞能量:10~40 V。
1.3.3 细胞培养和加药处理 THP-1细胞(购于上海细胞库)生长所需的完全培养基为含10%FBS、1%双抗和50μmol/Lβ-巯基乙醇的RPMI-1640培养基,将细胞在37°C,5%CO2条件下培养。药物处理组:药物处理前,先用100ng/mL的PMA处理12 h诱导THP-1细胞分化为巨噬细胞,去除非贴壁细胞,在完全培养基中培养24 h,用不同的di-CQA单体(100μmol/L)预处理12 h,然后用LPS(1μg/mL)孵育细胞2 h,MSU(200μg/mL)继续刺激4 h。对照组THP-1巨噬细胞不做药物处理,模型组仅用MSU刺激LPS预孵育的THP-1巨噬细胞,不加di-CQA预处理。
1.3.4 细胞存活率的测定 参考李慧等[21]的方法,测定不同di-CQA对MSU刺激的LPS预孵育的THP-1巨噬细胞存活率的影响。按照1.3.3节所述步骤刺激后,将MTT(0.5mg/mL)加入细胞培养2 h,最后加入150μL二甲基亚砜溶解细胞中的甲臜,采用酶标仪测定波长490 nm处的吸光度。
1.3.5 IL-1β的测定 细胞加药处理结束后,收集细胞上清。按照ELISA试剂盒说明书,检测上清液中IL-1β的含量。
1.4 统计分析
所有试验均重复3次,结果用平均值±标准差(SD)表示。采用SPSS 16.0软件的单因素方差分析进行显著性检验,显著性水平设置为P<0.05。
2 结果和讨论
2.1 藜蒿叶提取物di-CQA的定性、定量分析
通过与标准品的色谱保留时间、质谱碎片信息比对的方法鉴定藜蒿叶中的di-CQA。由图2和表1可知,藜蒿叶提取物中(峰2~5)4个峰的保留时间、最大紫外吸收波长、母离子[M-H]-、碎片离子及其相对丰度与3,4-diCQA、1,5-diCQA、3,5-diCQA和4,5-diCQA这4种di-CQA标准品一致,也与Zhang等[22]报道的藜蒿叶中的di-CQA质谱信息一致,因此,藜蒿叶提取物中的这4种化合物(峰2~5)分别为3,4-diCQA、1,5-diCQA、3,5-diCQA和4,5-diCQA。
藜蒿叶提取物中峰1母离子[M-H]-为515.1224,其碎片离子m/z 203相对丰度为49%(以m/z 353为基峰),该碎片离子从未在以前关于藜蒿叶di-CQA结构的鉴定研究中报道,与Clifford等[13]采用液-质谱联用鉴定的1,4-diCQA碎片离子的相对丰度接近,峰1也与1,4-diCQA标准品的保留时间、最大吸收波长、母离子和碎片离子信息一致,因此,藜蒿叶提取物中峰1对应的化合物为1,4-diCQA。本研究首次报道了1,4-diCQA存在于藜蒿叶中。以上研究表明,藜蒿叶含有除1,3-diCQA外所有的di-CQA异构体,藜蒿是多种di-CQA的膳食来源。
通过外标法测定了藜蒿叶提取物中di-CQA的含量。由表1可知,藜蒿叶提取物中不同di-CQA含量从高到低排序为3,5-diCQA(13.06%)>1,5-diCQA(6.85%)>4,5-diCQA(4.72%)>3,4-diCQA(1.39%)>1,4-diCQA(0.39%)。其中,1,4-diCQA含量显著低于其余4种di-CQA,这也可能是以前关于藜蒿化学成分的研究未报道1,4-diCQA存在的原因。
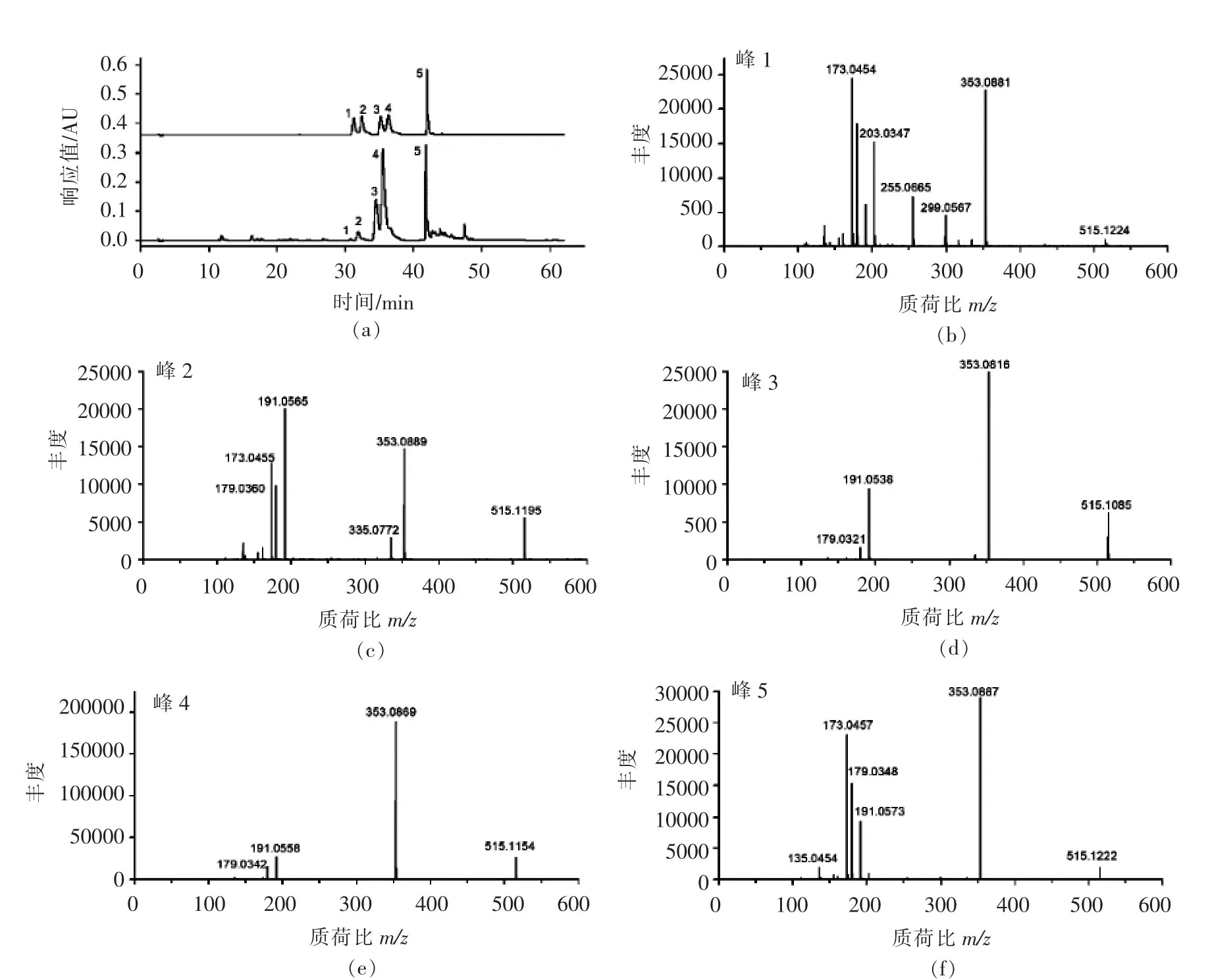
图2 藜蒿叶提取物和di-CQA标品的液相色谱图(a)及5种di-CQA的二级质谱图(b-f)Fig.2 HPLC chromatogram of Artemisia selengensis Turcz leaf extract and five di-CQA standards(a),MS2 spectra of five di-CQA standards(b-f)

表1 藜蒿叶提取物中di-CQA的定性、定量分析Table1 Qualitative and quantitative analysis of di-CQAs in Artemisia selengensis Turcz leaf extract
2.2 di-CQA抑制XOD的定性构效关系研究
由表2可知,6种di-CQA抑制XOD的IC50值的大小排序为:1,4-diCQA>别嘌醇>1,5-diCQA>1,3-diCQA>4,5-diCQA>3,4-diCQA>3,5-diCQA,其中4,5-diCQA抑制XOD的活性大于3,4-diCQA,该结果与Chen等[23]的报道一致。1,4-diCQA抑制XOD的活性显著高于其余5种di-CQA和阳性药别嘌醇,说明C1和C4取代对于提高di-CQA对XOD的抑制活性至关重要。通过比较相似结构的化合物抑制XOD的活性,可以获得有利于di-CQA抑制XOD的活性取代位置。如从1,3-diCQA>3,4-diCQA>3,5-diCQA抑制XOD的效果可以得到咖啡酸的C1取代>C4取代>C5取代;从1,4-diCQA>1,5-diCQA>1,3-diCQA抑制XOD的效果中可以得到咖啡酸的C4取代>C5取代>C3取代。定性构效关系表明,di-CQA不同咖啡酸取代位置对其抑制XOD的大小排序为C1取代>C4取代>C5取代>C3取代。
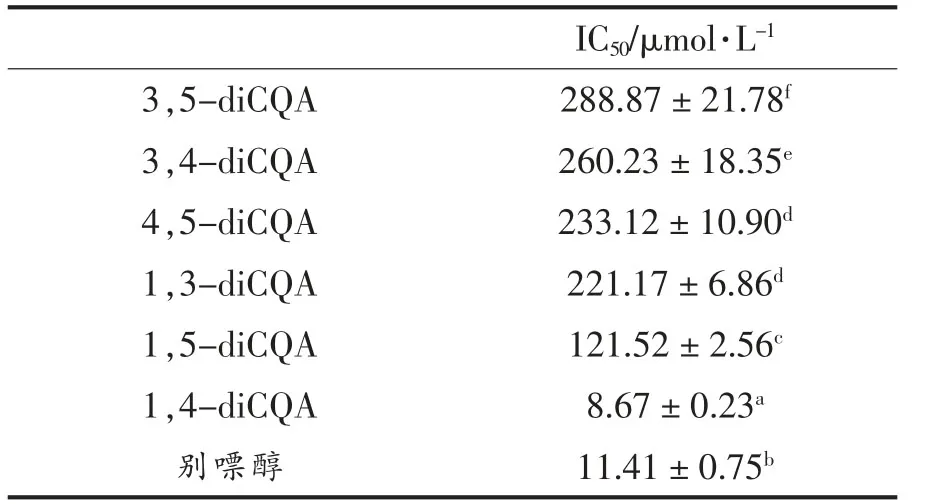
表2 不同di-CQA抑制XOD的IC50值Table2 The IC50 of different di-CQAs on XOD inhibition
2.3 di-CQA抑制MSU诱导的IL-1β的定性构效关系研究
IL-1β是痛风炎症发生过程中重要的炎症因子[20]。采用MSU刺激的LPS预孵育的THP-1巨噬细胞模型研究了6种di-CQA单体在浓度100 μmol/L时对IL-1β分泌的影响。MTT结果(图3a)表明,在浓度100μmol/L时,不同结构的di-CQA处理MSU刺激的LPS预孵育的THP-1巨噬细胞的存活率与对照组无显著性差异,表明不同结构的di-CQA对THP-1巨噬细胞无细胞毒性。图3b所示,1,3-diCQA和3,5-diCQA在浓度100μmol/L时对MSU诱导的IL-1β分泌无抑制效果,与其它di-CQA相比,1,4-diCQA和1,5-diCQA在该浓度下抑制MSU诱导的IL-1β分泌能力更强,然而二者的抑制能力无显著性差异。4种di-CQA在浓度100μmol/L时对MSU诱导的IL-1β分泌的抑制率分别为:1,5-diCQA(52.25%)、1,4-diCQA(46.87%)、4,5-diCQA(36.30%)和3,4-diCQA(18.96%),这表明不同咖啡酸的取代位置会影响di-CQA对MSU诱导的IL-1β分泌的抑制作用。
通过比较MSU诱导IL-1β的抑制率大小,可以获得有利于di-CQA抑制该活性的取代位置。从1,4-diCQA>4,5-diCQA>3,4-diCQA抑制MSU诱导的IL-1β效果可以得到C1取代>C5取代>C3取代;从1,4-diCQA=1,5-diCQA抑制IL-1β的效果可以得到C4取代=C5取代;从3,4-diCQA>3,5-diCQA抑制IL-1β的效果可以得到C4取代>C5取代。di-CQA的不同咖啡酸取代位置对其抑制IL-1β的大小排序为C1取代>C5取代>C3取代,C4取代≥C5取代。

图3 不同di-CQA对细胞存活率(a)及MSU诱导的IL-1β分泌的影响(b)Fig.3 Effects of different di-CQAs on cell viability(a)and MSU-induced IL-1βsecretion(b)
2.4 di-CQA抑制XOD与抑制MSU诱导的IL-1β的相关性分析
由表3可知,di-CQA抑制XOD的IC50与对MSU诱导的IL-1β抑制率呈显著负相关性(P<0.01),皮尔逊相关系数为-0.674。这表明di-CQA抑制XOD的能力与其抑制MSU诱导的IL-1β活性正相关,提示di-CQA可能通过抑制XOD发挥抑制MSU诱导的IL-1β的活性。此外,MSU引起的IL-1β分泌与活性氧水平升高、NLRP3炎症小体的激活相关[20]。di-CQA是否也可通过作用上述信号通路达到抑制MSU诱导的IL-1β,需进一步深入研究。

表3 di-CQA抑制XOD与IL-1β的相关性分析Table3 Correlation analysis of the XOD inhibitory activity and IL-1βinhibitory activity of di-CQAs
3 结论
本研究首次发现了1,4-diCQA存在于藜蒿叶中。定性构效关系表明,不同咖啡酸取代位置对di-CQA抑制XOD的影响强弱为C1取代>C4取代>C5取代>C3取代;对di-CQA抑制MSU诱导的IL-1β的影响强弱为C1取代>C5取代>C3取代,C4取代≥C5取代。同时,di-CQA抑制XOD的活性与抑制MSU诱导的IL-1β活性具有正相关性。本研究系统阐释了di-CQA化合物抑制XOD和抑制MSU诱导的IL-1β的结构特征,提示藜蒿作为食品具有降尿酸、抗痛风炎症的潜在应用价值。
