结肠癌组织中CDC6的表达及临床意义
2020-03-05罗志飞黄幼生阮细玲张艺馨王惟江王敏健
罗志飞,黄幼生,解 娜,杨 丞,阮细玲,张艺馨,王惟江,王敏健
结肠癌是我国最常见的恶性肿瘤之一,抑制结肠癌细胞的增殖、侵袭、转移是提高患者生存率的重要途径,寻找结肠癌增殖、侵袭、转移的分子靶标对判断预后、设计靶点药物及提高治疗水平具有重要意义[1]。CDC6属于ATP酶家族成员之一,是形成复制前复合物的主要成分,参与DNA复制,促进细胞周期转换,诱导细胞增殖[2-3],在多种肿瘤中存在高表达[4-8],但在结肠癌组织中的表达尚不清楚。本文应用免疫组化MaxVision法检测CDC6在结肠癌组织中的表达,并分析其与结肠癌临床病理特征及预后的关系。
1 材料与方法
1.1 材料收集2011~2012年海南医学院第一附属医院病理科存档的121例结肠癌标本,所有病例均有完整的临床病理资料,其中73例有5~6年的随访资料,患者术前均未接受放、化疗。本实验采用AJCC第8版对结肠癌进行病理分期。
1.2 组织芯片制作以结肠癌、癌旁正常黏膜组织制作芯片,光镜下选择HE标本进行定位、标记(避免出血、坏死等部位)。每个标本取2个位点,按18×12的阵列按顺序排放,在阵列孔的左上方第一排的第一个孔放置正常肝组织,避免混淆。
1.3 免疫组化采用免疫组化MaxVision法进行染色。常规切片、脱蜡、水化,经3%H2O2封闭内源性过氧化物酶5 min。1 mmol/L Tris-EDTA(pH 8.0)煮沸修复30 min,CDC6一抗(1 ∶400,Abcam公司)37 ℃ 1 h。PBS清洗5 min×3次,二抗(福州迈新公司)孵育20 min。PBS清洗5 min×3次,DAB显色(福州迈新公司),苏木精衬染1 min。以PBS代替一抗作为阴性对照。
1.4 结果判读CDC6阳性着色为细胞质及细胞核着色,呈棕黄色至棕褐色。根据细胞着色强度计分:浅棕色为1分,棕黄色为2分,深棕色为3分;根据阳性细胞数百分比计分:<5%为1分,≥5%为2分。两者评分结果相乘作为最终评判:<3分为低表达,≥3分为高表达。
1.5 统计学分析采用SPSS 18.0软件进行统计学分析,计数资料用百分比或率表示,采用χ2检验;CDC6表达与结肠癌临床病理特征的关系采用χ2检验比较;应用Kaplan-Meier进行生存曲线描绘,并用Log-rank检验进行比较分析,以Cox回归模型进行多因素分析,筛选预后相关因素。显著性检测水准α值=0.05,P<0.05差异有统计学意义。
2 结果
2.1 CDC6在结肠癌及癌旁正常黏膜组织中的表达在癌旁正常黏膜组织中,CDC6不表达或低表达,均为细胞核着色,阳性率为5.79%(7/121)。CDC6在结肠癌组织为细胞质、细胞核双表达,以细胞质表达为主,阳性率为80.2%(97/121),细胞核阳性率为29.8%(36/121),总阳性率为93.39%(113/121),强阳性率为68.60%(83/121);与癌旁正常黏膜组织相比,差异有显著性(P<0.001,图1)。
2.2 CDC6表达与结肠癌临床病理特征的关系CDC6的表达与临床分期及远处转移明显相关(P<0.05);与淋巴结转移明显相关(P<0.05),N0+N1期结肠癌CDC6表达强度明显低于N2期结肠癌,差异有显著性(P<0.05);但CDC6表达与患者性别、年龄等无关(P>0.05,表1)。
2.3 CDC6表达与结肠癌患者预后的关系121例结肠癌患者中93例进行随访,其中73例有完整的5年随访资料,对73例进行Kaplan-Meier法生存分析,结果显示CDC6高表达组的中位生存期(54.49个月)明显低于低表达组(69.09个月),差异有统计学意义(F=4.07,P=0.047);CDC6低表达组5年生存率为81.82%(18/22),明显高于高表达组54.9%(28/51),差异有显著性(χ2=17.19,P<0.01,图2)。
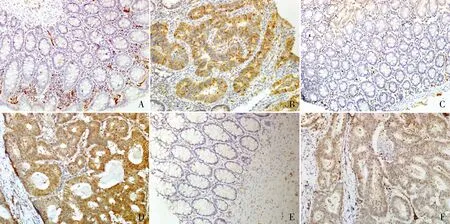
图1CDC6在结肠癌、癌旁正常黏膜组织中的表达,MaxVision法:A.例1癌旁正常黏膜组织中CDC6呈阴性;B.例1结肠癌组织CDC6细胞呈阳性;C.例2癌旁正常黏膜组织中CDC6呈阴性;D.例2结肠癌组织中CDC6呈细胞核、细胞质阳性;E.例3癌旁正常黏膜组织中CDC6呈阴性;F.例3结肠癌组织中CDC6呈细胞核阳性

表1 结肠癌临床病理特征与CDC6表达的关系
2.4 结肠癌患者预后Cox多因素分析经χ2检测,结肠癌患者生存状态与临床分期、肿瘤分级、浸润深度、淋巴结转移、远处转移及CDC6高表达相关(表2)。进一步Cox多因素回归分析表明肿瘤远处转移、临床分期及CDC6高表达是结肠癌预后的独立风险因素(表3)。
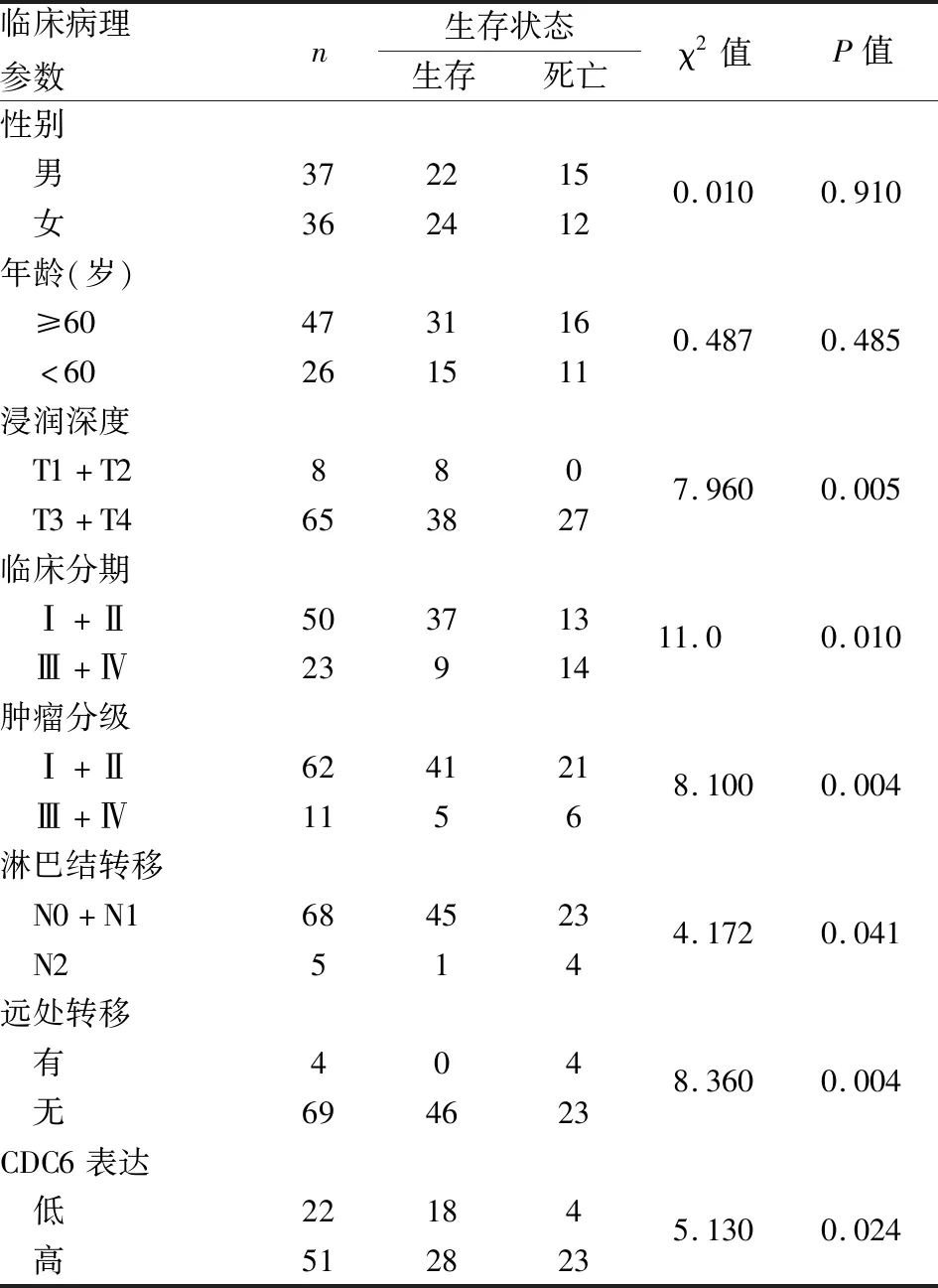
表2 结肠癌临床病理特征、CDC6表达与预后的关系

表3 Cox回归模型分析结肠癌患者预后

图2 CDC6表达结肠癌患者的生存曲线
3 讨论
细胞周期紊乱是肿瘤最主要的发生机制之一。结肠癌中也存在多种基因异常导致其细胞周期紊乱[2]。CDC6基因位于人类基因17q21.2,真核细胞中CDC6蛋白是ATP结合蛋白和复制前复合体(pre-replication complexes, pre-RC)成员,是细胞起始DNA复制的必需蛋白[2];其主要功能是结合起始识别复合物(ORC)、CDT1和MCM复合体(含MCM2-7蛋白),以ATP依赖的方式组装在ORC后,将MCM蛋白加载到DNA上,促进细胞从G1期进入S期[2-3]。除起始DNA复制外,CDC6还可抑制有丝分裂期细胞周期蛋白CDK1的活性,影响细胞分裂增殖,参与细胞恶性转化[3,6]。CDC6在正常组织细胞复制时,仅在G1期呈瞬时高表达;在肿瘤组织中却存在持续高表达,促进细胞周期转换,诱导细胞增殖。已有研究发现,CDC6在肝癌[5]、子宫颈癌[6]、乳腺癌[7]等多种恶性肿瘤中高表达。本实验发现CDC6在结肠正常组织中表达缺失;或在结肠隐窝底部呈散在核表达;在大部分结肠癌组织中呈细胞质和细胞核的高表达,可促进细胞持续G1/S期转换,进而导致结肠上皮恶性转化。
吕波等[5]报道CDC6的高表达可促进肿瘤转移,如肝癌的淋巴结转移患者其肿瘤组织中CDC6表达明显升高。Deng等[9]采用免疫组化法研究发现,与正常卵巢组织相比,卵巢癌组织中CDC6蛋白水平升高,CDC6表达与FIGO分期、分化程度、腹水、腹水恶性肿瘤细胞及淋巴结状态显著相关。本实验结果显示,CDC6的高表达与结肠癌患者淋巴结转移数量、临床分期及远处转移密切相关;高表达CDC6患者生存期明显低于CDC6低表达患者,Cox回归分析提示,CDC6高表达是结肠癌预后的独立风险因素。
CDC6过表达能促进肿瘤增殖,有研究认为可能与CDC6高表达抑制癌细胞凋亡有关[9-11]。CDC6的过表达能通过调控BCR/ABL信号通路抑制慢性髓系白血病细胞凋亡[10]。Karanika等[11]研究认为CDC6过表达显著降低AR信号抑制剂Enzalutamide和Chk1/2抑制剂AZD7762诱导的细胞凋亡,在进展性前列腺癌中表达增加,通过抑制AR-CDC6-ATR-Chk1信号通路,能靶向前列腺癌的DNA损伤应答。在体外血清饥饿释放过程中卵巢癌细胞系HO8910细胞内CDC6、Cyclin D1和PCNA的表达上调,而p16的表达下调。此外,下调CDC6可降低细胞增殖和集落形成[9];提示CDC6可作为恶性肿瘤潜在的治疗靶点。
CDC6在结肠癌中的作用报道较少,罗金现等[12]分别对结直肠癌显著差异的基因作GO富集、KEGG通路以及蛋白质相互作用网络分析,筛选出CDC6等多个与结直肠癌发生、发展关系密切的关键基因。应用TCGA数据库信息学分析CDC6在各肿瘤中的表达丰度,发现CDC6在结肠癌中表达明显高于正常组织,本实验结果证实CDC6在结肠癌组织中高表达,与结肠癌转移、分期及预后不良有关,然而其具体作用机制尚不明确,进一步深入分析将有助于阐明结肠癌发生、发展机制,为结肠癌治疗提供新的治疗靶点。
