异种源复合益生菌对杜滇仔猪肠道微生物多样性的影响
2020-03-05刘韶娜相德才赵智勇赵素梅赵彦光
刘韶娜, 郭 飞, 张 斌, 相德才, 赵智勇, 赵素梅*, 赵彦光*
(1. 云南省畜牧兽医科学院,云南 昆明 650224;2. 云南农业大学 动物营养与饲料重点实验室,云南 昆明 650201)
滇南小耳猪属于华南型地方猪种,主产于云南省西双版纳州、德宏州和临沧地区等,是优质的地方猪品种之一,具有耐高温高湿、耐粗饲、抗逆性强、早熟易肥、肉质细嫩等优点,但是由于生长缓慢、体型小和产仔数低等缺点[1]限制了该品种的应用推广和产业化发展,所以需要对其进行杂交,提高生产效率。有研究表明,代乳粉可以替代母乳,可以缩短母畜空怀时间,增加年产胎次,从而提高母畜利用率;提高弱畜的生长性能[2],对提高滇南小耳猪的生产效率具有重要的意义。但超早期断奶和补饲措施可使消化道营养物质发生改变,从而引起消化道微生物丰度和多样性的变化[3-6]。益生菌具有促生长[7]、提高免疫[8]及抑菌[9]等作用,通过微生物的新陈代谢及代谢产物促进营养的消化和吸收、增强细胞免疫等功能[10-12]。复合益生菌的促生作用更优于单一益生菌。本研究所用的复合益生菌由本实验室从迪庆藏猪肠道中分离所得,将其添加到杜洛克×迪庆藏猪超早期断奶(7 d)仔猪的代乳粉中,能够提高与碳水化合物代谢和抗肠道炎症相关的菌群相对丰度,但对杜滇猪超早期断奶(7 d)仔猪肠道微生物多样性的影响还未见报道。通过研究应用于迪庆藏猪消化道的复合益生菌对杜滇猪肠道微生物多样性的影响,为探索复合益生菌的应用范围,开发新的功能性微生物饲料添加剂提供参考。
1 材料与方法
1.1 材料
1.1.1 试验材料 复合益生菌制剂均由本实验室从迪庆藏猪盲肠内容物和粪便中分离的乳酸菌和芽胞杆菌制得,其中含有类肠膜魏斯氏菌(Weissellaparamesenteroides)、植物乳杆菌(Lactobacillusplanturum)、戊糖片球菌(Pediococcuspentosaceus)、枯草芽胞杆菌(Bacillussubtilis)、赖氨酸芽胞杆菌(Lysinibacillus)和贝莱斯芽胞杆菌(Bacillusvelezensis)。
1.1.2 试验日粮 参照国标NY/T65-2004肉脂型地方猪3~8 kg的标准,利用VF123软件计算配置粉状配合饲料,组成和营养成分见表1。代乳粉∶水按1∶6(体积比)冲调代乳粉,水温50~65 ℃。试验组DD和DY组添加复合益生菌,添加量见参考文献[7-8,11](表2)。

表1 代乳粉组成及营养水平
1.1.3 主要仪器与试剂 DNA抽提试剂盒(E.Z.N.A.®Soil DNA Kit,Omega Bio-Tek公司);琼脂糖(biowest公司);FastPfu聚合酶(天根生化科技有限公司);AxyPrep DNA Gel Extraction Kit(爱思进生物技术有限公司);建库试剂盒(NEXTFLEX Rapid DNA-Seq Kit,Bioo Scientific公司);测序试剂盒(MiSeq Reagent Kit v3,Illumina公司)。高速台式冷冻离心机(Eppendorf 5424R,Eppendorf公司);超微量分光光度计(NanoDrop2000,Thermo Fisher Scientific公司);酶标仪(BioTek ELx800,Biotek公司);旋涡混合器(QL-901,海门其林贝尔仪器制造有限公司);粉碎研磨仪(TL-48R,上海万柏生物科技有限公司);MP研磨仪(FastPrep-24 5G,MP公司);微型荧光计(QuantusTMFluoromete,Promega公司);电泳仪(DYY-6C,北京市六一仪器厂);PCR仪(ABI GeneAmp®9700型,ABI公司);Illumina Miseq测序仪(Illumina公司)。

表2 试验DD、DY组所用益生菌的添加量
1.2 方法
1.2.1 试验设计 选择10窝日龄相近的杜洛克×滇南小耳猪哺乳仔猪,随机挑选初生体重接近的乳仔猪,每窝挑选3头,共计30头,雌雄各半。按照血缘和性别随机分为3组,每组10头,2个重复,每个重复为1栏饲养。DM组跟随母猪哺乳,DY组与DD组于7日龄断奶,DD组哺喂代乳粉,DY组哺喂代乳粉+复合益生菌,试验期为21 d。DY组和DD组仔猪于试验第15天开始补饲代乳粉至试验结束。试验结束当天收集粪便样品,每组收集4个粪便样品,取刚排泄的粪便中间部分,置于冻存管中,在液氮中速冻后取出,于-80 ℃冰箱保存,采用IIIumina技术分析粪便微生物组成。
1.2.2 饲养管理 试验前正常免疫程序,DM组跟随母猪哺乳,DD、DY组哺喂相对应的代乳粉(液态),每天哺喂6次,从早晨8:00开始,每3 h哺喂一次,自由饮水。
1.2.3 成分测定 参照文献[13]测定分析方法,测定代乳粉中的各营养物质的含量。
1.2.4 16S rDNA PCR扩增 使用试剂盒 E.Z.N.A®soil DAN Kit抽提总DNA,用NanoDrop2000对提取的 DNA浓度和纯度利进行质量检测;用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3~V4可变区进行PCR扩增,回收并纯化,Tris-HCl 洗脱,电泳检测。利用 QuantiFluorTM-ST (Promega, USA) 进行检测定量。
1.2.5 高通量测序及数据分析 原始测序序列使用 Trimmomatic 软件质控并用 FLASH 软件进行拼接。根据 Illumina MiSeq平台构建 PE×300 的文库。按照97%的相似度对分析的序列进行OTU聚类,并去除单序列和嵌合体,在I-Sanger云平台对每条序列进行物种分类注释。采用SPSS17.0 统计软件进行单因素方差分析(one-way ANOVA),以Duncan进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。 数据以平均值±标准差表示,n=3。
2 结果与分析
2.1 对粪便细菌菌群结构的影响
2.1.1 OTU聚类分析 平均每个试验样品获得52 966条高质量序列,平均长度为471.58 nt。将相似性97%的序列聚类成一个OTU,12个粪便样品共获得1 105个OTU,聚类为19个门、27个纲、49个目、89个科、250个属、471个种。韦恩图分析如图1所示,3组共有的OTU数为355,其中DM独有的OTU数为242,DD组独有的OTU数为133,DY组为84。由此可见,DM组特有的OTU数最多,DD组特有的OTU数多于DY组。DM、DD和DY组OTU总数分别为814、656和610,说明仔猪采食代乳粉后,粪便中细菌的种类下降。
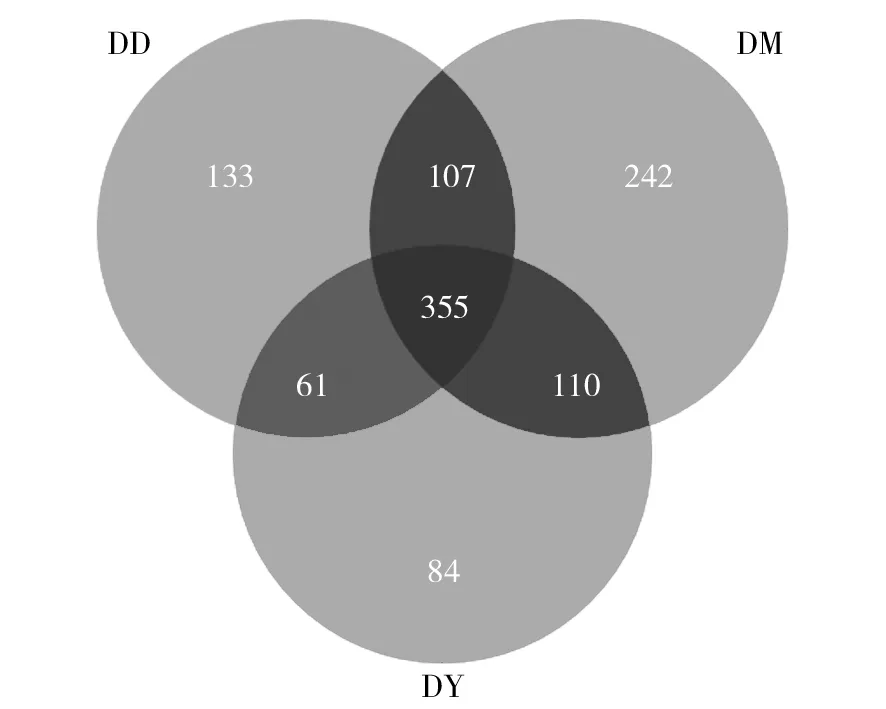
图1 OTU韦恩图Fig.1 Venn diagram based on OTU
2.1.2 Alpha多样性分析 Alpha多样性分析见表3,本研究中测序覆盖度均在99.8%以上,测序的深度和广度符合要求,数据合理。DY 组的Ace指数和Chao1指数均低于DD组(P>0.05)和DM组(P<0.05),Shannon指数显著低于DM组(P<0.05),Simpson指数则高于DY组和DD组(P>0.05),说明哺喂代乳粉后,粪便中微生物多样性下降,但不显著(P>0.05),代乳粉中添加异种源复合益生菌后,粪便中细菌多样性则无显著变化(P>0.05)。

表3 Alpha多样性分析
2.1.3 Beta多样性分析 基于Unweighted Unifrac加权距离的PCoA分析和基于Weighted Unifrac距离的PCoA分析如图3、图4所示,其中一个主要成分(PC1)用横坐标表示,而另一个主要成分(PC2)用纵坐标表示,PC1和PC2对样品差异的贡献值分别为36.03%、21.15%和47.45%、16.66%。12个样品明显分开,同一组组内样品聚集在一起,3个组的样品明显分开,显示了良好的组间差异,说明样品中菌群组成差异性较大。

图2 基于Unweighted unifrac距离PCoA分析Fig.2 Analysis of PCoA based on Unweighted unifrac distance
2.2 菌群组成差异分析
2.2.1 门水平上的优势菌群组成分析 在门水平上相对丰度排前10的物种如图4所示,粪便中细菌的物种主要为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),两者总和占细菌总数的90%以上。与DM组相比,DD组和DY组的厚壁菌门(P<0.01)、螺旋菌门(P<0.05)和ε-变形菌门(P<0.05)相对丰度下降,DY组的拟杆菌门相对丰度显著升高(P<0.05),放线菌门相对丰度则显著高于DM组和DD组(P<0.05)。

图3 基于Weighted unifrac距离PCoA分析Fig.3 Analysis of PCoA based on Weighted unifrac distance
2.2.2 纲水平上的优势菌群组成分析 在纲水平上相对丰度排前10的物种见图5,相对丰度大于1%的物种有7个菌纲,分别为拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、芽胞杆菌纲(Bacilli)、Negativicutes、Spirochaetia、丹毒丝菌纲(Erysipelotrichia)和放线菌纲(Actinobacteria),其中拟杆菌纲属于拟杆菌门,梭菌纲、芽胞杆菌纲、Negativicutes和丹毒丝菌纲属于厚壁菌门,Spirochaetia属于螺旋菌门,放线菌纲属于放线菌门。与DM组相比,DD组样品中的梭菌纲相对丰度显著下降(P<0.05),而DY组的则极显著下降(P<0.01),DD组的Spirochaetia相对丰度极显著降低(P<0.01),而DY组的则显著下降(P<0.05),DD、DY组的放线菌纲相对丰度均显著降低(P<0.05)。

图4 门水平上的细菌组成分析Fig.4 Composition of bacteria at the level of phylum

图5 纲水平上的细菌组成分析Fig.5 Composition of bacteria at the level of class
2.2.3 目水平上的优势菌群分析 在目水平上相对丰度高于1%的菌目共计8个,分别为拟杆菌目(Bacteroidales)、梭菌目(Clostridiales)、乳杆菌目(Lactobacillales)、Selenomonadales、螺旋体目(Spirochaetales)、丹毒丝菌目(Erysipelotrichales)、红椿菌目(Coriobacteriales)和柔膜菌目(Mollicutes),见图6。与对照组DM相比,DD组的拟杆菌目和梭菌目显著升高(P<0.05),DY组的则极显著升高(P<0.01)。DD组的Spirochaetales 极显著降低(P<0.01),DY组则显著降低(P<0.05)。

图6 目水平上的细菌组成分析Fig.6 Composition of bacteria at the level of order
2.2.4 科水平上的优势菌群分析 科水平上相对丰度超过1%的细菌分布在17个科,其中相对丰度排前10 的物种分别为普雷沃氏菌科(Prevotellaceae)、疣微菌科(Ruminococcaceae)、毛螺旋菌科(Lachnospiraceae)、Muribaculaceae、乳杆菌科 (Lactobacillaceae)、拟杆菌科(Bacteroidaceae)、氨基酸球菌科(Acidaminococcaceae)、Tannerellaceae、理研菌科(Rikenellaceae)、红椿菌科(Coriobacteriaceae),见图7。与对照组相比,DY组的疣微菌科显著降低(P<0.05),DD组的Muribaculaceae相对丰度显著升高(P<0.05),DY组和DM组的乳杆菌科(Lactobacillaceae)、拟杆菌科(Bacteroidaceae)、氨基酸球菌科(Acidaminococcaceae)和Tannerellaceae的物种相对丰度极显著降低(P<0.01),与DD组相比,DY组的普雷沃氏菌科极显著升高(P<0.01)。

图7 科水平上的细菌组成分析Fig.7 Composition of bacteria at the level of family
2.2.5 属水平上的优势菌群分析 属水平上相对丰度超过1%细菌分布在43个菌属。相对丰度排前10的物种分别为普氏菌属(Prevotella)、乳杆菌属(Lactobacillus)、Muribaculaceae、瘤胃球菌科_UCG_005、普拉索杆菌属等,见图8。其中乳杆菌属属于厚壁门,Muribaculaceae和普氏菌属则属于拟杆菌门。

图8 属水平上的细菌组成分析Fig.8 Composition of bacteria at the level of genus
DD组的乳杆菌属和拟杆菌属的相对丰度均极显著高于DY组和DM组(P<0.01),DY组普氏菌属(普氏菌属_2、普氏菌属_7和普氏菌属_9)相对丰度则高于DM组和DD组(P<0.05),DD和DY组的瘤胃球菌科_UCG_005显著高于对照组(P<0.01)。
2.3 组间差异分析
样品组间差异分析结果如图9所示,3组样品在属水平上存在显著性差异(P<0.05)和极显著性差异(P<0.01),相对丰度前15的菌属如图9,DY组的普氏菌属_9、普氏菌属_2、巨球菌属和柯林斯菌属相对丰度显著高于其他两组(P<0.05),其中普氏菌属_7的相对丰度差异极显著(P<0.01),DD组的拟杆菌属和拟普雷沃氏菌属的相对丰度显著高于其他两组(P<0.05),DM组中瘤胃球菌科、理研菌科、颤螺菌属和RF16型拟杆菌属相对丰度显著高于试验组(P<0.05)。

图9 组间差异分析图Fig.9 Analysis of difference among the three groups on species levels
3 讨 论
动物肠道菌群种类和数量的变化错综复杂,年龄、遗传、营养和生存环境等均是其重要的影响因素[14-16]。刘晗璐等[17],李曼曼等[18]通过研究后发现饲料为影响肠道微生物多样性的重要因素之一。有学者研究后发现,用代乳粉替代母乳后,沂蒙黑山羊的瘤胃微生物区系能达到一个动态的新的平衡,且随着日龄的增加与母乳组的差异越来越小[6,14]。饲粮中添加单一益生菌或复合益生菌能够提高肠道菌群的多样性,提高生产性能[19-20],本研究中两个试验组(DD、DY)样品中微生物Alpha多样性低于对照组(DM),但在代乳粉中添加复合益生菌后,杜滇仔猪的肠道微生物Alpha多样性并未显著上升。试验组DD多样性指标Chao1、Ace和Shannon指数均低于试验组DY,Simpson指数则高于试验组DY,说明添加异种源复合益生菌不能提高饲喂代乳粉组仔猪粪便中微生物Alpha多样性,而此复合益生菌在同样试验条件下可以提高杜藏猪肠道微生物多样性[21],由此可见益生菌的益生效果和途径在不同的动物中具有差异性。
肠道内细菌能够参与营养物质的代谢[22-23]。厚壁菌门(Firmicute)细菌与能量吸收有关[24-25],拟杆菌门(Bacteroidete)细菌与碳水化合物、胆汁酸和类固醇的代谢有关,并与肠黏膜修复免疫及肠道微生物动态平衡相关[23,25-26]。这两个菌门的相对丰度的比例与摄取食物热量和脂肪的贮存、代谢及代谢调控的转录因子的活性呈正相关[23,27]。拟杆菌门的相对丰度与饲粮中纤维含量呈反比,与脂肪含量呈正比[28],添加戊糖片球菌等益生菌[29]能够降低厚壁菌门/拟杆菌门的比值和炎症因子TNFα和IL-1β,拟杆菌门与末端为α-半乳糖的多糖代谢利用显著正相关[30],其相对丰度与霍乱弧菌感染的易感性呈反比,补充拟杆菌门核心菌种后,可以降低这种风险[31]。本研究中,3组的主要菌群为厚壁菌门、拟杆菌门、螺旋菌门和放线菌门,90%以上细菌主要分布在厚壁菌门和拟杆菌门,这与其他学者的报道一致[26-27,32]。DD组和DY组的优势菌为拟杆菌门,对照组DM的优势菌为厚壁菌门,这可能与试验饲粮的组分不同有关,试验结果表明,饲喂代乳粉的DY和DD组样品中普氏菌属(Prevotella)、Muribaculaceae、普拉梭菌(Feacalibacterium)的相对丰度高于对照组DM,其中DD组样品中乳杆菌属(Lactobacillus)的相对丰度显著高于对照组DM,推测原因可能与高能低氮的饲粮中的牛奶粉和乳清粉成分有关。虽然DY组添加了含有乳杆菌的复合益生菌,并未显著提高其粪便中乳杆菌的相对丰度,这一结果显示,低剂量的益生菌添加并不能显著提高添加益生菌的相对丰度,饲粮才是肠道微生物的重要影响因素之一。
拟杆菌是肠道中的厌氧菌,与碳水化合物的代谢利用、肠黏膜免疫及肠道菌群平衡密切相关[23,27,33]。普雷沃氏菌属是拟杆菌中的重要组成部分,与肝功能保护[34]、肠道炎症[35-36]和碳水化合物的代谢相关[23],其相对丰度与饲粮中部分纤维呈正比(低聚果糖、阿拉伯糖基木聚糖等)。普拉梭菌属(Faecalibacterium)是厚壁菌门中一员,与肠道的抗炎、腹泻、黏膜屏障及抗菌的作用相关[37]。患肠炎的动物肠道中普拉梭菌属和普氏菌属的相对丰度下降[35-36],添加益生菌后则能增加普氏菌属的丰度[38]。本研究中,DY组中普氏菌属和普拉梭菌属的相对丰度分别较DD组和DM均提高,差异极显著和显著,说明异种源的复合益生菌能提高杜滇猪肠道内与降低肠道炎症有关菌的丰度,具有潜在的抗炎趋势。DY组的代乳粉中添加芽胞杆菌和乳酸菌,其粪便样品中这两种菌的相对丰度与DD组相比较并无显著提高。因此,益生菌的益生作用,可能并不是简单地增加添加菌的数量或增加机体抵抗不良环境的自我调节能力,添加代乳粉后,对未发育完全的肠道是一个应激作用,复合益生菌通过调节肠道内菌群种类的数量,从而发挥益生作用。由此本研究认为,益生菌的添加原则应以直接或者间接促进肠道和机体抗应激的能力为前提,而不是仅仅依靠添加菌的生理作用为目的。
柯林斯菌属是初生仔猪肠道内一种常见的益生菌[39],其相对丰度随着年龄增长而呈上升趋势,能诱导美拉德反应产物的早期产物(如果糖赖氨酸)利用基因的表达,从而代谢为无毒产物,减少有害物质对肠道的危害,降低肠炎发病率[40],参与影响脂肪代谢,直接或者间接影响短链脂肪酸而影响炎症症状[41],其相对丰度与阳性T细胞呈正比,进而促进机体抵抗病毒[42]。本研究在代乳粉中添加复合益生菌后柯林斯菌属的相对丰度显著提高,说明复合益生菌具有提高抗肠道炎症、促进多糖等碳水化合物代谢的趋势。
本研究结果显示,在杜滇猪的饲粮中添加复合益生菌后,普雷沃氏菌和普拉梭菌属的丰度升高,说明代乳粉中添加异种源的益生菌后,增加了与碳水化合物的消化吸收能力、肠道抗炎和黏膜免疫能力相关的消化道微生物的丰度,由此可以推测异种源复合益生菌的添加有可能从营养物质代谢吸收和肠道免疫抗炎两方面缩短消化道微生物区系由哺乳型向饲料型的转变历程。
本研究首次研究了复合益生菌对7日龄超早期断奶的杜滇仔猪肠道微生物的影响,并发现试验组和对照组的粪便中90%以上细菌都属于厚壁门和拟杆菌门,试验组的优势菌为拟杆菌门,对照组的优势菌为厚壁菌门,饲粮为影响肠道微生物多样性的重要因素,其影响能力高于低剂量添加的益生菌。非母乳的试验组的粪便菌群多样性低于母乳组,代乳粉中添加异种源复合益生菌不能提高粪便中添加益生菌的相对丰度,但提高了与碳水化合物的消化吸收能力、肠道抗炎和黏膜免疫能力相关的消化道微生物的相对丰度。
