全绿吊兰茎叶系统净化室内甲醛及其生理指标变化
2020-03-03钟娇婵刘庆辉颜流水
钟娇婵, 李 剑, 占 婷, 刘庆辉, 杨 航, 郭 谍, 颜流水
南昌航空大学, 重金属污染物控制与资源化国家地方联合工程研究中心, 江西 南昌 330063
甲醛(formaldehyde)是最简单的醛类,被广泛应用于各种领域,如合成树脂、胶水及皮革的制造等[1-2]. 甲醛对机体的毒害作用主要包括刺激作用、致敏作用、遗传毒性和癌症、神经毒性及生殖毒性等作用[3]. 有研究表明,2002—2015年,我国39个城市室内平均φ(甲醛)为0.11×10-6[4],且2006—2015年,宁夏回族自治区空气中甲醛柱浓度年均增速达1.1×1015moleccm2[5]. 另外,一项针对我国乘用车内空气污染现状的研究发现,甲醛对男性职业司机致癌风险的浓度为US EPA(美国环境保护局)规定基准值(1×10-6)的60.67倍[6]. 因此,随着人类现代生活环境的改变,在诸多挥发性有机污染物中,甲醛因其来源广、污染面广、浓度高及危害大而逐步成为室内环境污染中的主要有机污染物,引起了人们的广泛关注.
目前去除室内甲醛的技术主要有生物降解作用、活性炭纤维吸附、光催化氧化以及臭氧氧化等[7]. 张义安等[8]于2018年的研究表明,通过多胺高分子接枝改性活性炭吸附材料(ACm-g-PAH)对甲醛的去除率最高达99.4%. 但是吸附剂的定期更换处理,使其处理效率和经济效益难以权衡. 对于光催化氧化技术来说,其实际应用也面临着如催化剂的使用寿命短及易产生二次污染等问题[9]. 因此,植物修复技术因其适用性强、绿色环保且经济效益好,受到越来越多的关注. 在日常生活场所摆放盆栽植物,不仅有利于愉悦身心,还可改善居住环境和提高工作积极性[10-12]. 植物通过生命活动和根系微生物的高活性能可有效去除挥发性有机污染物[13]. 如φ(甲醛)为0.54×10-6~13.35×10-6时,袖珍椰子在48 h内可去除65%~100%的甲醛气体[14]. 植物净化甲醛的过程中,在FDH(formaldehyde dehydrogenase,甲醛脱氢酶)的作用下将甲醛氧化生成CO2,进入卡尔文循环同化为葡萄糖或氨基酸、脂类、游离糖、有机酸和细胞壁成分等[15-16]. 此外,植物还可去除水中的甲醛,如水葫芦可以在144 h内完全清除水中浓度为200×10-6的甲醛[17]. 而吊兰是我国常见的室内景观盆栽,属多年生常绿草本植物,性喜温暖湿润、半阴的室内环境,且有较强的空气净化能力. XU等研究发现,吊兰对甲醛的去除率高于芦荟、绿萝等植物[13],且吊兰茎叶系统对甲醛的净化率达88%[18].
植物叶片中w(叶绿素)和ρ(游离蛋白质)的变化是监测植物生长过程中遭受损害程度的良好指标[19-20]. 有研究[21]表明,植物经过甲醛的熏蒸处理后,其w(叶绿素)下降,而ρ(游离蛋白质)上升,如绿萝经过不同浓度的甲醛气体熏蒸后,w(叶绿素)下降了9.9%~15.8%,ρ(游离蛋白质)上升了7.1%~20.0%. 另外,当植物叶片受损时,其电导率会增加[22]. MDA(malonaldehyde,丙二醛)是导致植物体内脂质过氧化的重要产物,在甲醛胁迫下会大量积累[23]. 而抗氧化酶能清除组织中的活性氧以降低细胞脂质化作用[24]. 因此,SOD(superoxide dismutase,超氧化物歧化酶)和POD(peroxidase,过氧化物酶)的活性会显著提高,同时,CAT(catalase,过氧化氢酶)活性降低[25-26]. 如SU等[27]研究发现,白藜叶提取物主要通过酶促反应和氧化还原反应来降解甲醛.
综上,利用植物净化室内空气中的甲醛不仅环保经济且科学有效. 虽然很多学者已对吊兰去除甲醛的性能进行过研究,但大多数都是研究其总体的去除率[13-14],没有对其在不同时间段内的去除率进行深入分析,且大都是采用静态熏蒸系统[18,21],不能模拟正常室内空气流通的环境. 鉴于此,该研究采用动态熏蒸系统和摄像头在线监测系统,在长达7 d的熏蒸期内,进行24 h在线监控,对不同时间段内的甲醛去除率进行详细分析;另外,对熏蒸前后全绿吊兰盆栽叶片中w(叶绿素)、ρ(游离蛋白质)、MDA含量、H2O2含量、羟自由基含量、电导率和SOD、POD、CAT活性以及T-AOC(total antioxidant capacity,总抗氧能力)等生理指标变化进行检测. 以期进一步揭示全绿吊兰盆栽与大气中甲醛相互交换的机理,为进一步探索室内全绿吊兰盆栽去除甲醛的作用机制提供科学依据.
1 材料与方法
1.1 试验装置

注: 1—气体循环泵;2—三通;3—气阀;4—甲醛溶液; 5—缓冲室;6—甲醛在线检测仪;7—网络摄像头; 8—小风扇;9—供试全绿吊兰盆栽;10—温室度计; 11—反应室;12—DNPH甲醛吸收液.图1 试验装置Fig.1 Experimental setup
试验所用动态熏蒸系统装置如图1所示,装置主要有四部分: ①甲醛气体产生系统,气体循环泵抽取的大气经过稀释后的甲醛溶液,吹出甲醛气体,通过阀门和流量计联合调节气体流速来获得不同φ(甲醛)的气体,并输送至缓冲室(40 L,Tedlar,USA). 试验中入口φ(甲醛)的变化率维持在±5.0%以内. ②气体缓冲系统,在缓冲室中悬挂的小风扇将甲醛气体混匀,由气体循环泵输送至反应室,由甲醛检测仪(ADL-600B-HCHO,ANDEIL,深圳市安德量科技有限公司)测定进口φ(甲醛). ③全绿吊兰盆栽反应系统,全绿吊兰盆栽在反应室中与甲醛进行反应,悬挂的小风扇维持装置内气体的流动性,采用温湿度计测定反应室中的温度与相对湿度,同样采用甲醛检测仪测定出口φ(甲醛),最后残留尾气通过DNPH盐酸溶液洗气瓶后排出系统. ④在线监测系统,由两个网络摄像头(YI,1080p,上海小蚁科技有限公司)对试验过程进行24 h监控,主要记录进出口φ(甲醛)以及装置内全绿吊兰盆栽生长状况和温湿度计读数.
1.2 试剂和材料
测试盒(南京建成生物工程研究所);化学试剂主要有甲醛溶液(37.5%)、丙酮溶液(99.5%)、2,4-二硝基苯肼(DNPH)、碳酸钙(99.0%)、二氧化硅(99.0%)、乙醇(99.7%)和冰乙酸(99.5%)等,均购于西陇科学股份有限公司.
该试验对象选用全绿吊兰盆栽,购于南昌花鸟市场,购买回来后放置于实验室内驯养30 d. 开展试验前各盆植株长势良好,茎叶无任何不良症状. 为了防止熏蒸试验过程中盆栽基质对甲醛气体的吸附作用和相互反应影响试验实际数据,在试验前采用锡箔纸将全绿吊兰盆栽的栽培器具、栽培基质及根部全部包裹封闭.
1.3 试验步骤
试验过程分3个阶段进行:①装置校准. 不放任何植物,向装置通入甲醛气体,比较装置进出口φ(甲醛)大小,以排除因系统渗漏、室内水蒸气和装置内表面吸附、光降解以及其他化学反应造成的甲醛损失. ②全绿吊兰盆栽熏蒸试验. 供试植物只暴露茎叶部分,其余均用锡箔纸包裹,放置于反应室中,然后连续通入7 d甲醛气体. 国家安全生产监督管理总局在2010年对广东、云南、福建等省份的85家木质家具制造企业进行现场检测的结果显示,甲醛超标的企业占76.9%,最高超标倍数为116倍,即φ(甲醛)最高时达11.6×10-6[28]. 因此该试验选择4种不同φ(甲醛)(0、1×10-6、5×10-6和8×10-6),其中,φ(甲醛)为0的一组为放置于室内正常环境培养的对照组,每组进行3次平行试验. 熏蒸过程中,利用网络在线摄像头全程监控,每0.5 h记录一次进出口φ(甲醛)以及反应室内温度和相对湿度,分别研究不同φ(甲醛)及不同时间段(如白天与夜间,上午与下午,前期和后期)全绿吊兰盆栽对甲醛去除率的变化特征. ③生理生化特征测定. 全绿吊兰盆栽经过7 d甲醛熏蒸后取出,立即对其各项生理指标进行测定,分析其变化特征. ④叶片表面气孔观测. 采用电子显微镜(SAIKEDIGITAL,深圳赛克数码科技开发有限公司)对经过φ(甲醛)为8×10-6气体熏蒸7 d后的全绿吊兰盆栽叶片表面进行观察拍照,与对照组对比分析其变化特征. ⑤植株修复初探. 分别测定经过熏蒸后全绿吊兰盆栽在第1、3、6、10、15天细胞脂质化生理指标MDA含量和总抗氧化能力T-AOC,分析其修复状况,如果与对照组无显著性差异,则推断为基本修复至正常生长状态.
1.4 生理指标检测方法
随机摘取供试全绿吊兰盆栽的叶片,称取1 g新鲜样本,按照质量(g)与体积(mL)比为1∶9的比例加入9 mL生理盐水,冰浴(0~4 ℃)下研磨成组织匀浆,用冷冻离心机UGE(HC-2518R,安徽中科中佳科学仪器有限公司)在4 ℃、4 000 rmin(H2O2样本为 8 000 rmin)下离心10 min. 取上清液为待测样品进行各生理指标的测定.
w(叶绿素)采用丙酮可见光法进行测定;叶片的电导率采用电导仪(DDS-11A,上海霄盛仪器制造有限公司)检测;全绿吊兰盆栽的茎叶组织匀浆中MDA含量、ρ(游离蛋白质)、H2O2含量、羟自由基含量以及SOD、POD、CAT和T-AOC的活性等生理特性分别采用A003-1、A045-2、A064、A018、A001-1-1、A084-3、A007-1-1和A015-1型号的测试盒测定,这一系列试剂盒具有操作简单,灵敏度高的特点[29];采用分光光度计(UV-1800,岛津,日本)测定吸光度.
1.5 数据分析
全绿吊兰盆栽对甲醛的去除率计算公式:
RE=(1-CoutCin)×100%
(1)
式中:RE为去除率,%;Cout为出口φ(甲醛),10-6;Cin为进口φ(甲醛),10-6.
采用ANOVA水平检验数据间的差异显著性(P<0.05).
2 结果与讨论
2.1 甲醛去除率分析

注: φ(甲醛)为1×10-6.图2 全绿吊兰盆栽在甲醛熏蒸7 d(2018年7月6—13日)期间对甲醛的去除率及 装置内温度和相对湿度的变化曲线Fig.2 The variation of formaldehyde removal efficiency, temperatures and relative humidity of the green Chlorophytum under the formaldehyde fumigation conditions within 7 d (6th-13th July, 2018)
有研究[13-14]表明,室内盆栽在白天对甲醛的去除率要高于夜间. 由图2可见,φ(甲醛)为1×10-6时,全绿吊兰盆栽对甲醛的去除率在每天15:00左右开始迅速下降,05:00左右迅速上升,白天(06:00—18:00)的平均去除率为71.1%±0.2%,明显高于夜间(18:00—06:00)的36.2%±0.2%. 通过相关性分析还发现,在整个熏蒸过程中,全绿吊兰盆栽对甲醛的去除率与装置内温度、相对湿度的相关系数分别为0.49、0.52,其中在白天时其与相对湿度的相关系数高达0.99,可能是由于甲醛易溶于水,使得在温度和相对湿度较高的环境下,更有利于全绿吊兰盆栽对气体甲醛的吸收与吸附作用,进而提高了去除率. 另外,该研究中,长达7 d的甲醛熏蒸处理对全绿吊兰盆栽起到了一定的驯化作用,提高了甲醛的去除率,如后期(4~7 d)的平均去除率(57.0%±0.2%)高于前期(1~3 d)(51.9%±0.3%).
由图3可见,全绿吊兰盆栽在上午(06:00—12:00)对甲醛的去除率低于下午(12:00—18:00),如φ(甲醛)为5×10-6时,上午、下午的去除率分别50.7%±0.1%和60.0%±0.0%,φ(甲醛)为8×10-6时分别为25.0%±0.1%和36.4%±0.0%. 另外,不同φ(甲醛)下,全绿吊兰盆栽一天中去除率的最大值均出现在15:00左右,φ(甲醛)为5×10-6、8×10-6时的去除率分别为62.2%、38.9%. 通过对全绿吊兰盆栽的甲醛去除率与相对湿度相关性分析发现,二者的相关系数高于0.98,因此,上午、下午的相对湿度差异有可能是引起该现象的重要原因之一.
另外,通过试验数据分析发现,全绿吊兰盆栽的茎叶系统对气体甲醛具有较高的去除能力,如当φ(甲醛)为1×10-6时,去除率最高可达95.2%. 但是,φ(甲醛)越高,植物叶片中MDA、H2O2等氧化物的积累也越多,进而细胞脂质化越严重,植物对甲醛的代谢活动也就越弱[21,26],因而全绿吊兰盆栽对甲醛的平均去除率也会随着φ(甲醛)的升高而降低,如在φ(甲醛)为1×10-6、5×10-6和8×10-6时,去除率分别为54.4%、48.2%和30.7%. 有研究也发现,吊兰属植物对气体甲醛有着较高的去除率,如采用φ(甲醛)为6.92×10-6的气体对吊兰处理24 h后,去除率约为88.0%[18],采用φ(甲醛)为0.99×10-6的气体对吊兰处理74 h后,去除率则为68.0%[30].
2.2 叶片中w(叶绿素)和ρ(游离蛋白质)
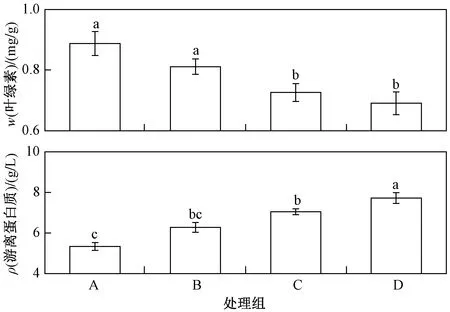
φ(甲醛)10-6: A—0(对照组);B—1;C—5;D—8.图4 熏蒸后全绿吊兰盆栽叶片中w(叶绿素)和 ρ(游离蛋白质)的变化Fig.4 The variations of chlorophyll and protein content in leaves of green Chlorophytum after fumigation with formaldehyde
全绿吊兰盆栽的叶片中w(叶绿素)随着φ(甲醛)的升高而降低,如采用φ(甲醛)为0.81×10-6~2.44×10-6处理后,w(叶绿素)降低了9.5%~14.1%[31]. 由图4可见,与对照组相比,φ(甲醛)由1×10-6升至8×10-6时,叶片内w(叶绿素)降低了8.6%~22.2%. 另外,由于甲醛熏蒸对叶片造成了损害,叶片内部组织中游离蛋白质状态发生改变,无法与磷脂分子正常转换,进而造成了游离蛋白质的积累[32]. 因此,φ(甲醛)为1×10-6、5×10-6和8×10-6时,全绿吊兰盆栽的叶片中ρ(游离蛋白质)分别增加了17.6%、32.0%和44.6%.w(叶绿素)和ρ(游离蛋白质)的变化表明,其光合作用减弱及蛋白质转换途径受阻是甲醛去除率降低的原因之一.
2.3 叶片中氧化物的含量
由图5可见,全绿吊兰盆栽叶片中各氧化物含量均随φ(甲醛)的上升而升高,如φ(甲醛)为1×10-6时,电导率比对照组增加了25.1%,φ(甲醛)为8×10-6时的增幅高达165.8%;φ(甲醛)为8×10-6时,MDA含量为3.6 nmolg,是对照组的2倍;φ(甲醛)为1×10-6、5×10-6、8×10-6时,H2O2含量较对照组(3.16 mmolg)分别增加了96.5%、314.6%和522.2%,羟自由基含量较对照组分别增加了10.1%、21.1%、41.5%. 这一系列氧化作用的指标均随φ(甲醛)的升高而增大,其中,电导率增加促使细胞膜通透性变大,MDA、H2O2及羟自由基等氧化物的过度积累会破坏叶片组织的正常代谢活动及抗氧化系统的调节作用[33-34],阻碍全绿吊兰盆栽对甲醛气体的降解进程,因此这一系列氧化指标的上述变化情况也是全绿吊兰盆栽对甲醛去除率降低的原因之一.
2.4 叶片中抗氧化酶的变化
植物在甲醛胁迫的环境中,酶促系统中的抗氧化酶能有效地清除组织中过度积累的氧化物并对甲醛实现降解[27],但随着甲醛浓度的升高,植物叶片中各抗氧化酶活性的变化趋势不同,如常春藤、驱蚊草和绿萝叶片中SOD活性及POD活性升高,CAT活性则降低[35]. 由表1可见,在φ(甲醛)为1×10-6、5×10-6和8×10-6时,全绿吊兰盆栽叶片中SOD活性较对照组分别提高了8.8%、15.6%和44.4%,POD活性分别提高了32.1%、72.6%和118.7%,CAT活性则降低了2.4%、17.1%、26.8%,T-AOC活性提高了13.%、39.8%、85.3%. 可见,随着叶片中MDA、H2O2及羟自由基等氧化物的积累,全绿吊兰为了维持正常生长,抗氧化系统中抗氧化酶的总体活性开始增强,对过度积累的氧化物进行清除,环境中的甲醛气体随之得到降解.
2.5 熏蒸前后叶片及气孔形态变化
全绿吊兰盆栽经过φ(甲醛)为8×10-6的气体熏
注: 数据为平均值±SD(n=3). *表示各组数据间差异性显著(P<0.05).
蒸 7 d 后,叶片表面气孔的形态发生了明显改变,对照组中各气孔的大小和形状相似且排列有序,熏蒸后却变得大小不一,呈细小狭长状,且气孔开度明显变小,部分呈闭合状态(见图6). 有研究[36-37]提出,植物叶片气孔的密度、大小及形状会因胁迫条件的作用而改变,其通过调节与空气的交换率来保护自己免受或减少侵害. 因此,全绿吊兰盆栽叶片气孔有效面积的减小,可能是对甲醛去除率降低的重要原因之一. 另外,经甲醛熏蒸后全绿吊兰盆栽外观无明显变化,仍能保持正常生长,说明叶片组织中的抗氧化系统起到了有效的调节作用,推测全绿吊兰盆栽对甲醛的耐受浓度应高于8×10-6.

注: 电子光学显微镜(×1 000).图6 经过φ(甲醛)为8×10-6的气体熏蒸7 d后全绿吊兰盆栽叶片表面气孔形态的变化Fig.6 The variation of stomatal morphology of the green Chlorophytum leaves were observed after fumigation with formaldehyde (8×10-6) for 7 d
2.6 全绿吊兰盆栽修复期间生理特征的变化
全绿吊兰盆栽经过φ(甲醛)为8×10-6的气体熏蒸7 d后,置于正常室内环境中继续栽培,并在恢复过程中不同时间段测定其叶片中MDA含量与T-AOC活性,分别与对照组对比,若无显著性差异则认为已恢复至正常生长状态. 由图7可见,全绿吊兰盆栽叶片中MDA含量和T-AOC活性均随着修复时间的延长而逐渐降低. 第6天时,全绿吊兰盆栽叶片中MDA含量比第1天时下降了24.8%,下降速率在第10天后趋于平稳,至第15天时与对照组无显著性差异;T-AOC 活性在15 d内均匀下降,在第15天时与对照组无显著性差异. 可见,全绿吊兰盆栽对甲醛气体有较强的抗耐性,经过浓度高达8×10-6的甲醛气体处理后仍能在15 d左右恢复至正常生长状态.
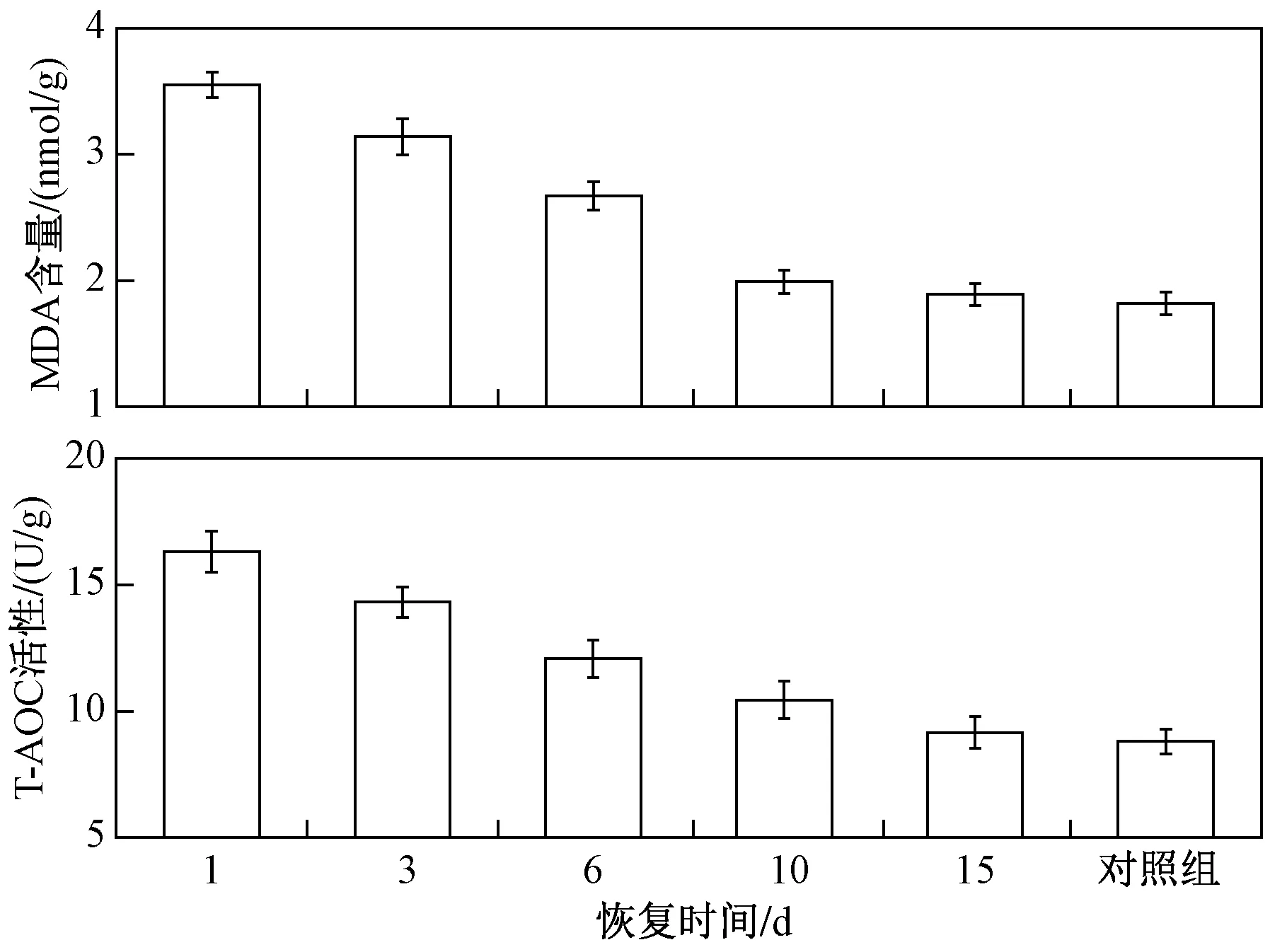
图7 全绿吊兰盆栽在恢复15 d内叶片中 T-AOC活性和MDA含量的变化情况Fig.7 The variations of T-AOC and MDA content in leaves of green Chlorophytum in recovery period of 15 days
3 结论
a) 对全绿吊兰盆栽进行7 d的甲醛熏蒸处理后发现,其茎叶系统对甲醛气体有较高的去除率,且当天去除率的最大值出现在15:00左右;但是在不同时间段内的去除率有所差异,如白天高于夜间、熏蒸后期高于熏蒸前期、下午略高于上午.
b) 对全绿吊兰盆栽叶片生理指标分析发现,除w(叶绿素)和CAT活性外,其他指标均随着φ(甲醛)的上升而升高. 这一系列生理指标的变化反映了甲醛气体与全绿吊兰间的反应机制,如w(叶绿素)的减少使其光合作用减弱;ρ(游离蛋白质)及电导率的变化破坏了其植物组织的正常状态;MDA、H2O2及羟自由基的积累会导致全绿吊兰盆栽茎叶系统内氧化作用增强;而抗氧化系统酶的总活性增强则有效地抵抗了甲醛气体造成的毒害作用.
c) 较高浓度的甲醛气体促使全绿吊兰盆栽的叶片表面气孔形态发生改变,对植物与大气的气体交换作用造成了影响,降低了其对甲醛的去除率;但是全绿吊兰盆栽的茎叶表面无明显受损症状,且熏蒸后在15 d左右即可恢复至正常状态.
d) 全绿吊兰盆栽对甲醛气体具有较高的去除能力,且有较强的抗耐性及自愈能力. 因此,利用全绿吊兰盆栽净化室内甲醛气体污染不仅经济美观效率高,还可持续性循环利用.
