CMC/阳离子β-CD静电自组装水凝胶的制备及其缓释性能
2020-02-29贾旺强郑进智刘泽华
刘 瑜,徐 力,贾 盼,贾旺强,郑进智,刘泽华
(天津市制浆造纸重点实验室,天津科技大学轻工科学与工程学院,天津 300457)
羧甲基纤维素(CMC)作为一种天然无毒的聚阴离子纤维素醚,可用作 pH敏感型水凝胶的构建与设计[1].基于 CMC等天然高分子材料制备得到的水凝胶具有较好的生物相容性、生物可降解性以及与活体组织的相似性,从而这类水凝胶更适合作为药物输送的载体[2].因疏水性药物与纤维素基水凝胶亲水性聚合物网络之间固有的不亲和性,故其多用于水溶性药物的输送[3–6],疏水性药物在此类水凝胶中的释放不能长时间控制[7].为克服以上问题,可将β–环糊精(β-CD)与纤维素及其衍生物以水凝胶为载体进行有效地结合.
β-CD作为一种具有纳米尺形疏水空腔结构的低聚糖,可用于提高疏水性药物溶解度、稳定性及生物利用度等[8].在现有报道中,多通过交联聚合方法制备得到 β-CD与纤维素基材料相结合的水凝胶,但在制备过程中需使用有毒的交联剂[9–10],这较大程度地影响了所得水凝胶的生物相容性.Ghorpade等[11–12]则选用柠檬酸作为无毒的交联剂分别制备得到了 β-CD/羟丙基甲基纤维素交联水凝胶与 β-CD/CMC交联水凝胶,并研究所得水凝胶对疏水性药物酮康唑的载药性能.严安等[13]基于CMC与阳离子β-CD的静电相互作用得到了自组装功能纤维,并将其抄片成纸应用于苯酚废水的处理.此法虽与本研究基于同一原理,但所制备的材料缺乏水凝胶生物材料相关的优异特性.
本研究将利用CMC与阳离子β-CD之间的静电作用,无需交联剂,以一种简便易行的方法制备得到智能型自组装水凝胶用于疏水性药物的载运.通过FITR、SEM 等表征方法对所得自组装水凝胶基本性能进行分析,研究阳离子溶液浓度、组装时间、阳离子 β-CD取代度等组装条件对水凝胶性质的影响,测试水凝胶在不同 pH条件下的溶胀性能,探讨疏水性药物氯霉素在新型 pH敏感水凝胶中的控释机理,并且利用 Korsmeyer-Peppas动力学模型拟合药物释放曲线.
1 材料与方法
1.1 试剂与仪器
CMC,DS 0.7,上海古长实业有限公司;2,3–环氧丙基三甲基氯化铵,分析纯,上海笛柏化学品技术有限公司;酚酞,分析纯,天津市化学试剂一厂;无水乙醇,分析纯,天津市风船化学试剂科技有限公司;氯霉素,分析纯,上海麦克林生化科技有限公司;无水碳酸钠,分析纯,天津市江天化工技术有限公司;β-CD、氢氧化钠、丙三醇,分析纯,国药集团化学试剂有限公司.
FTIR–650型傅里叶变换红外光谱仪,天津市港东科技发展有限公司;UV–2550型多功能 UV-vis分析仪,日本SHIMADZU公司;JSM–IT300 LV型扫描电子显微镜,日本JEOL公司;ALpHR1–2 LD plus型冷冻干燥机,北京市五洲东方科技发展有限公司;DF–101S型集热式恒温加热磁力搅拌器,河南省巩义市予华仪器有限责任公司;VOS–60A 型真空干燥箱,施都凯仪器设备有限公司;Kjeltec 8400型全自动凯式定氮仪,丹麦 FOSS公司;TGL–20M 型高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;HNY–100B型恒温培养振荡器,天津市欧诺仪器仪表有限公司.
1.2 水凝胶的制备
1.2.1 阳离子β-CD的合成
称取10g β-CD于单口烧瓶中,加入一定量的氢氧化钠溶液,于 70℃恒温搅拌 5~10min后,加入2,3–环氧丙基三甲基氯化铵(阳离子醚化剂)于70℃下反应 5h.反应后,用无水乙醇浸泡,搅拌直至形成白色粉末状物质.乙醇洗涤,抽滤,于 60℃真空烘箱中干燥至质量恒定.氢氧化钠加入质量为 β-CD质量的2.2%,反应体系含水量为25%.
1.2.2 阳离子β-CD取代度的测定
采用全自动凯式定氮仪测定阳离子 β-CD的含氮量,通过式(1)计算阳离子β-CD的取代度.

式中:DS为阳离子β-CD的取代度;ws为样品中氮的质量分数;w0为原 β-CD 中的氮的质量分数;162为β-CD中葡萄糖单元的相对分子质量;14为氮元素的相对原子质量;151.5为取代基团季铵基的相对分子质量.
1.2.3 自组装水凝胶的制备
CMC溶液和阳离子 β-CD溶液直接混合进行组装所形成的凝胶结构松散、强度低,故采用 CMC膜与阳离子 β-CD进行组装,形成的组装体状态稳定,便于性能检测和应用.以蒸馏水为溶剂,将 CMC在40℃下搅拌溶解,制成质量分数为 5%的溶液,加入10mL丙三醇,搅拌均匀后,以 2500r/min的转速进行离心脱泡 6min.将离心后的溶液转入培养皿,于55℃烘箱中干燥至质量恒定,即得CMC膜.取0.3g CMC膜浸泡在20mL一定浓度的阳离子β-CD溶液中,12min后取出,即得 CMC/阳离子 β-CD 自组装水凝胶.
1.3 水凝胶的表征
1.3.1 凝胶中β-CD含量的测定
参照文献[14]绘制标准曲线,通过最小二乘法拟合得到直线方程为 A=0.93533–0.00604ρ,R2=0.9989.式中:A为吸光度;ρ为 β-CD 质量浓度,mg/L.
称取冷冻干燥后的干凝胶 50mg于 25mL比色管中,加入10mL蒸馏水,之后加入 2.00mL浓度为3.7×10-4mol/L的酚酞溶液,在摇床中以 110r/min的转速振荡 2h,再加入 2.00mL浓度 2.8×10-2mol/L的碳酸钠溶液,定容至 25mL,摇匀,在 15min内测定其在 552nm 处吸光度,将测得的吸光度代入回归方程得到β-CD质量浓度ρ.通过式(2)计算凝胶中β-CD含量.

式中:w为凝胶中β-CD 含量,mg/g;ρ为β-CD质量浓度,mg/L;V为溶液体积,L;m为干凝胶质量,g.
1.3.2 红外光谱分析(FTIR)
称取1mg绝干样品与100mg光谱级KBr粉末混合研磨并压片,使用红外光谱仪进行扫描,波数范围为 400~4000cm-1,分辨率为 1.5cm-1.
1.3.3 水凝胶的微观形貌分析
将水凝胶样品于超低温保存箱(-65℃)淬冷后进行冷冻干燥,然后进行喷金处理,用 JSM–IT300 LV型扫描电子电镜观察其表面微观形貌.
1.3.4 溶胀性能测试
称取冷冻干燥后的干凝胶 50mg分别浸泡在20mL 配制的 pH=4、6、7、8的磷酸氢二钠–柠檬酸缓冲液及 pH=10的甘氨酸–氢氧化钠缓冲液中,到达溶胀平衡后取出,用滤纸吸干凝胶表面的水分,称其质量[15].

式中:SR为样品溶胀率;md、ms分别为凝胶溶胀前后的质量.
1.4 水凝胶的载药及缓释性能
1.4.1 氯霉素标准曲线的绘制
准确称取氯霉素 100mg,在不同介质中溶解,置于 100mL容量瓶中,并稀释至刻度,摇匀,配制成1mg/mL 的溶液,准确移取 0.5、1.0、1.5、2.0、2.5、3.0mL分别置于50mL容量瓶中,稀释至刻度,用紫外分光光度计于 278nm 处测量其吸光度,得到标准曲线回归方程.
介质为水时A1=0.0834+30.2300ρ1,R2=0.99983;介质为 pH=4的缓冲液时A2=0.0966+29.4770ρ2,R2=0.99994;介质为 pH=6 的缓冲液时A3=0.0765+29.6621ρ3,R2=0.99951;介质为 pH=7 的缓冲液时A4=0.0858+29.5690ρ4,R2=0.99779.式中:A1、A2、A3、A4为吸光度;ρ1、ρ2、ρ3、ρ4为氯霉素质量浓度,mg/mL.
1.4.2 载药实验
称取 50mg冻干后的水凝胶浸泡在 40mL质量浓度为1mg/mL的氯霉素水溶液中,24h后取出,在40℃烘箱干燥.将浸泡水凝胶后剩余的氯霉素溶液准确吸取 2mL置于 50mL容量瓶,稀释至刻度.依据氯霉素浓度与吸光度之间的关系曲线,计算得出剩余溶液中的氯霉素含量,水凝胶的载药量s即为氯霉素总量减去剩余氯霉素溶液中的含量.
1.4.3 体外模拟药物释放实验
称取载药凝胶 50mg,分别置于 pH 4、6、7的50mL缓冲液中,放入(37.5±0.5)℃的摇床中以150r/min 振荡.分别在第 20、40、60、120、240、360、480、600、720min取样,测定其在 278nm 处的吸光度.代入回归方程计算药物释放质量浓度,累积释放率Q[16]为

式中:Q为第i次取样后体系的累积释放率,%;ρi为第i次取样时药物的释放质量浓度,mg/mL;m为干凝胶质量,g;s为载药量,mg/g;V1为每次取样的体积,mL;V2为缓冲溶液的体积,mL.
2 结果与讨论
2.1 静电自组装的验证
为验证水凝胶形成的驱动力为静电自组装,而不是因为 CMC本身在溶液中的溶胀及其高分子结构的简单吸附过程,设计以下对照实验进行验证,结果见表1.

表1 静电自组装验证实验Tab. 1 Verification of electrostatic self-assembly
实验中发现,CMC膜在蒸馏水中,5min开始溶解,90min后溶解完全(1#);阳离子β-CD 在蒸馏水中能迅速溶解成透明溶液(2#);而将 CMC膜浸泡在阳离子β-CD水溶液中,却发现 CMC膜仅仅发生润胀,不再溶解,即呈现凝胶的状态(3#).可见,CMC和阳离子β-CD之间发生了相互作用;在中性或碱性条件下,CMC膜因其存在的羧基负离子之间的静电斥力而膨胀[17],利于链的伸展,而溶液中阳离子 β-CD的季铵型阳离子基团与CMC的羧基阴离子可以通过静电相互作用发生反应,即静电自组装,并起到交联的作用,形成不溶于水的凝胶.在酸性条件下(4#),CMC的羧基被质子化,降低了分子链间排斥力,溶胀性显著降低,阳离子 β-CD也难以组装到CMC分子链上.
阳离子 β-CD(2#)、自组装水凝胶(3#)以及 4#所得样品的红外光谱如图1所示.

图1 不同样品的红外光谱图Fig. 1 FTIR spectra of different samples
由图 1可知:3410、2926cm-1分别是—OH 与C—H的伸缩振动吸收,因自组装水凝胶体系中的CMC通过静电作用负载了大量的阳离子β-CD,故两处的吸收强度显著增强.4#的 CMC膜因浸泡在酸性溶液中,羧基被大量质子化,产生氢键缔合(二聚体),故在 1724cm-1处出现二聚体 C=O 伸缩振动吸收[18].1410cm-1对应于 COO-的对称伸缩振动吸收[17],但发现 4#样品 COO-的反对称伸缩振动吸收在 1611cm-1左右,而自组装水凝胶 COO-的反对称伸缩振动在1635cm-1附近,说明CMC与阳离子β-CD交联后破坏了原来羧酸根基团的多电子 π键体系[19],使 COO-双键加强,证明水凝胶体系中存在CMC 与阳离子 β-CD 的静电自组装.944cm-1处的吸收带与 β-CD 中α–(1→4)连接的吡喃糖环的振动有关[20],从图中可以看出该吸收只出现在阳离子 β-CD 与自组装水凝胶中.在酸性条件下,4#样品虽然不溶,但这是 CMC质子化后不溶造成的,而非组装体水凝胶,这进一步说明了自组装水凝胶的驱动力为CMC与阳离子β-CD之间的静电相互作用力.
2.2 组装条件对凝胶中β-CD含量的影响
在质量分数 30%的 DS 0.68阳离子 β-CD溶液中,考察不同组装时间对凝胶中 β-CD含量的影响,结果如图 2所示.由图 2可知:在 9min前,凝胶中β-CD含量随着组装时间迅速增加,在 9min时达到68.60mg/g,之后随时间延长逐渐达到平衡,说明CMC与阳离子 β-CD的静电自组装是一个快速的过程.

图2 组装时间对凝胶中β-CD含量的影响Fig. 2 Effect of assembly duration on β-CD content in the gel
固定组装时间12min,考察两种不同取代度的阳离子 β-CD的溶液浓度对凝胶中 β-CD含量的影响,结果如图 3所示.从图 3可以看出:在阳离子 β-CD取代度固定情况下,自组装水凝胶中 β-CD含量表现出随溶液浓度增大而增大的现象.质量分数达 30%时,DS 0.68的凝胶中β-CD含量为69.69mg/g,且与40%时的70.85mg/g的含量差别不大.

图3 不同浓度不同取代度阳离子 β-CD对 β-CD含量的影响Fig. 3 Effects of different concentration and degree of substitution of cationic β-CD on β-CD content
2.3 不同pH对水凝胶的溶胀性能的影响
将冻干的静电自组装水凝胶(自组装条件为阳离子 β-CD 质量分数 30%、DS 0.68、反应时间 12min)分别置于不同 pH的缓冲液中测定其溶胀率,结果如图4所示.由图4可以看出,随着pH的提高,自组装水凝胶的溶胀率逐渐降低,表现出 pH敏感性.这是由于 pH越低,CMC分子链上的羧甲基质子化程度越大,导致其整体上与阳离子 β-CD间的静电作用开始减弱,交联层变薄同时交联密度减小,交联结构对内部水的限制减小,内部包含的大量溶剂对其溶剂化作用增强及凝胶体系中的 CMC链段更为舒展,故凝胶结构越来越疏松,溶胀率变大.但同时也需注意到pH的降低将会导致未交联的 CMC之间的静电斥力的减小,静电斥力的减小有助于分子链相互缠绕导致凝胶结构的紧密,因此溶胀率的变化是以上两方面影响因素的竞争结果.从结果上来看,交联结构的变化对溶胀率的影响更为显著.

图4 不同pH下静电自组装水凝胶的溶胀率Fig. 4 Swelling rate of electrostatic self-assembled hydrogel at different pH values
2.4 水凝胶的微观形貌分析
静电自组装水凝胶(自组装条件为阳离子 β-CD质量分数30%、DS 0.68、反应时间12min)在不同pH缓冲液中溶胀后的微观形貌如图 5所示.静电自组装水凝胶在pH 4与pH 6的缓冲液中溶胀后,凝胶表现出疏松多孔结构,整体上具有纤维状三维贯通的网络结构,分布着较多比较杂乱的大孔洞,这有利于水凝胶快速、大量地吸水,同时进一步说明了该水凝胶在pH 4与pH 6条件下具有较高的溶胀率的原因.而当 pH继续增大时,阴阳离子之间的静电作用显著增强,凝胶结构的交联密度增大,高分子网络的弹性有所下降,可以观察到当pH 7与pH 8时其网孔变小,整体上表现为收缩结构,阻碍了孔道吸收溶剂的速率及数量,因而溶胀率有所下降.在 pH 10时,凝胶微观形貌呈现致密的蜂窝状,这可能是 CMC中绝大部分羧甲基的去质子化导致体系中产生更多的物理交联及缠结,故存在着明显的通道结构.
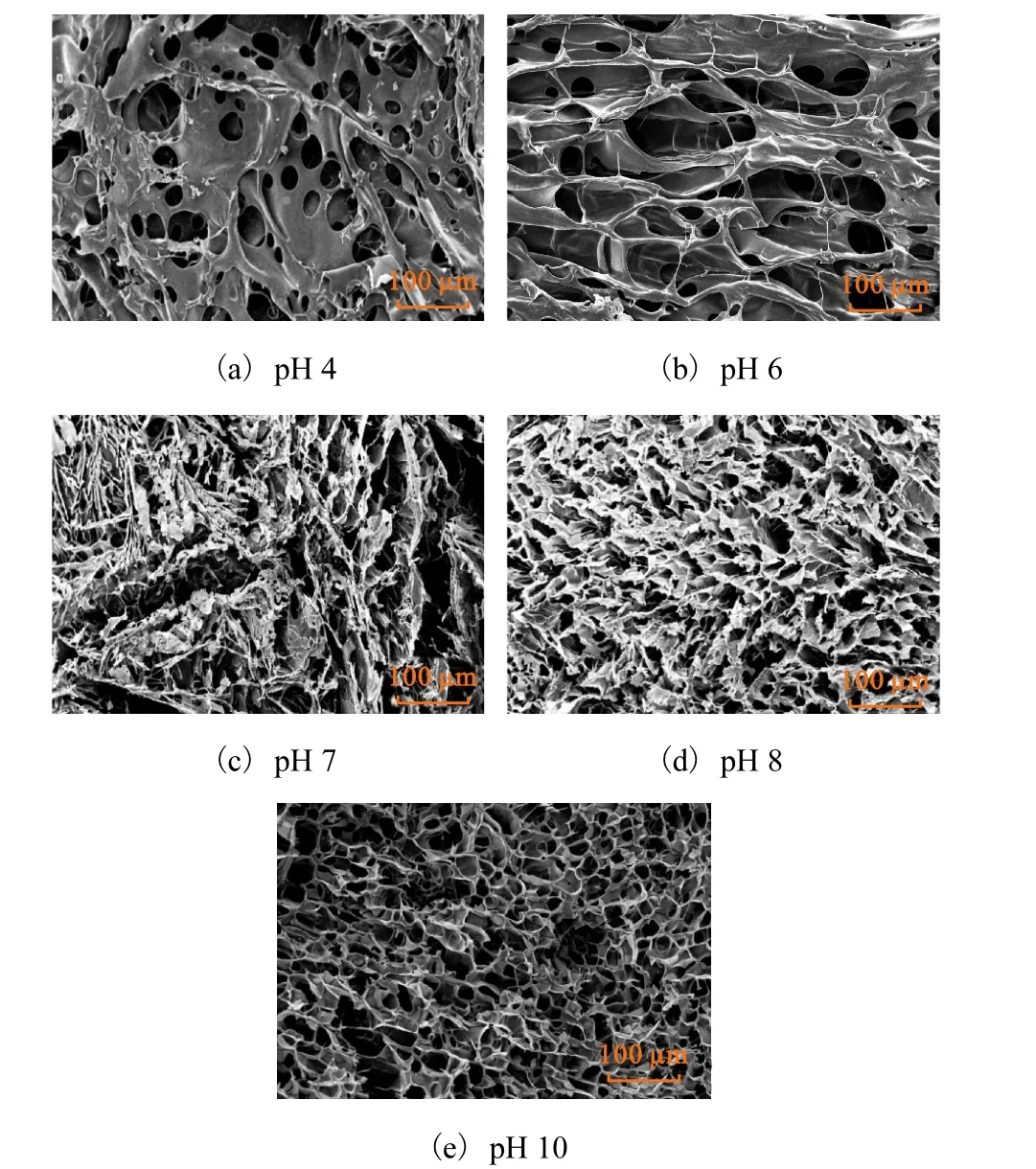
图5 静电自组装水凝胶在不同 pH缓冲液中溶胀后的SEM图Fig. 5 SEM images of electrostatic self-assembled hydrogel in different pH buffer after swelling
2.5 药物包含及释放性能
以CMC与DS 0.68的阳离子β-CD组装成的水凝胶为例,当 β-CD 含量为 12.36、34.14、69.69mg/g时,水凝胶对氯霉素的载药量分别为 11.43、33.33、215.33mg/g,其最高载药量可达聚乙烯醇/壳聚糖水凝胶[21]对氯霉素载药量的 10倍以上.此外发现,载药量随着 β-CD含量的增大而增大,这可能是因为药物分子与 β-CD之间的络合导致疏水相互作用力的增强[22].
图 6为载药量 215.33mg/g的载药凝胶(该凝胶的自组装条件为阳离子 β-CD质量分数 30%、DS 0.68、反应时间 12min)在不同 pH 条件下的释药曲线.在所有pH下2h内都可观察到水凝胶的药物突释,当 pH 4、6、7时,药物释放 120min的累积释放率分别为47.74%、42.37%、32.05%,这主要是表面吸附药物的释放[12].在 2h后药物释放显著减缓,药物开始长时间稳定释放,当 pH 4、6、7时,药物释放720min的累积释放率分别为 53.46%、48.86%、39.60%,具有明显的控制缓释特征.
此外,载药凝胶在不同 pH下表现出不同释药速率,在相同的释放时间内,pH越低,累积释放率越高.

图6 自组装水凝胶在不同pH下药物的释放曲线Fig. 6 Drug release curves of self-assembled hydrogel at different pH
在药物的释放过程中,同时伴随着凝胶骨架结构的解析和溶蚀,其扩散路径长度不断发生着变化,可以通过 Korsmeyer-Peppas模型来描述缓释动力学机理[23–24].

表 2为氯霉素释放的 Korsmeyer-Peppas动力学模型参数.动力学机理取决于n[25],即pH 4和6时,n≤0.45,药物释放机理属于 Quasi-Fickian机理,此时凝胶骨架与药物之间的相互作用力较弱;pH 7时,0.45<n<0.89,属于 Non-Fickian机理,说明凝胶骨架与药物之间的相互作用力显著增强;当 n≥0.89,属于以骨架溶蚀为主.

表2 氯霉素释放的动力学模型参数Tab. 2 Parameters of different kinetics model for chloramphenicol release
3 结 论
(1)通过静电自组装水凝胶的验证设计以及红外光谱分析,证明 CMC/阳离子 β-CD水凝胶形成的驱动力为静电自组装,同时水凝胶中阳离子 β-CD的存在主要是依靠阴阳离子静电作用的自组装行为,而不是因为 CMC本身在溶液中的溶胀行为及其高分子结构的简单吸附过程.
(2)CMC/阳离子β-CD水凝胶的溶胀率随pH的增大而减小,具有良好的 pH敏感性,同时其微观形貌在不同 pH条件下也表现出显著差异,结果与溶胀性能的pH敏感行为相符.
(3)体外药物释放实验表明 CMC/阳离子 β-CD水凝胶对氯霉素具有长效的缓释作用,在中性条件下的释药速率低于酸性条件,采用 Korsmeyer-Peppas模型对释药过程的动力学数据进行拟合,在 pH 4和pH 6的缓冲液中符合Quasi-Fickian机理,而在pH 7的缓冲液中符合Non-Fickian机理.
