小鼠脂肪沉积过程中定量PCR内参基因的筛选
2020-02-24华永琳秦文昌熊显荣字向东
华永琳,熊 燕,*,张 静,,郭 玉,,秦文昌,熊显荣,字向东,殷 实,李 键,*
(1.西南民族大学 生命科学与技术学院,四川 成都 610041;2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041)
脂肪组织的过度沉积是导致小动物肥胖的关键因素,该生物学过程受到大量基因的时空表达调控。伴随着肥胖的产生,机体和组织水平的炎症细胞和炎症因子大量产生,多种慢性疾病作为肥胖的并发症出现,产生复杂的病理状态。小鼠作为模式动物,基因改造相对容易且脂肪组织沉积特征明显,主要有腹股沟白色脂肪组织(inguinal white adipose tissue,iWAT)、附睾白色脂肪组织(epidydimal white adipose tissue,eWAT)和棕色脂肪组织(brown adipose tissue,BAT)等,是动物脂肪沉积基因功能活体研究的理想材料。在基因功能研究中,RNA水平的调控是基因调控极其重要的一个层面。目前基于qRT-PCR的相对定量分析是检测RNA表达水平应用最广泛的技术,但不同的内参基因可能导致的定量结果差异较大,偏离体内基因表达的真实水平,因此选择稳定的内参是基因相对定量分析的关键[1]。
脂肪组织常用内参基因包括β2-微球蛋白(B2M)、甘油醛-3-磷酸脱氢酶(Gapdh)、β肌动蛋白(β-actin)、β-微管蛋白(β-tubulin)、亲环蛋白A(PPIA)、琥珀酸脱氢酶复合物亚单位A(SDHA)等基因。近年来的研究结果发现,在不同组织和细胞类型、细胞增殖分化不同阶段、体外培养等情况下这些内参基因的表达量通常变异较大[2]。YAN等[3]发现,RPL13a和YWHAZ组合可作为小鼠急性胰腺炎模型中的最佳内参基因;而DESSELS等[4]研究发现,在新鲜FBS诱导的脂肪来源的基质细胞中,RPL13a是表达最不稳定的内参基因。此外,在C57BL/6J和C3H/HeJ等2个品系小鼠的下丘脑、垂体和卵巢中,Gapdh和HPRT1表达最为稳定[5];而GU等[6]发现,在小鼠早期胚胎、妊娠期胎盘中Gapdh和β-actin的表达稳定性较差。小鼠脂肪组织及细胞是研究动物体内外脂肪沉积较好的模型,但其qRT-PCR相对定量研究的内参基因还存在争议。据报道,ACTB是肌内脂肪成脂分化过程中稳定表达的内参基因[7],但也有研究显示ACTB不适合作内参基因。
因此,本试验以小鼠iWAT、eWAT和BAT为试验材料,采用qRT-PCR方法检测不同类型脂肪组织、白色和棕色脂肪细胞诱导分化过程中Gapdh、PPIA、18S rRNA、β-tubulin、β-actin、SDHA、UBC、ACTB和RPL13a等9个候选内参基因的表达水平,并利用RefFinder程序(geNorm、NormFinder、BestKeeper、ΔCt)进行综合分析内参基因的稳定性,以期获得小鼠脂肪沉积过程中的最优内参,为后期关于小鼠脂肪沉积过程中RNA定量研究提供基础数据。
1 材料与方法
1.1 试验动物本试验所需昆明小鼠(n=10)购于成都达硕实验动物有限公司,饲养于西南民族大学实验动物中心SPF级动物房,7:00-19:00光照,19:00-07:00黑暗,自由采食,温度控制在25℃左右。将1~2月龄雄性昆明小鼠颈椎脱臼处死,75%酒精消毒处理后分别采集3种类型脂肪组织于RNA-free的EP管中,-80℃保存备用。
1.2 试验方法
1.2.1小鼠前体脂肪细胞培养及诱导分化 将采集的脂肪组织置于盛有PBS(含1%双抗)的培养皿中,清洗干净后用灭菌剪刀剪碎,加入适量Ⅰ型胶原酶,于恒温振荡水浴锅37℃消化30~60 min。消化完成后加入含20%FBS的DMEM培养基终止消化,然后离心接种于12孔板,第2天换液,以后每2 d 换1次培养液,至细胞密度达到70%~80%,换诱导液继续培养4 d,之后换分化液继续培养,并于诱导后0,2,4,6,8 d收集细胞,每个样品收集3个重复。
1.2.2总RNA提取和cDNA合成 Trizol法提取小鼠脂肪组织及脂肪细胞的总RNA,利用核酸浓度分析仪测定RNA浓度和纯度,其中将D260/D280比值为1.9~2.1的样品按照 TaKaRa反转录试剂盒说明书合成cDNA第一条链,-20℃保存。
1.2.3引物设计及标准曲线构建 根据各基因在脂肪沉积中的研究进展以及前人研究[8],本试验选取9个内参基因,根据GenBank中的登录序列,利用Primer Primer 5.0软件设计引物(表1),引物由金斯瑞生物科技有限公司合成。将1.2.2中小鼠脂肪组织cDNA按5倍稀释,选取5-1~5-4稀释倍数的样品进行qRT-PCR,构建标准曲线。

表1 9个候选内参基因的引物序列
1.2.4实时荧光定量PCR qRT-PCR通过BIO-RAD CFX connect real-time system运行,具体反应程序及步骤参照文献[9]。
1.2.5内参基因稳定性分析 候选内参基因的稳定性通过RefFinder程序进行分析。将所有候选基因qRT-PCR的循环阈值(Ct)减去最小Ct值,得到ΔCt,并转换为相对表达量。geNorm程序通过计算2-ΔCt值测定基因表达稳定性(M值)大小(M值越小,基因表达越稳定),从而判断最稳定及最不稳定的内参基因。当M>1.5时,该基因不适合作为内参[10]。NormFinder与geNorm计算原理相似,根据所有候选内参基因稳定值的大小筛选出稳定性最好的内参基因[11]。BestKeeper则根据Ct值的几何平均数计算出标准偏差(standard deviation,s)、变异系数(soefficient of variation,CV)、相关系数(correlation coefficient,R2),根据s、CV值的大小判定内参基因的稳定性[12]。ΔCt法[13]根据各内参基因的平均标准差(s)评估基因表达稳定性。
2 结果
2.1 内参基因引物的特异性及扩增效率对PPIA等9个内参基因引物进行扩增,qRT-PCR熔解曲线显示,每一个内参基因扩增均表现为单个产物的峰值,没有非特异性扩增(图1)[14],同时生成标准曲线评估引物效率。结果显示相关系数R2为0.894 5 ~1.000 0,PCR扩增效率E为 0.75~1.16(表2),表明内参基因的引物特异性好、扩增效率符合要求,可用于后续试验。此外,通过分析上述组织及细胞中9个候选内参基因的循环阈值(Ct),发现PPIA和Ubc的Ct值在iWAT、eWAT和BAT中都比较稳定,而18S rRNA、ACTB和Gapdh的Ct值变化较大;在白色脂肪细胞分化过程中SDHA、18S rRNA、PPIA、Gapdh的Ct值较稳定,而在棕色脂肪细胞中Ubc、RPL13a、PPIA的Ct值较稳定(图2)。
2.2 小鼠脂肪沉积过程中内参基因的稳定性评估本试验利用geNorm、Normfinder、Bestkeeper以及ΔCt等方法对其进行分析,最终推荐出适合小鼠脂肪沉积的最佳内参基因[15]。geNorm对所有样品的 2-ΔCt值分析显示在小鼠3种不同类型脂肪组织中9个候选内参基因稳定性排序依次为β-tubulin=RPL13a、Ubc、PPIA、β-actin、SDHA、Gapdh、ACTB、18S rRNA,其中最稳定的是β-tubulin和RPL13a,稳定值为0.457,其次为Ubc,最不稳定的是18S rRNA。同时在小鼠脂肪细胞诱导分化过程中表达最稳定的内参基因也是β-tubulin,而传统内参基因Gapdh、ACTB以及SDHA在小鼠脂肪沉积过程中表达不稳定(图3)。

图1 小鼠脂肪组织中 9 个候选内参基因的 Real-time PCR 熔解曲线 A.PPIA;B.β-tubulin;C.β-actin;D.18S rRNA;E.ACTB;F.SDHA;G.Gapdh;H.Ubc;I.RPL13α
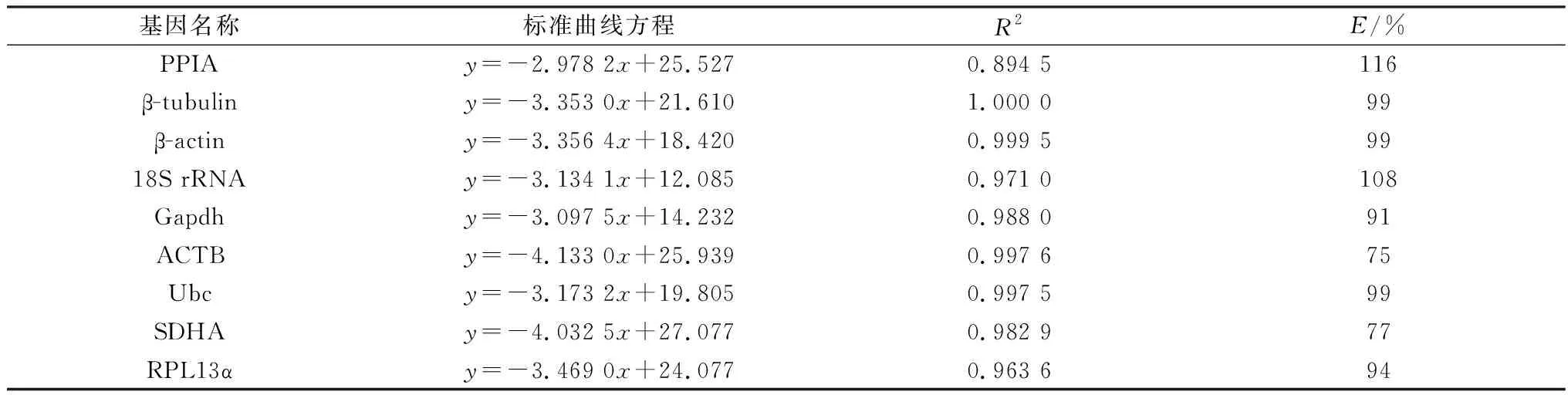
表2 内参基因标准曲线方程、相关系数(R2)及扩增效率(E)
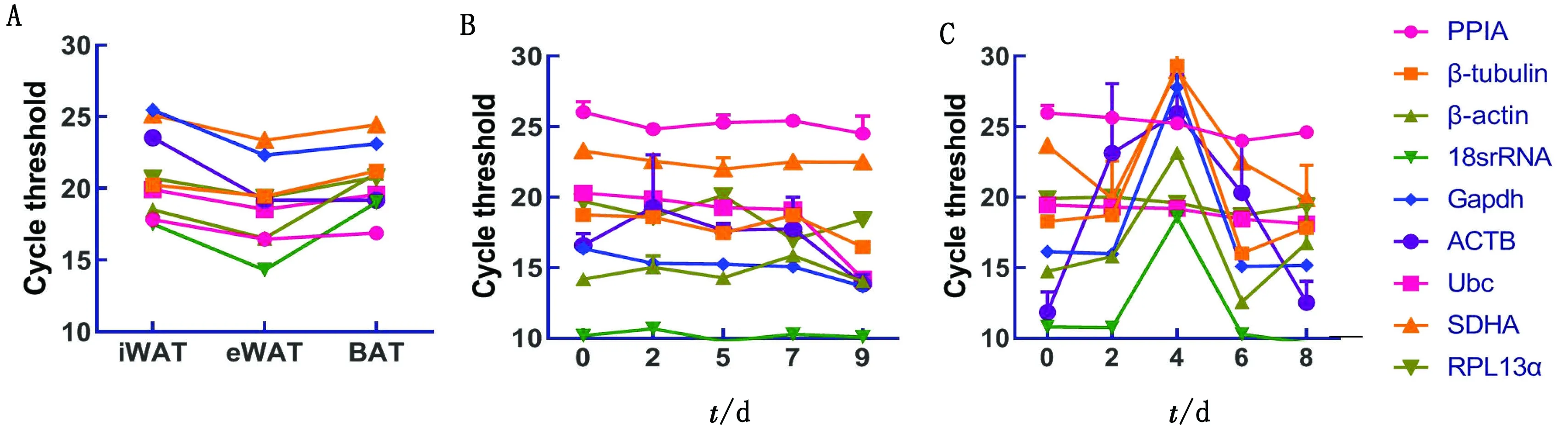
图2 小鼠脂肪组织及脂肪细胞诱导分化过程中9个候选内参基因的循环阈值 A.1~2月龄小鼠的不同类型脂肪组织(iWAT、eWAT、BAT)中内参基因的循环阈值;B.小鼠白色脂肪细胞诱导分化过程中内参基因的循环阈值;C.小鼠棕色脂肪细胞诱导分化过程中内参基因的循环阈值
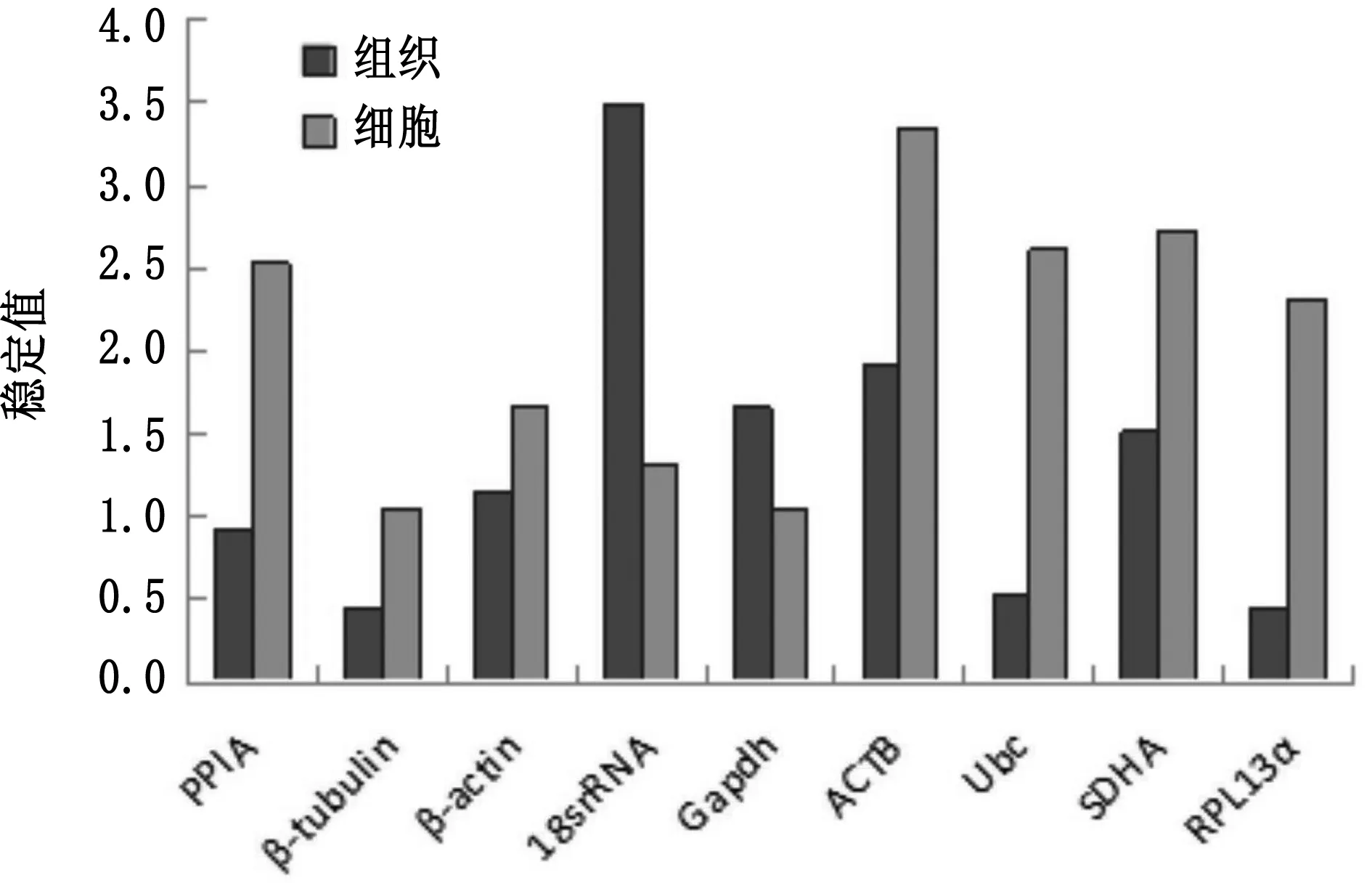
图3 geNorm分析小鼠不同类型脂肪组织及脂肪细胞诱导分化过程中9个候选内参基因的稳定性
NormFinder程序分析发现,在脂肪组织中RPL13a基因排名第一,β-tubulin次之,18S rRNA排名最后,稳定值达到8.888。而在脂肪细胞诱导分化过程中18S rRNA表达最稳定,其次为β-tubulin,RPL13a基因的稳定性介于所选9个内参基因的中间(表3)。BestKeeper分析得出小鼠脂肪组织中9个候选内参基因的稳定性排序为:18S rRNA>PPIA>β-actin>Ubc>RPL13α>β-tubulin>ACTB>Gapdh>SDHA(表4)。小鼠脂肪细胞分化过程中内参基因稳定性排序为RPL13α、PPIA、Ubc、18S rRNA、SDHA、β-tubulin、β-actin、Gapdh、ACTB(表5)。此外通过比较Ct法发现在小鼠不同类型脂肪组织中RPL13α表达最稳定,接下来依次为β-tubulin、Ubc、β-actin、PPIA、Gapdh、SDHA和ACTB,最不稳定的是18S rRNA,而在脂肪细胞诱导分化过程中18S rRNA表达最为稳定(表4,5)。
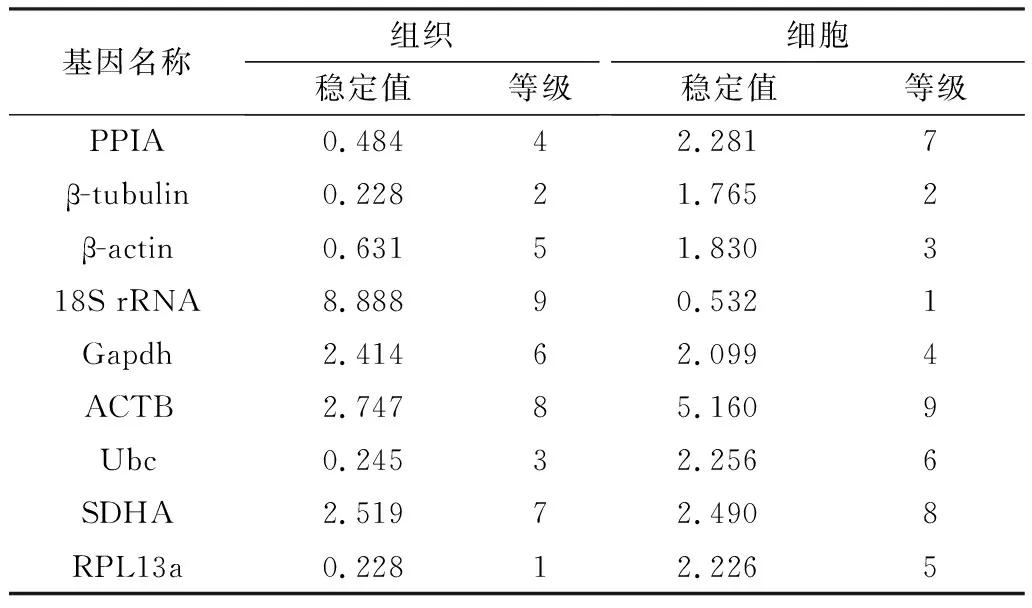
表3 利用 NormFinder 程序分析候选内参基因的表达稳定性
RefFinder程序最终分析出在小鼠不同类型脂肪组织中排名前3位的内参基因分别是RPL13α、β-tubulin、Ubc,其中RPL13α和ACTB是最稳定和最不稳定的内参基因(表4)。在脂肪细胞诱导分化过程中18S rRNA表达最稳定,ACTB也是表达最不稳定的内参基因(表5)。因此,在研究小鼠脂肪沉积过程中ACTB并不适合作为内参基因。
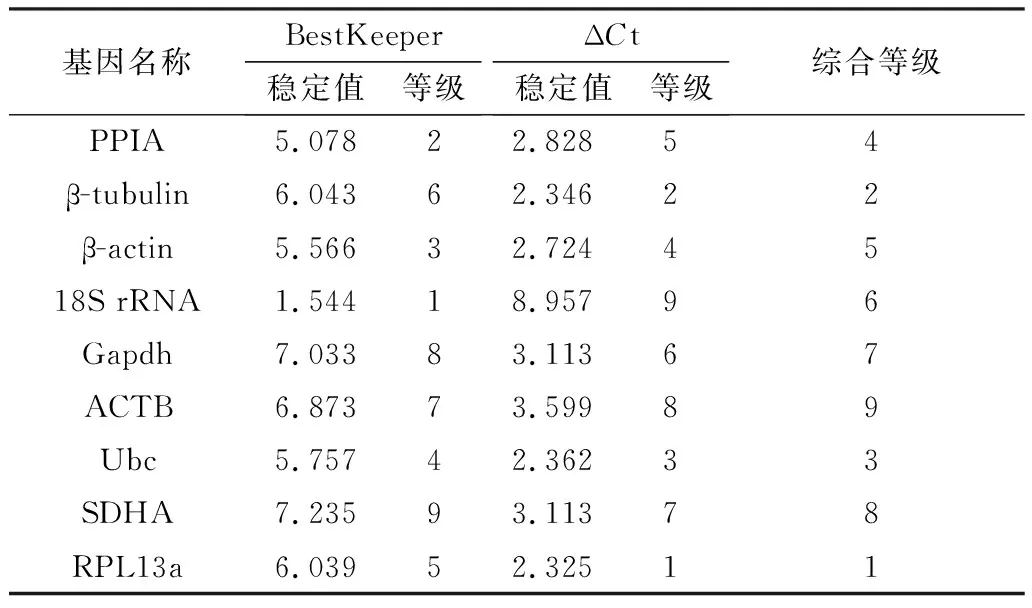
表4 RefFinder程序分析小鼠脂肪组织中候选 内参基因的稳定值
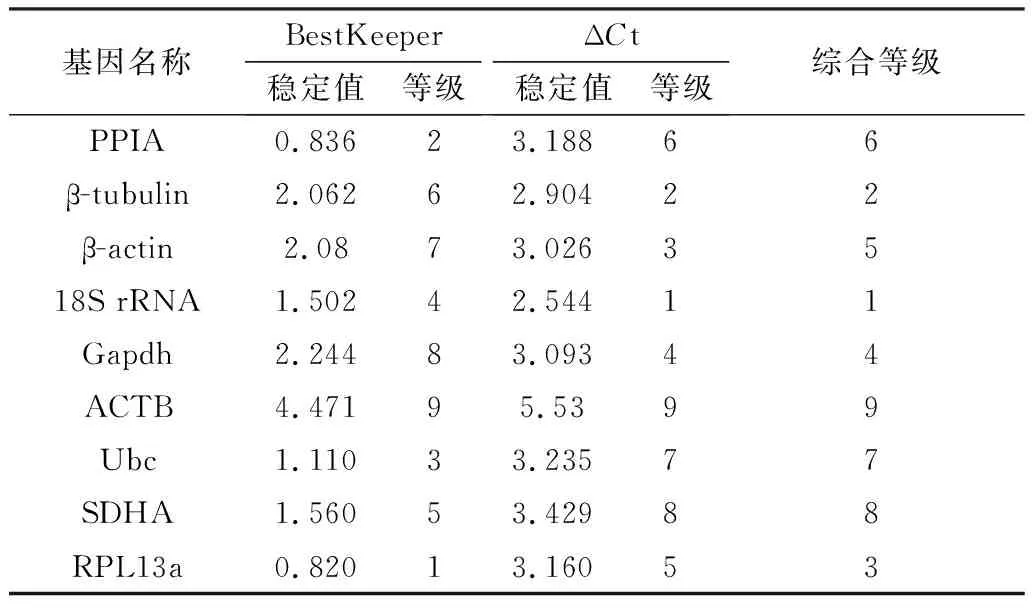
表5 RefFinder程序分析小鼠脂肪细胞诱导分化过程中 候选内参基因的稳定值
2.3 脂肪组织中内参基因的表达验证为验证已筛选稳定内参基因的可靠性,以脂肪组织最稳定的RPL13a基因及最不稳定的ACTB为内参基因,用qPCR方法分析目的基因KDM2A在不同类型脂肪组织的表达。结果显示,以RPL13α 为内参时,KDM2A在eWAT中具有较高的表达量,BAT次之(图4A);而以ACTB为内参基因时,KDM2A在BAT中表达量最高,在eWAT中表达量最低(图4B),进一步通过绝对定量发现KDM2A在不同类型脂肪组织的表达模式与以RPL13a为内参基因的相对定量结果一致(图4C),表明通过上述方法分析获得的稳定内参基因可靠,可广泛作为不同类型脂肪组织基因相对定量表达的内参基因。
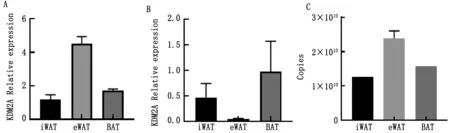
图4 小鼠不同类型脂肪组织中内参基因的表达验证 A.RPL13α为内参基因时KDM2A的相对表达量;B.ACTB为内参基因时KDM2A的相对表达量;C.绝对定量结果
3 讨论
qRT-PCR是基因表达相对定量的常用方法,合适的内参基因是获得可靠试验结果的关键[16-17]。研究表明,没有一种内参基因可在所有条件下被普遍使用[18]。在以往的相关研究中,由于Gapdh和ACTB在所有组织细胞中高表达且表达量恒定[19],常被用作内参基因。然而在人类肥胖相关研究中,CATALAN等[20]证明Gapdh是最不稳定的内参基因。GENTILE等[21]研究发现,RPL13α是人脂肪细胞分化过程中最稳定的内参基因。这与本试验筛选出的小鼠脂肪组织中最稳定表达的内参基因RPL13α的结果相一致。
本试验通过多种程序分析9个候选内参基因的稳定性,结果显示RPL13α和18S rRNA分别是小鼠不同类型脂肪组织及脂肪细胞诱导分化过程中表达最稳定的内参基因。PPIA、SDHA、ACTB、Gapdh等不适合作为小鼠脂肪沉积的内参基因,可能是由于这些基因在脂肪组织沉积或者脂肪细胞分化过程中发挥重要作用。近年来的研究发现,PPIA是一种在肥胖中发挥重要作用的新型脂肪因子,正向调节脂肪细胞分化及机体脂肪组织的沉积[22]。有研究表明,ACTB的表达受细胞有丝分裂原的刺激[23],前体脂肪细胞分化感受诱导信号,首先发生细胞克隆增殖,该过程中ACTB的表达上调[24],因此ACTB也不适合作为脂肪沉积基因表达研究的内参基因。本研究发现Gapdh在脂肪组织及脂肪细胞分化过程中均不适合作为内参基因,Gapdh 是能量代谢过程中的重要激酶[25],白色与棕色脂肪组织或细胞能量代谢过程差异较大[26],因此不适合作为脂肪组织沉积的内参基因。
组蛋白特异性去甲基化酶KDM2A与KDM2B同属KDM2亚家族,KDM2B参与3T3-L1前体脂肪细胞分化早期阶段,而KDM2A对小鼠脂肪沉积的作用尚未见报道[27]。因此,本试验运用RPL13α为内参基因来校正目标基因KDM2A在不同类型脂肪组织中的表达以及绝对定量计算每个样品中的实际拷贝数,为后期继续探究KDM2A基因在小鼠脂肪沉积过程中的作用奠定一定的基础。校正结果显示, KDM2A基因在eWAT中表达量最高,其次为BAT,而在iWAT中表达量最低,而以ACTB作内参基因时,KDM2A基因高表达于BAT,在eWAT中表达量最低。以上结果表明,选择合适的内参基因对RNA定量表达的研究具有至关重要的作用。
综上所述,本试验成功筛选出了小鼠3种不同类型脂肪组织及白色和棕色脂肪细胞诱导分化过程中表达最稳定的内参基因,分别为RPL13α和18S rRNA,并以RPL13α、ACTB为内参基因以及绝对定量来验证KDM2A基因在腹股沟白色脂肪组织、附睾白色脂肪组织和棕色脂肪组织中的表达,为小鼠脂肪沉积过程中基因功能的相关研究提供基础参考。
