Cr掺杂的Co-B非晶态合金的制备及催化硼氢化钠水解制氢
2020-02-24陈悦蓉靳惠明邵阳阳
陈悦蓉,靳惠明,俞 亮,邵阳阳
(扬州大学机械工程学院,江苏扬州225100)
二氧化碳的排放在全球引起了严重的环境问题。氢被认为是一种可再生和可持续的能源,可用于减少全球化石燃料消耗和应对全球变暖[1]。目前,制备氢气的方式有很多种:电解水制氢、矿物燃料制氢、生物制氢等。硼氢化钠水解制氢是目前研究较为广泛的一种硼氢化物制氢方法[2-4]。硼氢化钠水解反应方程式:
NaBH4+2H2O→NaBO2+4H2△=-217 kJ·mol (1)
NaBH4溶液产生氢气具有以下优点[5-8]:1)储氢量高,NaBH4的理论储氢质量分数为10.8%;2)安全性高,NaBH4溶液是不可燃的,在碱性条件下可稳定存在数月,易运输;3)硼氢化钠是放热反应,不需要能量输入就可产生H2;4)氢气纯度高,反应产生的气流中较纯净,仅有H2和一些水蒸气;5)可回收利用率高,副产物是硼酸盐[四羟基硼酸钠,NaB(OH)4],是水溶性的,可以循环使用且对环境无害;6)可控性强,可通过加入催化剂控制产氢速率,一旦溶液与催化剂分离,反应立刻停止。
有机酸、无机酸、金属基催化剂都能够提高硼氢化钠水解反应速率,但酸催化硼氢化钠水解的反应通常无法控制[9],而金属基催化剂可有效地加速水解反应,且反应可控。 贵金属 Pt、Au[10]和 Ru[11]催化剂具有较优的催化活性。但是由于贵金属的价格昂贵,总量有限,贵金属基催化剂的发展受到了很大的限制。非贵金属基催化剂对硼氢化钠水解也有较好的催化活性,其拥有低成本、易推广、易制备的特点,因此非贵金属Co、Ni基催化剂得到了较多的关注。其中,由于Co基催化剂的催化性能较好,价格较低,其研究较为广泛。Co基催化剂的催化性能与其比表面积和成分有关。硼氢化钠水解是放热反应,催化剂颗粒易聚集使其有效比表面积减少,限制了催化活性。近年来,许多研究都是通过增加催化剂的表面积来改善Co-B催化剂的活性[12-16]。为了提高Co基催化剂的性能,Co-B粉末中加入过渡金属(如 Mo[12]、Cr[14]、W[15]、Zn、Cu[16]),这些过渡金属要以氧化物的形式,以较低的浓度就能降低粉末聚集程度,显著增加Co-B催化剂粉末的比表面积。此外,过渡金属可以充当酸性位点,吸收更多的OH-,改善催化剂表面上反应物质的吸收,促进整体催化反应。过渡金属也可增加活性金属原子上的电子密度。 K.Dandan 等[12]发现n(Co)∶n(Mo)=3∶1,Co-Mo-B的粒径减小到30 nm,比面积增大,氧化钼弱化了H—OH的结合,二者相互作用使得硼氢化钠水解产氢速率提高了2.5倍。R.Fernandes等[14]发现掺杂Cr的Co-B粉末团聚程度降低是由于氧化铬存在,催化剂的比表面积因此增加。此外,Cr3+可以吸引更多水中的OH-,使得硼氢化钠水解反应速率明显提高。N.Patel等[15]研究掺杂剂:Ni,Fe,Cu,Cr,Mo 和 W 对Co-B 催化剂的影响, 发现添加了 Cr、Mo、Ni、Cu 的Co-B催化剂使产氢速率增加了3~4倍。L.D.Xin等[16]在 Co-B 催化剂加入 Cu,发现当n(Co)∶n(Cu)=3∶1时,催化剂的活性最高。此外,在高比表面积的材料上沉积催化剂颗粒也可以提高催化剂的活性,比如泡沫镍、γ-Al2O3、石墨烯、纳米管、SiO2、二氧化铈、二氧化锆、TiO2等[17-22]。
掺杂少量的Cr即可显著提高Co基催化剂的活性,Cr的价格相对较低。本文采用化学还原法,在Co-B催化剂中掺杂不同含量的Cr,制备出实用的Co-B-Cr催化剂。
1 实验
1.1 催化剂的制备
通过化学还原法合成Co-Cr-B粉末催化剂。量取 0.3 mol/L 的 CoSO4·7H2O 溶液与 Cr(NO3)3·9H2O溶液混合,将1.0 mol/L的硼氢化钠(NaBH4)溶液作为还原剂缓慢加入混合溶液中,剧烈搅拌所得黑色溶液离心得到黑色沉淀物,用去离子洗涤至中性后再用无水乙醇洗涤2次,干燥得到Co-Cr-B粉末催化剂。 改变加入 Cr(NO3)3·9H2O 的浓度进行对比实验。
1.2 催化剂的表征
通过Zeiss-Supra55型场发射扫描电镜和Tecnai 12型透射电镜(TEM)观察了催化剂粉末的表面形貌;采用D8 Advance型多晶X射线衍射仪(XRD)对样品进行结构和组成测定[Cu靶Kα辐射,管电压为40kV,管电流为 40mA,扫描速度为 4(°)/min,扫描范围为 30~80°]。
1.3 催化性能表征
通过排水法收集氢气得到催化剂对硼氢化钠产氢速率的影响,装置见图1。三口圆底烧瓶置于水浴锅中,称取催化剂倒入烧瓶中,配置NaBH4溶液倒入反应装中,立刻计时,采用排水法收集氢气。

图1 实验装置示意图
2 结果与讨论
2.1 Cr浓度的影响
图2为掺杂不同含量Cr的Co-Cr-B催化剂粉末的SEM照片。由图2可见,当Cr的掺杂量(以Cr与Co物质的量比计,下同)为0.003~0.005时,催化剂粉末呈圆球状,且随着掺杂量的增加,催化剂的粒径(30 nm左右)与未掺杂的产品粒径(80 nm左右)相比明显减小;当Cr的掺杂量超过0.005时,催化剂的粒径随着掺杂量的增加而稍有增加,并且催化剂的形貌发生变化,出现较多的片状组织。
图3为Co-B和Co-Cr-B催化剂粉末的TEM照片。由图3可见,当Co-B粉末中掺杂极少量的Cr后,催化剂的粒径明显减少,催化剂的团聚现象也有所改善。

图2 掺杂不同含量Cr的Co-Cr-B催化剂粉末的SEM照片

图3 不同成分催化剂粉末的TEM照片
图4 a是不同Cr含量的Co-Cr-B催化剂粉末的XRD谱图。由图4a可见,45°处出现宽峰,这是非晶态CoB的特征衍射峰。图4b为催化剂粉末的选区电子衍射照片。由图4b可以明显看出一个漫散的光斑,也可以证明该样属于非晶态。所有掺杂了Cr的催化剂在2θ=35°处出现了一个小峰,代表Cr2O3。

图4 不同Cr含量的Co-Cr-B催化剂粉末的XRD谱图(a)和样品的选区电子衍射照片(b)

图5 不同n(Cr)/n(Co)的Co-Cr-B催化NaBH4水解产氢性能(a)和n(Cr)/n(Co)与产氢速率的关系曲线(b)
图5 a为不同n(Cr)/n(Co)的Co-Cr-B粉末催化NaBH4水解产氢性能图。图5b为n(Cr)/n(Co)与产氢速率关系曲线。由图5可以看出,当纯Co-B催化剂中掺杂极少量的Cr,催化剂催化水解NaBH4溶液产氢速率明显提高;随着掺杂量的增加,催化剂催化水解NaBH4溶液产氢速率先增后降。总体上来看,掺杂少量Cr的催化剂活性优于纯Co-B催化剂。这与催化剂的成分和形貌有关。纯Co-B催化NaBH4水解速率较低,其比表面积较小,仅为31.241 m2/g。当n(Cr)∶n(Co)=0.003 时,Cr以氧化物的形式降低了催化剂的团聚程度,催化剂的粒径明显减少,因此催化剂的比表面积增大,催化剂的活性和吸附性增加。当Cr与Co物质的量比增至0.005时,一方面Cr2O3的存在使得催化剂的粒径减小,催化剂的表面积达到66.402 m2/g;另一方面一部分未氧化Cr3+对BH4-有较大的吸引力,二者共同作用使得催化剂的性能达到最佳。随着n(Cr)/n(Co)继续增大,较多的Cr2O3存在,不仅使催化剂的粒径稍有增大,还覆盖了催化剂表面的活性位点,阻碍了活性Co-B和BH4-的接触;但是,未氧化的Cr3+对BH4-有较大的吸引力,因此催化剂催化水解NaBH4溶液产氢速率下降,但产氢速率仍高于纯Co-B催化剂。
2.2 催化剂量的影响
图6a为不同用量Co-Cr-B催化NaBH4水解产氢性能。图6b为Co-Cr-B用量与产氢速率关系曲线。由图6可见,随着催化剂量的增加,NaBH4溶液产氢速率增加。这是由于催化剂量的增加,使得单位时间内,BH4-与更多的催化剂接触,参与反应的BH4-增多,因此产生的氢气速率增加。NaBH4水解产氢速率与催化剂质量浓度成正比,说明NaBH4水解产氢反应对催化剂质量浓度为一级反应。根据一级反应速率方程:
r=kρ (2)
式中,r为反应速率;k为速率常数;ρ为催化剂质量浓度,g/L。通过方程可以得到NaBH4水解产氢反应的反应速率常数为50.09 min-1。

图 6 不同用量 Co-Cr-B[n(Cr)∶n(Co)=0.010]粉末催化 NaBH4水解产氢性能(a)与Co-Cr-B用量与产氢速率关系曲线(b)
2.3 NaBH4溶液的影响
图7 为不同初始浓度NaBH4溶液时,Co-Cr-B催化剂催化硼氢化钠水解产氢曲线。由图7可见,随着NaBH4溶液初始浓度的增加,硼氢化钠水解产氢速率先增后减。当溶液浓度为1 mol/L时,反应的产氢速率最快。这是由于反应速率与催化剂表面吸附的BH4-的量和H2O有关。NaBH4溶液浓度较低时,催化剂表面吸附的BH4-的量相对较少,产氢速率较低。当NaBH4浓度增至1 mol/L时,催化剂表面吸附的BH4-的量增加,反应速率达到最大。当NaBH4溶液浓度继续增加时,一方面由于反应消耗水,反应生成的偏硼酸钠溶解度降低,易吸附在催化剂的表面,阻碍了BH4-与催化剂的接触;另一方面,水的含量减少,溶液黏度增加,M-H与H2O接触的概率降低,产氢速率因此降低。

图 7 Co-Cr-B[n(Cr)∶n(Co)=0.005]催化不同浓度 NaBH4溶液水解产氢性能(a)与NaBH4溶液浓度与产氢速率关系曲线(b)
2.4 温度的影响
图8 a为不同温度下,NaBH4溶液反应产氢曲线。随着温度的增加,水解产氢速率明显增加。这是由于温度升高,溶液中的BH4-扩散速率明显增加,BH4-和催化剂的接触概率增加,反应的BH4-可以快速补充,产生的氢气可快速脱离催化剂的表面,副产物偏硼酸钠在溶液中的溶解度增加,覆盖在催化剂表面的概率降低。图8b为1/T为横坐标lnk为纵坐标的Arrhenius拟合图,1/T与lnk呈线性关系。温度T与反应速率k的关系:

式中,k为温度为T时反应速率常数;Ea为反应活化能,J/mol;R为气体常数,J/(mol·K);T为反应温度,K;A为指前因子。此反应的活化能为44.51 kJ/mol。
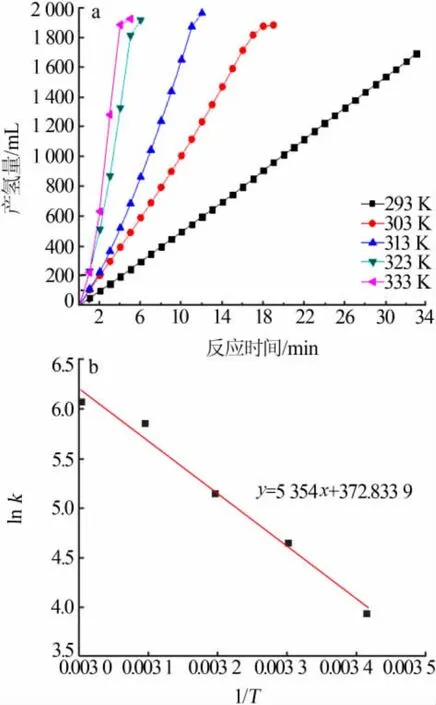
图 8 不同反应温度下 Co-Cr-B[n(Cr)∶n(Co)=0.005]催化NaBH4水解产氢性能(a)与 Arrhenius曲线(b)
2.5 氢氧化钠浓度影响
图9 为不同NaOH浓度的硼氢化钠溶液水解产氢速率图。未添加NaOH的NaBH4溶液,水解产氢速率基本不变。当NaBH4溶液中添加NaOH,起初溶液的水解产氢速率明显提高;随着反应时间延长,反应速率逐渐降低。随着NaOH浓度的增加,NaBH4溶液产氢速率稍有增加,随着反应的进行,溶液产氢速率下降。这与催化剂催化NaBH4溶液的机理有关。NaOH 的加入使得 BHnOH(4-n)[BH3OH-、BH2(OH)2-、BH(OH)3-、B(OH)4-]产生速率加快,分解产生 M-H的速率也因此增加,从而H2的产生速率增加。此外,增加NaOH的浓度,BH4-与OH-接触概率增加,但是OH-会占据催化剂表面的活性位点,溶液的黏度也有所增加,因此,硼氢化钠溶液水解反应速率稍有增加。由于前期反应速率较快,产生大量的副产物偏硼酸钠,该产物属于强碱弱酸盐,在碱性条件下溶解度比较低,偏硼酸钠会覆盖在催化剂的表面,阻碍了M-H和H2O的接触,因此反应后期H2的产生速率下降。

图 9 Co-Cr-B[n(Cr)∶n(Co)=0.015]催化不同 NaOH浓度的NaBH4溶液水解产氢性能
3 结论
采用化学还原法制得三元非晶态Co-Cr-B催化剂,研究了Cr与Co物质的量比、催化剂用量、NaBH4溶液浓度、反应温度、NaOH浓度等因素对NaBH4水解产氢反应的影响。得到结论:1)化学还原法制得三元非晶态 Co-Cr-B 催化剂,当n(Cr)∶n(Co)=0.005时,催化剂为球状,其粒径为30 nm左右,催化效果最佳。与纯Co-B相比,其对硼氢化钠水解产氢速率提高了2倍。2)催化剂用量、反应温度对NaBH4溶液水解产氢反应速率有明显影响,催化剂用量越大,反应温度越高,产氢速率越快。3)NaBH4溶液浓度和NaOH浓度对产氢速率也有影响。NaBH4溶液产氢速率随着溶液浓度增大而提高,在1 mol/L时达到最大,继续增大NaBH4溶液浓度,反应速率下降。当NaBH4溶液中添加NaOH,起初溶液的水解产氢速率明显提高;随着反应时间延长,反应速率逐渐降低。
