以PAC为原料制备锂吸附剂及其吸附性能的研究
2020-02-24张文丁邓小川朱朝梁樊发英卿彬菊
张文丁 ,邓小川 ,朱朝梁 ,樊发英 ,张 毅 ,卿彬菊
(1.中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁810008;2.青海省盐湖资源综合利用工程技术中心;3中国科学院大学)
吸附法提锂主要依靠吸附剂对锂离子的选择性吸附实现锂的分离富集。吸附法提锂的优势在于选择性好、工艺简单、过程绿色,另外可应用于低品位卤水锂矿的分离提取。锂吸附剂有无机吸附剂和有机吸附剂[1]两类,但有机锂吸附剂研究很少,主要以无机锂吸附剂为主。研究较成熟的无机锂吸附剂根据其结构主要分为无定型氢氧化物吸附剂、层状吸附剂、铝盐吸附剂和离子筛型吸附剂[2]等。目前,已实现工业应用的锂吸附剂主要有锰系[3]和钛系[4]离子筛型吸附剂。
对于铝盐锂吸附剂的研究始于20世纪80年代,但总体而言相关研究较少。铝盐锂吸附剂的优势是选择性高、制备原料廉价易得、成本低。现有研究多以氢氧化铝为原料来合成吸附剂,所制备的吸附剂综合性能还不太令人满意,主要是其吸附容量较锰系和钛系离子筛型吸附剂明显偏低。
作为新型的无机高分子混凝剂,聚氯化铝(PAC,poly aluminum chloride)是一种介于 AlCl3和Al(OH)3之间的水溶性无机高分子聚合物,化学通式为[Al2(OH)nCl6-n],其中n表示 PAC 产品的中性程度。笔者拟采用PAC[5]为原料来制备铝盐锂吸附剂,并对所制备吸附剂的吸、脱附性能进行研究。
1 实验部分
1.1 试剂和仪器
试剂:聚氯化铝(质量分数为98%,上海麦克林生化科技有限公司)、LiOH·H2O(AR,国药集团化学试剂有限公司)、LiCl·H2O(AR,国药集团化学试剂有限公司)、无水乙醇(AR,天津富宇精细化工有限公司)。
仪器:NEXUS型傅里叶变换红外光谱仪、X′pert Pro型X射线衍射仪、FEI NanoSEM400型扫描电镜、Icap6500型电感耦合等离子体原子发射光谱仪、磁力加热搅拌器、蠕动泵、电热恒温鼓风干燥箱等。
1.2 实验方法
吸附剂合成方法:以PAC和LiOH为原料,常温水相反应制得含锂复合铝盐,得到铝盐吸附剂。实验条件:15 g PAC、3.75 g LiOH·H2O分别溶于200 mL高纯水中,将LiOH溶液以20 mL/min的速度滴加到PAC溶液中反应,25℃反应 2 h,搅拌速度为400 r/min,经离心分离、水洗醇洗后,在75℃下干燥得到吸附剂。
锂离子的脱除:合成的粗品吸附剂经研磨后,以0.1 mol/L的稀HCl溶液为洗脱液,在30℃下于水浴恒温振荡洗涤12 h,脱除锂离子,再经水洗、过滤、75℃烘干24 h后得到吸附剂。
吸附量的测定:测定吸附前后锂离子浓度,计算吸附量(Q,mg/g)。 计算公式:

式中,ρ1为吸附前溶液锂离子质量浓度,g/L;ρ2为吸附后溶液锂离子浓度,g/L;V为吸附溶液的体积,mL;m为吸附剂的质量,g。
2 结果与讨论
2.1 吸附剂的表征
图1为吸附剂的XRD谱图。由图1可知,吸附剂为结晶度较低的 LiCl·2Al(OH)3·nH2O、Al(OH)3和非晶态化合物的混合物。
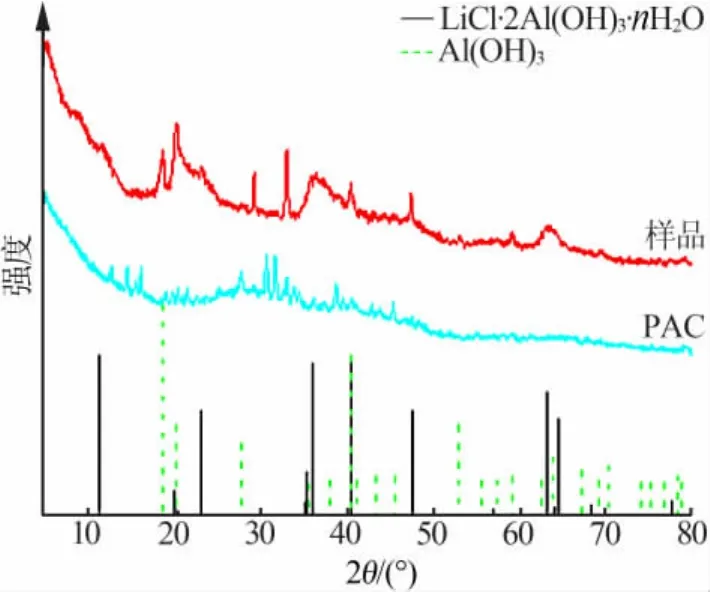
图1 吸附剂的XRD谱图
图2 为吸附剂的SEM照片。由图2可见,吸附剂样品以片状结构为主,还有大量颗粒物,片状结构尺寸为0.1~0.3 μm,片状结构为结晶度较差的LiCl·2Al(OH)3·nH2O。

图2 吸附剂的SEM照片
图3 为吸附剂的FT-IR谱图。由图3可见,3 456.76 cm-1处是羟基的伸缩振动产生的吸收峰,1640.45cm-1处为水分子的剪式振动峰,1422.45 cm-1处为CO32-的振动峰,995.07 cm-1处为Al—OH键振动峰、755.38 cm-1处为Al—O键振动峰,537.68 cm-1处为Li—O键振动峰。将红外结果与XRD结果对照,推测XRD结果中未确定的非晶态物质为非晶态的LiCl·2Al(OH)3·nH2O 和 Al(OH)3。吸附剂的组成为结晶度较低和非晶态的 Al(OH)3、LiCl·2Al(OH)3·nH2O的混合物。

图3 吸附剂的FT-IR谱图
2.2 吸附实验
2.2.1 吸附时间对吸附量的影响
取约10 g吸附剂,加入500 mL锂离子质量浓度约为1.8 g/L、pH=3.27的LiCl中,在30℃下振荡吸附,考察了吸附时间对吸附量的影响,结果见图4。从图4可见,在吸附开始的5 h以内,吸附量随着吸附时间延长而迅速增大,5 h以后增大速度放缓,大约在8 h时基本达到平衡,此时吸附量为5.8 mg/g。随着吸附时间的进一步延长,吸附量变化不大,到15 h完全达到平衡,平衡吸附量即吸附容量为6.1 mg/g。结合实际实验的情况,确定后续实验吸附时间为8 h。
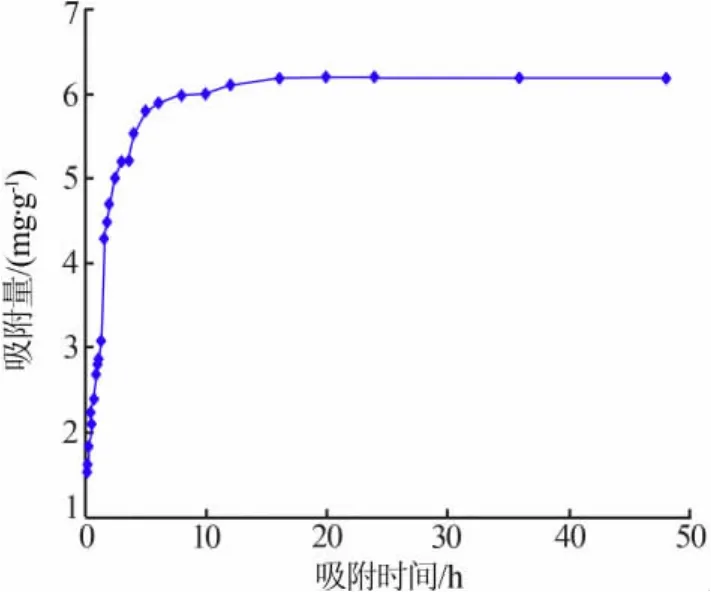
图4 吸附量随吸附时间的变化曲线
2.2.2 温度对吸附量的影响
取约10 g吸附剂,加入500 mL锂离子质量浓度约为1.8 g/L、pH=3.27的LiCl中,振荡吸附8 h,考察了温度 (25、30、35、40、50、60 ℃) 对吸附量的影响,结果见图5。从图5可见,随着温度升高吸附容量整体呈增大趋势,当温度从25℃升至60℃时,吸附量相应地从6.1mg/g提升至8.85mg/g。实验结果表明,温度对吸附量的影响非常显著,吸附在高温下更有利。

图5 吸附温度对吸附量的影响
2.2.3 初始液浓度对吸附量的影响
取约10 g吸附剂,加入500 mL不同质量浓度锂离子、pH≈3的LiCl中,振荡吸附8 h,考察了初始锂离子质量浓度对吸附量的影响,结果见图6。从图6可见,在锂离子初始质量浓度为0.6~3.1 g/L时,吸附量随着初始浓度的增加而相应增大。实验表明,吸附液浓度的提高有利于吸附。
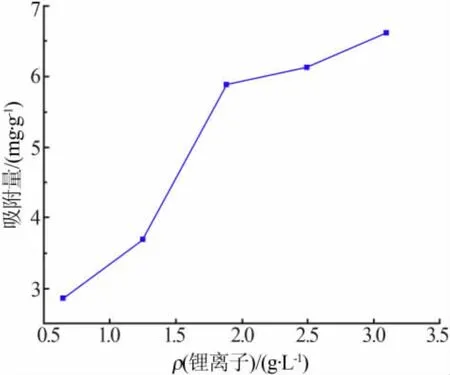
图6 锂离子初始浓度对吸附量的影响
2.2.4 pH对吸附量的影响
取约10 g吸附剂,加入500 mL锂离子质量浓度约为1.8 g/L的LiCl中,在30℃下振荡吸附,实验考察了 pH(3.02、4.01、4.90、6.19、7.93、10.04)对吸附量的影响,结果见图7。由图7可见,吸附量随着吸附溶液pH的增大而逐渐减小,在pH为3.02~10.04时,吸附量从6.4 mg/g降至3.9 mg/g。实验表明,pH对吸附的影响非常显著,吸附剂在酸性环境下吸附量较高,而在碱性环境时吸附量较低。但吸附溶液过酸,吸附剂会被溶解。因此,实验选择适宜的溶液pH为 3~5。
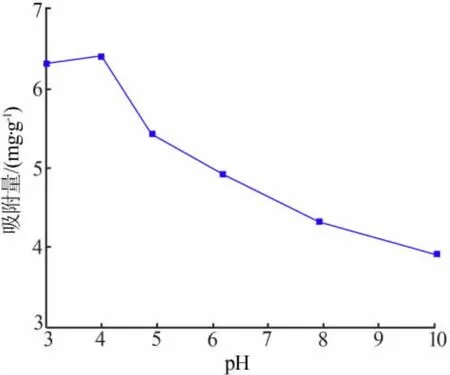
图7 pH对吸附量的影响
2.2.5 选择性吸附实验
研究在4个含有一种干扰离子的简单体系(Li-Na、Li-K、Li-Ca、Li-Mg体系) 以及自制模拟卤水体系中的吸附选择性,结果见表1。由表1可见,在Li-Na、Li-Ca、Li-K体系中,吸附剂对锂都具有选择性。尤其是Li-Ca体系中的分离系数达到了10以上,选择性非常好;吸附剂在Li-Na体系中对锂的选择性次之;对于Li-Mg体系来说,吸附剂对镁离子的选择性吸附远远高于对锂离子的吸附。

表1 简单体系吸附实验
表2为自制模拟卤水选择性吸附实验的结果。从表2可以看出,吸附结果与简单体系的结果基本一致,在Li、Na、Ca共存时,吸附剂对锂都具有选择性。尤其是Li+、Ca2+的分离系数达到了78以上,选择性非常好;在Li-Mg共存体系中,吸附剂对Mg2+有很好的选择性吸附效果。
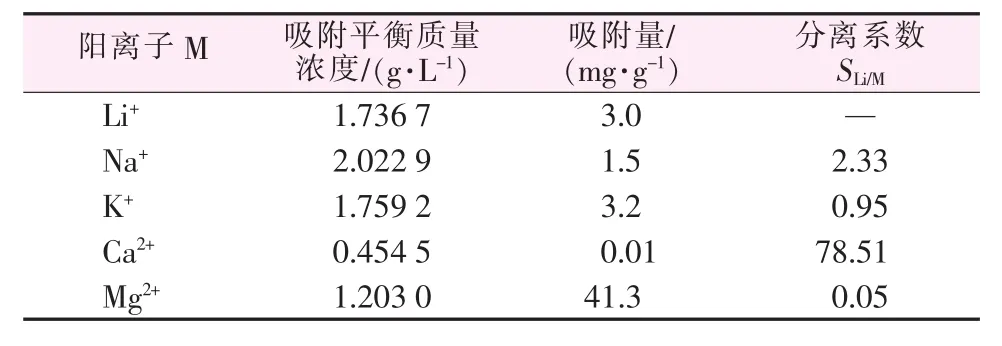
表2 模拟卤水选择性吸附实验结果
以PAC为原料制备的铝盐锂吸附剂,其在简单体系和模拟卤水复杂体系中,均对Ca2+有良好的分离效果,同时相对Na+也有一定的分离效果,吸附剂适用于 Li+与 Ca2+、Na+的分离富集; 在 Li+、Mg2+共存体系中,通过对Mg2+的选择性吸附,也可实现Li+和Mg2+之间的分离,可以另辟蹊径利用吸附剂这一特性找到其他合适的用途。
2.3 脱附实验
以不同pH的高纯水、稀LiCl溶液为洗脱液,研究了洗脱液、洗脱液pH、脱附温度、脱附时间等条件对脱附率的影响,结果见表3。分析表3实验结果,得出主要结论:所建立的脱附工艺,最高脱附率为40.58%,最低脱附率为9.17%;高纯水的脱附率明显高于稀LiCl溶液的脱附率;在60℃下的脱附率均高于30℃下的脱附率,且差异明显;当调节高纯水的pH=3时,脱附率最高;脱附时间在12~24 h时差别并不显著,可见脱附12 h左右已基本平衡。综上所述,脱附的最佳条件:以pH为3左右的高纯水为洗脱液,60℃下脱附12 h。

表3 脱附实验结果
2.4 吸附动力学研究
采用吸附量随时间变化的数据,分别用准一级动力学模型 (1)[6]和准二级动力学模型(2)[6]对动力学数据进行拟合,结果见图8,动力学模型拟合参数见表4。

式中,Qt为在t时刻时的吸附量,mg/g;Qe为吸附达到平衡时的吸附量,mg/g;K1(h-1)、K2[m2/(mg·h)]代表吸附速率常数。

图8 吸附动力学模型拟合

表4 吸附动力学模型拟合参数
比较表2两种模拟结果,准二级动力学方程拟合模型相关系数较高,且通过拟合线性方程计算得到的理论最大吸附量Qe与实验得到的最大吸附量更为接近,也能说明吸附剂的吸附过程更契合准二级动力学模型。
2.5 吸脱附机理研究
为研究吸附、脱附机理,对比了吸附前后、脱附前后吸附剂的XRD谱图,结果见图9。从图9a可以看出,吸附前后衍射峰位置、峰强度基本没有发生改变,只有吸附剂的第一个特征峰强度有变化,推测这是锂离子的脱出和嵌入形成的。从图9b可以看出,脱附前后衍射峰位置、峰强度基本没有发生改变,也只有第一个特征峰强度发生变化,推测这同样也是由锂离子的脱出、嵌入所引起。
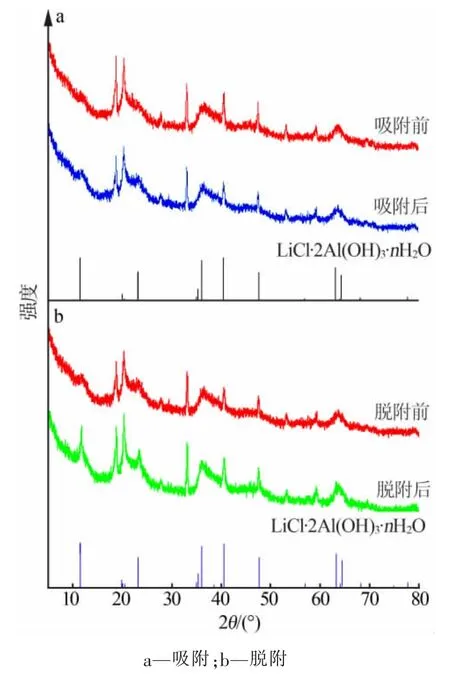
图9 吸脱附前后XRD谱图
图10 为吸附前后、脱附后吸附剂的红外谱图。由图10可以看出,吸附前、吸附后以及脱附后,吸附剂的红外吸收谱图中主要的峰都未发生变化:羟基的振动峰(3 461.72 cm-1和3 461.79 cm-1以及3461.84cm-1)保持不变、水分子的振动峰(1638.54cm-1和1 654.83 cm-1以及1 633.64 cm-1)也基本保持不变、400~1 000 cm-1之间的金属-氧键和氧-金属-氧键的振动峰基本未变。但吸附前吸附剂在2 917.76 cm-1和2 856.07 cm-1处的吸收峰在吸附后消失,脱附后又重新出现(2 923.36 cm-1和 2 847.66 cm-1)。据文献报道[7],2 917.76 cm-1和 2 923.36 cm-1的峰归属于H—Cl键的振动吸收峰。吸附前和脱附后,锂离子脱出留下的活性位点为氢离子占据,出现H—Cl键的红外吸收峰;吸附后,活性位点被锂离子占据,所以H—Cl键的红外吸收峰消失,表明吸附、脱附过程中,锂离子与氢离子发生了离子交换。红外吸收峰发生上述变化说明吸附、脱附过程发生了锂离子的嵌入和脱出,这个推断与XRD分析结论相一致。吴志坚等[8]研究认为锂离子很可能是以裸离子的形式嵌入氢氧化铝层内的八面体空腔内而被吸附,为平衡电荷,氯离子进入层间。筛分效应和锂离子与其他离子水合作用的差异是吸附剂对锂有较好选择性的主要原因。

图10 吸脱附前后的红外谱图
3 结论
本文以PAC为原料制备了锂吸附剂,并系统研究了吸附剂的吸附、脱附性能,对吸附机理做了探讨。结果表明:吸附剂的吸附容量为6.1 mg/g,吸附平衡时间为15 h,吸附溶液的最佳pH为3~5,吸附剂Li+与Ca2+、Na+的分离系数高;以pH为3左右的高纯水为洗脱液,在60℃下脱附12 h可达最佳脱附效果;吸附机理的研究表明,吸附剂在吸附前后结构未发生明显变化;吸附、脱附过程中有锂离子通过与氢离子进行离子交换实现嵌入和脱出。
本文所制备吸附剂的吸附容量较其他铝盐锂吸附剂有所提高,但较锰系、钛系锂吸附剂则偏低。且该吸附剂对于锂镁分离效果较差,后续还需要针对上述问题开展相关研究。
