杨树PtBBE9a基因异源过表达功能分析
2020-02-22施天元程玉祥
施天元 程玉祥
摘要:小檗碱桥酶(berberine bridge enzyme,简称BBE)是一类典型的黄素双共价氧化酶家族,参与植物生长发育的多个生物过程。PtBBE9a是笔者所在课题组前期从杨树发育木质部分离、鉴定的糖蛋白。PtBBE9a基因表达在杨树木质部呈现高丰度水平,并且随着茎木质化程度的增强而升高。组织β-葡萄糖苷酸酶(GUS)活性染色结果显示,PtBBE9a启动子活性集中在ProPtBBE9a::GUS转基因拟南芥幼苗的顶端分生组织、成熟果荚皮及根组织。通过构建PtBBE9a-GFP过表达载体发现,PtBBE9a过表达拟南芥比野生型拟南芥早开花。进一步研究发现,转基因拟南芥的叶片数少于野生型拟南芥,而其茎木质素含量高于野生型拟南芥。推测PtBBE9a可能通过调控拟南芥生长发育周期而产生早花表型。
关键词:杨树;PtBBE9a基因;异源过表达;启动子;转基因拟南芥;BBE
中图分类号: S718.43 文献标志码: A 文章编号:1002-1302(2020)23-0066-05
小檗碱桥酶(berberine bridge enzyme,简称BBE)是一类典型的黄素双共价氧化酶家族[1]。BBE家族的所有成员均有黄素腺嘌呤二核苷酸(FAD)结构域和底物结合域(a/b结合域)[2]。BBE最先被报道参与生物碱合成[3-4],随后人们发现了BBE的不同功能,如参与免疫反应与胁迫响应[5-6]、受激素调控[7-9]、参与雌雄配子体发育和花粉管伸长等[10-12]。Daniel等研究发现,拟南芥中的BBE蛋白具有木质素氧化酶特性,可氧化松柏醇、β-糖苷松柏醇等木质素单体,参与木质素生物合成[13]。
杨树BBE家族有69个成员,分为A~F 6个亚型[14]。笔者在前期研究并鉴定杨树发育过程中的木质部糖蛋白组时,识别到11个PtBBEs(未发表),PtBBE9a是其中之一。经过序列比对发现,PtBBE9a与拟南芥单木质素氧化酶AtBBE-like 13是对应基因。本研究通过分析PtBBE9a在组织内的表达水平和其启动子活性,旨在着重解析PtBBE9a在模式植物拟南芥中的异源过表达功能。
1 材料与方法
1.1 试验材料
在2018年10月取生长于东北林业大学林木遗传育种国家重点实验室温室内的毛果杨(Populus trichocarpa)幼树(6月龄)的各个组织和茎节,用于转录水平的基因表达分析。将温室栽培45 d的苗期、开花盛期的拟南芥用于农杆菌浸花法遗传转化。
1.2 主要试剂
pBIOZOL Plant Total RNA Extraction Reagent(Bioflux);cDNA反转录试剂盒[PrimeScript RT reagent Kitt with gDNA eraser(购自Takara公司)];pENTR/SD/D-TOPO、Gateway LR酶(购自Invitrogen公司);胶回收试剂盒[Silica Bead DNA Gel Extrction Kit(购自Thermo Scientific公司)];KOD-Plus高保真酶(购自Toyobo公司);X-Gluc、乙酰溴(购自Sigma公司)。GUS染液配方:1 mg/mL X-Gluc,10 mmol/L EDTA(乙二胺四乙酸),100 mmol/L Na3PO4(磷酸钠),2 mmol/L K3Fe(CN)6(铁氰化钾),2 mmol/L K4Fe(CN)6(亚铁氰化钾),0.1% Triton X-100(聚乙二醇辛基苯基醚)。
1.3 试验方法
1.3.1 植物RNA的提取和cDNA的合成 在液氮条件下把毛果杨各个组织、茎节及拟南芥叶片材料研磨成粉末,加入pBIOZOL植物RNA提取试剂,提取具体操作参照pBIOZOL Plant Total RNA Kit说明书。cDNA的合成参照PrimeScript RT reagent Kit with gDNA Eraser操作說明书进行。
1.3.2 PCR扩增 20 μL RT-PCR反应体系:13.5 μL 去离子无菌水,2.0 μL dNTP,2.0 μL 10×Buffer,0.5 μL Taq DNA聚合酶,各0.5 μL引物,1.0 μL cDNA模板。RT-PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,55~60 ℃ 30 s,72 ℃ 30 s,24~35个循环;72 ℃ 7 min。扩增产物经2%琼脂糖电泳检测。50 μL全长基因和启动子扩增体系:32.0 μL去离子无菌水,5.0 μL dNTP Mix(2 mmol/L),5.0 μL 10×PCR buffer,2.0 μL MgSO4(25 mmol/L),1.0 μL KOD-plus,各1.5 μL引物,2.0 μL模板。扩增产物经1.0%琼脂糖电泳检测。
1.3.3 ProPtBBE9a::GUS 和35S::PtBBE植物表达载体的构建 用PtBBE9a-Pro-up/down引物扩增PtBBE9a基因启动子片段;回收后连接至pENTR/SD/D-TOPO载体上,再用该载体转化TOP10;挑选出阳性菌落,提取质粒,经LR交换连接到pGWB3上,将后者转化入GV3101农杆菌中。用PtBBE9a-up/down引物扩增PtBBE9a基因片段,再将其连接至pENTR/SD/D-TOPO载体上,提取阳性菌落质粒,经LR交换构建到pGWB5植物过表达载体上。
1.3.4 拟南芥遗传转化及转基因植株的分子鉴定 拟南芥遗传转化采用农杆菌浸花法[15]。转基因拟南芥的分子鉴定包括2个方面:用RT-PCR检测转入PtBBE9a基因的转录水平;用Western Blot检测转入PtBBE9a基因的蛋白质水平,一抗为anti-GFP抗体,具体操作方法参考Liu等的报道[16]。
1.3.5 GUS染色检测 将ProPtBBE9a::GUS各组织材料放入离心管中,加入GUS染液使其没过植物材料,放入真空干燥器里抽气,重复数次至植物材料沉至管底。取出植物材料后于37 ℃过夜反应,再分别用100%、90%、70%乙醇逐级脱去叶绿素。
1.3.6 拟南芥开花时间及叶片数统计 当拟南芥茎抽出1 cm时,统计时间和莲座叶数量。每个转基因株系统计15个植株,重复3次,并进行数据统计分析。
1.3.7 木质素含量的测定 称取1 mg拟南芥茎组织粉末,木质素含量的测定参照Foster等的改良测定方法[17]。
1.3.8 数据分析 采用IBM SPSS 19.0软件进行数据分析。对开花时间、开花时叶片数和茎组织木质素含量等数据使用单因素方差分析(ANOVA)。
1.3.9 引物序列 本研究所用引物及其序列见表1。
2 结果与分析
2.1 PtBBE9a基因的表达分析
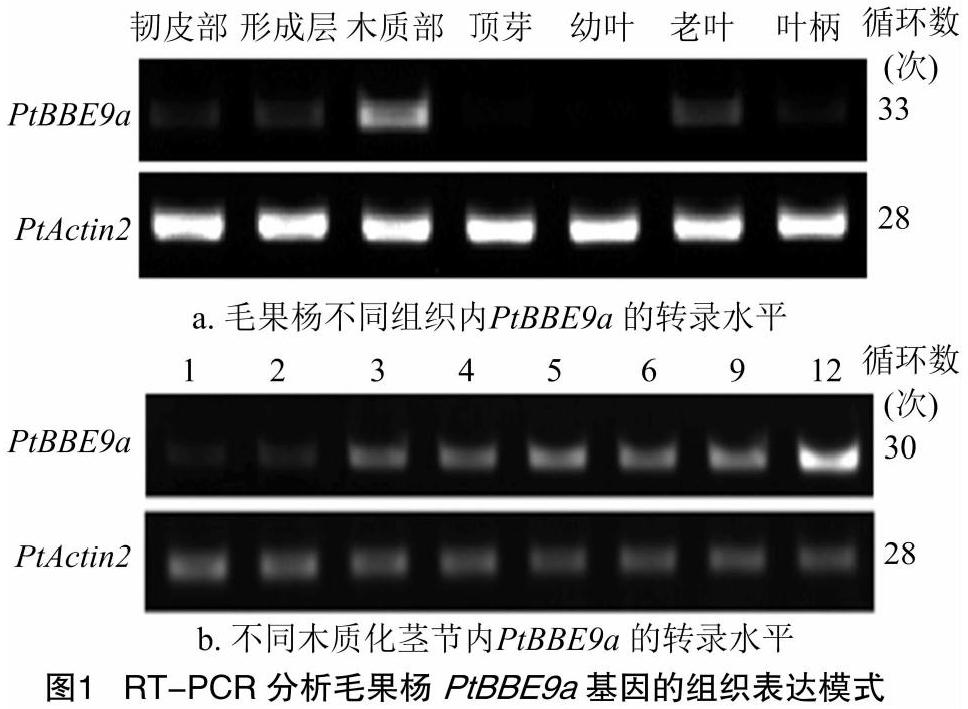
提取毛果杨木质部、形成层、韧皮部、顶芽、幼叶、老叶、叶柄和第1~6、9、12茎节总RNA后,反转录合成cDNA。用PtActin2内标基因对各组织内的cDNA进行定量,RT-PCR分析结果显示,PtBBE9a能在木质部特异性表达且转录水平较高,在形成层和老叶中也有少量转录(图1-a)。第1、2茎节中PtBBE9a的转录水平极低,第3、4、5、6、9茎节中的转录水平逐渐增加,第12茎节中的转录水平极高(图1-b)。这表明随着毛果杨茎逐步木质化,PtBBE9a的转录水平逐渐升高。
2.2 ProPtBBE9a::GUS植物表达载体的构建
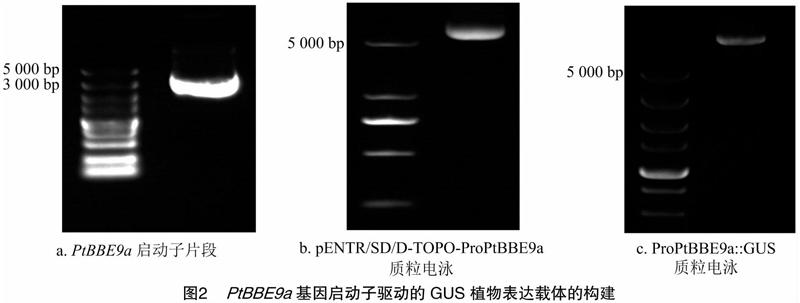
为了鉴定PtBBE9a基因启动子的活性,构建其驱动表达GUS报告基因的pGWB3植物表达载体。经PCR扩增,得到3 287bp的PtBBE9a启动子片段(图2-a),将其连接到pENTR/SD/D-TOPO载体上(图2-b),通过LR交换反应,将PtBBE9a启动子片段同源重组到pGWB3载体上,得到ProPtBBE9a::GUS融合质粒(图2-c),将其转化GV3101农杆菌,用于拟南芥的遗传转化。
2.3 ProPtBBE9a::GUS转基因拟南芥组织GUS活性染色
通过对拟南芥进行转化,获得12个ProPtBBE9a∷GUS转基因株系。苗龄为5、10 d的幼苗染色结果显示,GUS活性出现在顶端分生组织(图3-a~图3-c)。在开花的ProPtBBE9a∷GUS转基因植株中,在果荚基部、成熟果荚皮上均检测到GUS染色(图3-d~图3-e)。另外,在成熟的植株根部也检测到GUS染色(图3-f)。这些结果提示,ProPtBBE9a启动子活性集中在拟南芥幼苗的顶端分生区和维管系统较发达的根组织。
2.4 PtBBE9a过表达载体的构建及其在拟南芥中的异源过表达
为了鉴定PtBBE9a的功能,笔者构建了pGWB5-PtBBE9a植物过表达载体。以毛果杨木质部组织cDNA为模板,扩增出了PtBBE9a基因的全长片段(图4-a),将该基因片段连接到pENTR/SD/D-TOPO载体上(图4-b),采用LR交换反应得到 35S∷PtBBE9a-GFP 融合质粒(图4-c),再用该质粒转化GV3101农杆菌,用于拟南芥过表达转化。
采用农杆菌浸花法将35S∷PtBBE9a-GFP转化入拟南芥中,获得12个独立的转基因株系(编号为1#~12#)。提取野生型和12个转基因拟南芥株系的总RNA并合成cDNA,用RT-PCR检测各株系PtBBE9a-GFP的转录水平(图5-a)。与内参基因AtActin2相比,2#、5#、10#、12#株系中PtBBE9a的转录水平极高,表明这4个株系达到了PtBBE9a的过表达水平。随后,通过Western检测分析转基因株系的PtBBE9a-GFP蛋白质水平(图5-b)。以Actin蛋白量为参照的分析结果显示,2#、5#、10#、12# 株系中的PtBBE9a-GFP蛋白质含量非常高,表明这4个株系的PtBBE9a蛋白质量达到了过表达水平。
2.5 过表达PtBBE9a拟南芥早开花
笔者选取PtBBE9a过表达量最高的3个转基因株系(2#、5#、12#)的鑒定表型,发现3个过表达株系拟南芥均比野生型拟南芥呈现出早开花表型(图6-a),野生型拟南芥生长至抽薹的平均时间为23.87 d,3个过表达株系生长至抽薹的平均时间分别是21.53、21.00、19.07 d。进一步观察过表达株系发育状态发现,抽薹时野生型拟南芥莲座叶数量平均为12.87张,3个过表达株系的莲座叶数量分别为11.40、10.93、9.73张(图6-b),表明PtBBE9a过表达导致拟南芥植株的生长发育周期缩短。为了探究PtBBE9a过表达带来的早开花功能,笔者测定了3个转基因株系的茎部木质素含量,结果显示,转基因植株茎部木质素含量均高于野生型植株(图6-c)。
3 讨论
早期被报道的BBE家族功能是参与生物碱合成,最新的研究发现,BBE有木质素单体氧化酶活性[13]。PtBBE9a是笔者在前期研究中从杨树木质部糖蛋白组中分离出来的(数据未发表)。本研究发现,PtBBE9a在毛果杨木质部呈现出特异性转录水平,在ProPtBBE9a∷GUS转基因拟南芥中,PtBBE9a启动子的活性主要体现在顶端分生组织和成熟根部,这些组织是植物次生维管系统较发达的组织,暗示PtBBE9a很可能与细胞壁的木质素代谢相关。
过表达PtBBE9a拟南芥出现早花表型,该发现在植物BBE功能研究中尚未报道。研究还发现,转基因PtBBE9a拟南芥的连座叶数量变少,表明转基因缩短了拟南芥的生长周期,使其比野生型早开花。另外,过表达PtBBE9a的拟南芥茎部木质素含量明显高于野生型。木质素水平升高很可能会加速植物维管组织系统成熟,可能增强了叶片成花素(FT)的运输。过表达糖苷转移酶基因的烟草会早花,木质素含量会升高[18],而过表达细胞壁扩张蛋白也会导致植物早花[19]。推测植物维管系统细胞壁状态可能与早开花密切相关,而木质素是次生细胞壁的关键成分,它影响次生维管系统的发育成熟。今后,笔者将利用过表达PtBBE9a拟南芥早花材料进行深入探究。
参考文献:
[1]Daniel B,Konrad B,Toplak M,et al. The family of berberine bridge enzyme-like enzymes:a treasure-trove of oxidative reactions[J]. Arch Biochem Biophys,2017,632:88-103.
[2]Winkler A,Lyskowski A,Riedl S,et al. A concerted mechanism for berberine bridge enzyme[J]. Nat Chem Biol,2008,4(12):739-741.
[3]Winkler A,Puhl M,Weber H,et al. Berberine bridge enzyme catalyzes the six electron oxidation of(S)-reticuline to dehydroscoulerine[J]. Phytochemistry,2009,70(9):1092-1097.
[4]Winkler A,Hartner F,Kutchan T M,et al. Biochemical evidence that berberine bridge enzyme belongs to a novel family of flavoproteins containing a bi-covalently attached FAD cofactor[J]. J Biol Chem,2006,281(30):21276-21285.
[5]Klok E J,Wilson I W,Wilson D,et al. Expression profile analysis of the low-oxygen response in Arabidopsis root cultures[J]. Plant Cell,2002,14(10):2481-2494.
[6]Li W X,Oono Y,Zhu J,et al. The Arabidopsis NFYA5 transcription factor is regulated transcriptionally and posttranscriptionally to promote drought resistance[J]. Plant Cell,2008,20(8):2238-2251.
[7]Goda H,Sawa S,Asami T,et al. Comprehensive comparison of auxin-regulated and brassinosteroid-regulated genes in Arabidopsis[J]. Plant Physiol,2004,134(4):1555-1573.
[8]Redman J C,Haas B J,Tanimoto G,et al. Development and evaluation of an Arabidopsis whole genome Affymetrix probe array[J]. Plant J,2004,38(3):545-561.
[9]Rashotte A M,Carson S D,To J P,et al. Expression profiling of cytokinin action in Arabidopsis[J]. Plant Physiol,2003,132(4):1998-2011.
[10]Becker J D,Boavida L C,Carneiro J,et al. Transcriptional profiling of Arabidopsis tissues reveals the unique characteristics of the pollen transcriptome[J]. Plant Physiol,2003,133(2):713-725.
[11]Johnston A J,Meier P,Gheyselinck J,et al. Genetic subtraction profiling identifies genes essential for Arabidopsis reproduction and reveals interaction between the female gametophyte and the maternal sporophyte[J]. Genome Biol,2007,8(10):R204.
[12]Wuest S E,Vijverberg K,Schmidt A,et al. Arabidopsis female gametophyte gene expression map reveals similarities between plant and animal gametes[J]. Curr Biol,2010,20(6):506-512.
[13]Daniel B,Pavkov-Keller T,Steiner B,et al. Oxidation of monolignols by members of the berberine bridge enzyme family suggests a role in plant cell wall metabolism[J]. J Biol Chem,2015,290(30):18770-18781.
[14]施天元. 毛果楊BBE基因家族及部分基因的功能解析[D]. 哈尔滨:东北林业大学,2020.
[15]Clough S J,Bent A F. Floral dip:a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana[J]. Plant J,1998,16(6):735-743.
[16]Liu J W,Zhou W B,Liu G F,et al. The conserved endoribonuclease YbeY is required for chloroplast ribosomal RNA processing in Arabidopsis[J]. Plant Physiol,2015,168(1):205-221.
[17]Foster C E,Martin T M,Pauly M. Comprehensive compositional analysis of plant cell walls (lignocellulosic biomass) part Ⅰ:lignin[J]. J Vis Exp,2010,37:e1745.
[18]Wang Y W,Wang W C,Jin S H,et al. Over-expression of a putative poplar glycosyltransferase gene,PtGT1,in tobacco increases lignin content and causes early flowering[J]. Exp Bot,2012,63(7):2799-2808.
[19]Xiao C,Barnes W J,Zamil M S,et al. Activation tagging of Arabidopsis POLYGALACTURONASE INVOLVED IN EXPANSION2 promotes hypocotyl elongation,leaf expansion,stem lignification,mechanical stiffening,and lodging[J]. Plant J,2017,89(6):1159-1173.荊玲侠,卜朝阳,崔学强,等. 素馨属植物ISSR-PCR反应体系的建立和优化[J]. 江苏农业科学,2020,48(23):71-79.
